以红小豆或绿豆为基料低GI值冲调粉功能评价
2020-12-22肖萍刘欣悦王雪王步江王聪刘金福
肖萍,刘欣悦,王雪,王步江,王聪,刘金福,*
(1.天津农学院食品科学与生物工程学院,天津300392;2.天津市农副产品深加工技术工程中心,天津300392)
随着生活节奏加快、饮食习惯改变及人口老龄化问题的进一步突出,糖尿病、肥胖症等胰岛素抵抗相关的慢性疾病比例不断上升,已成为目前全球性重大的公共卫生问题[1]。食物血糖生成指数(glycemic index,GI)是指含50 g可利用碳水化合物的食物与相当量的葡萄糖在一定时间(一般为2 h)内,体内血糖反应水平的百分比。根据GI值大小可将食物血糖生成指数划分为 3 个等级:GI≤55,低血糖生成指数食物;55<GI≤70,中等血糖生成指数食物;GI>70,高血糖生成指数食物[2]。研究发现,食用低血糖生成指数食物可抑制餐后血糖升高,减少一天内GI的变化幅度,降低血清胆固醇和甘油三酯水平[3]。因此,开发低血糖生成指数食品成为了慢性疾病营养防治的一个新热点。如低血糖生成指数豆乳粉[3]、挂面[4]、面包[5]、八宝粥[6]、罗汉果营养粉[7]等。
冲调食品作为即食食品的一类型具有方便携带、食用省时、营养成分高、功能特性强等特点,深受消费者青睐。目前制备冲调粉的原料包括黑豆、黑木耳、黑枣、燕麦、鹰嘴豆、大豆等,但以红小豆或绿豆为主要原料生产低GI值营养冲调粉的研究报道则较少。
红小豆,又名赤豆,膳食纤维含量较高,并且含有减慢消化速率的碳水化合物,研究表明:以红豆为主要餐食的人餐后血糖上升速度较慢,血糖指数在60以下[8];绿豆也称青小豆,有粮食中的“绿色珍珠”的美誉,在高蛋白、中淀粉、低脂肪类的食物中,绿豆占有一席之地[9],研究发现,以绿豆为原料开发的绿豆挂面为低血糖生成指数食品,适合糖尿病人食用[10]。
课题组前期利用低温焙烤技术并运用线性规划的方法设计开发了以红小豆或绿豆为基料的营养冲调粉,其GI值分别为49.6和35.7,均为低GI值食品。本文旨在前期产品开发的基础上,进一步对以红小豆或绿豆为主要原料的低GI值冲调粉的糖脂代谢、氧化应激、调节肠道微生态的功能方面进行探讨,为开发适合糖尿病、肥胖人群食用的健康食品提供理论支撑。
1 材料与方法
1.1 材料与试剂
红小豆、绿豆、薏米:天津市红旗农贸批发市场;燕麦麸皮:张家口新素燕麦食品科技有限公司;板栗粉:迁西神栗食品股份有限公司。
高脂饲料、基础饲料:北京军事医学科学院实验动物中心;链脲霉素(streptozotocin,STZ)、LBS培养基、EMB培养基、胰岛素(insulin,INS)酶联免疫吸附测定试剂盒:北京索莱宝科技有限公司;甘油三酯(triglyceride,TG)、胆固醇(total cholesterol,TC)、高密度脂蛋白(high density lipoprotein,HDL)、低密度脂蛋白(low density lipoprotein,LDL)、总抗氧化能力(total antioxidant capacity,T-AOC)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、丙二醛(malondialdehyde,MDA)测试盒:南京建成生物工程研究所;短链脂肪酸(乙酸、丙酸、丁酸)标准品:上海麦克林生化科技有限公司;乙腈(色谱纯):天津市康科德科技有限公司;其他试剂均为分析纯。
1.2 仪器与设备
Agilgent 1260高效液相色谱仪:美国安捷伦公司;LGR20-W高速冷冻离心机:北京京立离心机有限公司;BXM-30R立式压力蒸汽灭菌器:上海博讯实业有限公司;ELx800酶标仪:美国BIO-TEK公司;Tissueprep快速组织细胞破碎仪:天津杰灵仪器制造有限公司。
1.3 实验方法
1.3.1 动物模型的建立及饲喂
清洁级健康昆明雄性小鼠(13 g~15 g),饲养于动物室内,室温20℃~25℃,明暗各12 h。适应性喂养一周后,随机分为6组,即:饲喂常规普通饲料的空白组、自制红豆营养冲调粉饲料的红豆组(红豆营养冲调粉配方:红小豆58%、薏米10%、麸皮25%、板栗2%、罗汉糖5%,GI值49.6)、自制绿豆营养冲调粉饲料的绿豆组(绿豆营养冲调粉配方:绿豆55%、薏米2%、麸皮35%、麦苗粉3%、罗汉糖5%,GI值35.7)、高脂饲料模型空白组、高脂饲料+自制红豆饲料的模型红豆组、高脂饲料+自制绿豆饲料的模型绿豆组。
2型糖尿病小鼠(type 2 diabetes mice,T2DM)模型:参照刘紫萱等方法建立T2DM模型[11]。造模成功后,模型空白组饲喂普通饲料,模型红豆组饲喂自制红豆饲料,模型绿豆组饲喂自制绿豆饲料28 d;同时,空白组、红豆组、绿豆组分别继续饲喂普通饲料、自制红豆饲料和自制绿豆饲料28 d。
1.3.2 葡萄糖耐量试验及血糖下面积计算
参照李毅腾等方法进行试验并计算血糖下面积[12]。
1.3.3 血清指标测定
小鼠末次饲喂后禁食12 h,乙醚麻醉,摘眼球取血,血液 4℃静置 20 min,7 240×g离心 20 min,吸出上清液即为血清,贮存于-80℃冰箱中备用。按照试剂盒说明书测定 TG、TC、HDL、LDL、T-AOC、GSH-Px、SOD、MDA的含量。
1.3.4 蛋白质消化率的测定
24只健康清洁级昆明雄性小鼠,分为3组,每组8只,饲养于粪便代谢笼中,7 d为一周期,收集粪便,一周期结束后,将粪便烘干并粉碎,测定粪便中的蛋白质含量,按下式计算蛋白质消化率:
蛋白质消化率=(饲料中蛋白质含量-粪便中蛋白质含量)/饲料中蛋白质含量
1.3.5 小鼠粪便中肠道微生物的测定
粪便中乳酸杆菌和大肠杆菌数量统计采用梯度稀释涂布法,前者使用LBS培养基37℃厌氧培养48 h,后者使用EMB培养基37℃有氧培养24 h,培养结束后记录菌落个数并以log10 CFU/g表示。
1.3.6 小鼠肠道中短链脂肪酸(short chain fatty acids,SCFAs)含量测定
1.3.6.1 色谱分析条件
采用Venusil ASB C18色谱柱(4.6 mm×250 mm,5 μm)进行分析,流动相为0.1%磷酸溶液,流速为1 mL/min,进样量10 μL,柱温30℃,检测波长 210 nm。
1.3.6.2 SCFAs标准品的制备
准确称取0.1 g乙酸、丙酸和丁酸标准品,配制成0.1 g/mL标准品溶液;并利用超纯水将乙酸、丙酸和丁酸稀释成不同浓度的短链脂肪酸标准品溶液,过0.22 μm水系微孔纤维素滤膜后进行标准曲线的测定。
1.3.6.3 粪便样品SCFAs的测定
称取贮存于-80℃冰箱中的小鼠粪便0.5 g于离心管中,加入2 mL 0.1%磷酸溶液,置于4℃冰箱中12 h;在4℃条件下3 620×g离心10 min;吸取上层清液过0.22 μm水系微孔纤维素滤膜后进行测定。
1.3.7 数据处理与统计分析
所有数据均以均值±标准差表示。使用SPSS 23.0统计软件包进行统计学分析,组间均数比较组间用t检验,p<0.05具有统计学意义。
2 结果与分析
2.1 红小豆或绿豆为基料的低GI值营养冲调粉对T2DM小鼠糖脂代谢的影响
课题组前期按照糖尿病及肥胖人群全营养配方食品的技术要求,采用线性规划法进行营养冲调粉的配方设计,以红小豆或绿豆为基料的营养冲调粉GI值均小于55,并且通过对营养冲调粉的营养指标进行测定可知,2种营养冲调粉属于高蛋白质、高膳食纤维、低钠食品(见表1),适合糖尿病或肥胖人群食用。

表1 冲调粉营养成分表Table 1 Nutrition components of mixing powder
2.1.1 表征观察
在试验中观察到,正常组的小鼠活跃好动,动作敏捷,毛皮顺滑,干净整洁。造模成功后,小鼠表现出多饮、多食、多尿,体重下降等症状,并且呆滞嗜睡,反应迟钝,毛皮杂乱发黄。给予以红小豆或绿豆为基料的低GI营养冲调粉后,小鼠精神状态有所好转,毛皮光泽有所恢复。
适应性喂养后,前4周各组小鼠体重随小鼠生长均稳步上升,第5周将各模型组腹腔注射STZ建立T2DM小鼠模型,除正常组外,其他组别小鼠体重有所下降,饮水量急剧增多;通过饲喂自制红小豆或绿豆饲料后,与模型空白组比较,其体重降低、饮水、摄食量增加的状态有了明显改善。
2.1.2 冲调粉对小鼠糖代谢水平的影响
各组小鼠的葡萄糖耐量和血糖下面积(area under the curve of blood glucose,AUC)如图1和图 2所示。

图2 各组小鼠糖耐量测定对AUC的影响Fig.2 The effect on AUG of glucose tolerance in each group mice
各组小鼠灌胃葡萄糖后,血糖值在0.5 h达到最高水平,随后逐渐下降,2 h后恢复到正常水平;模型空白组小鼠的血糖水平一直维持在较高水平,而饲喂营养冲调粉后对小鼠的糖耐量有一定的改善作用。结合AUC结果,各组之间的AUC无显著性差异(p>0.05)。但是,各模型组AUC均比空白组高,空白组血糖下面积是红豆组的1.11倍,模型空白组血糖下面积分别是模型红豆组和模型绿豆组的1.06倍和1.10倍,说明红小豆和绿豆冲调粉不会增加小鼠的糖耐量水平,且在一定程度上可以降低小鼠的血糖值,适合糖尿病和肥胖人群食用。
2.1.3 冲调粉对小鼠血脂水平的影响
各组小鼠TG、TC、LDL、HDL的测定结果见表2。
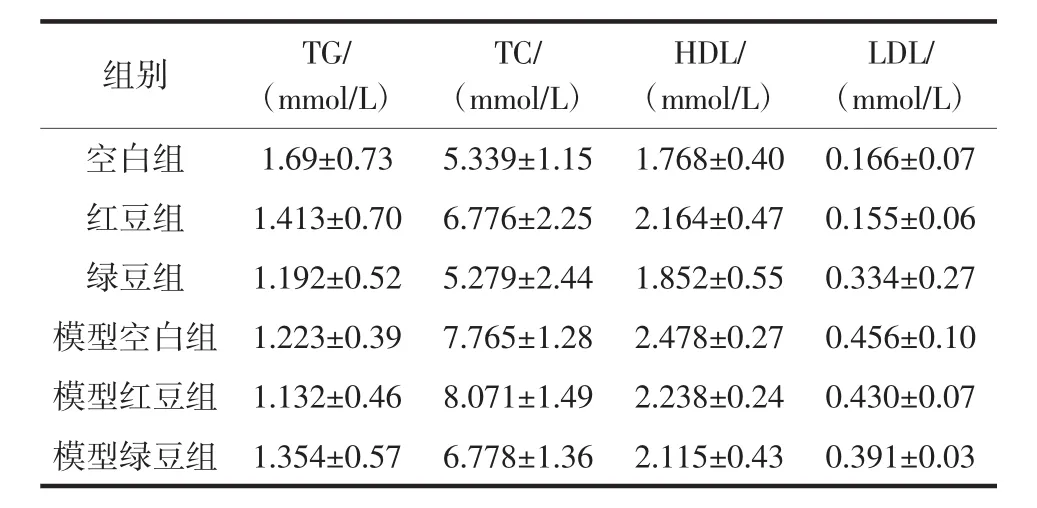
表2 各组小鼠TG、TC、LDL、HDL的测定Table 2 Determination of TG,TC,LDL,HDL of mice
由表2可知,与空白组比较,红豆组和绿豆组小鼠血清中TG、TC、HDL和LDL均无显著性差异;模型红豆组和模型绿豆组小鼠血清中TG、TC、HDL和LDL水平与模型空白组比较也没有显著性差异,说明食用冲调粉后不会影响小鼠的血脂水平。
2.2 红小豆或绿豆为基料的低GI值营养冲调粉对小鼠蛋白质消化率的影响
通过饲喂3种不同的饲料,测得蛋白质消化率结果如图3所示。
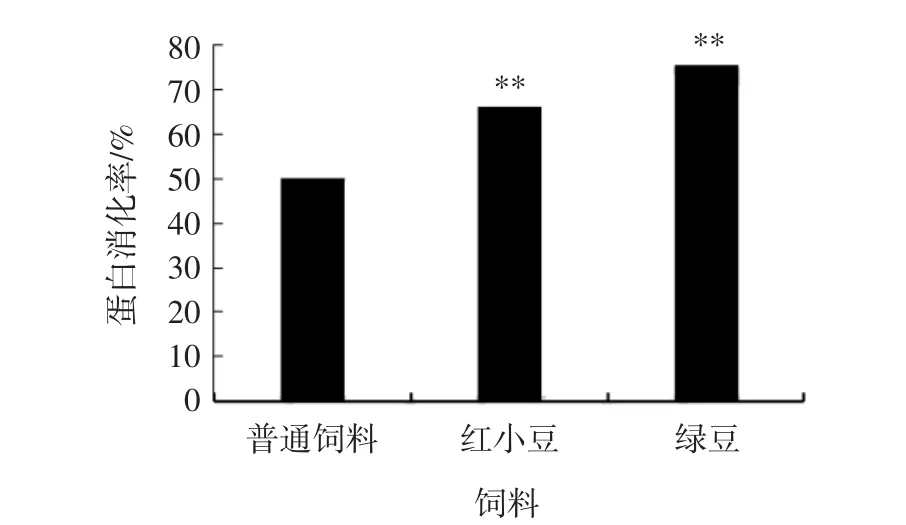
图3 3种饲料的体内蛋白质消化率结果Fig.3 Digestive rate of protein in three feeds
如图3所示,喂养普通饲料、红小豆产品自制饲料和绿豆产品自制饲料的小鼠一个周期后测定蛋白质消化率分别是52.52%、68.71%和77.27%。红小豆饲料和绿豆饲料的蛋白质消化率明显高于普通饲料(p<0.01),说明小鼠对红小豆和绿豆中蛋白质的消化吸收率更高,吸收利用率高说明营养价值更高。
2.3 红小豆或绿豆为基料的低GI值营养冲调粉对T2DM小鼠氧化应激水平的影响
2.3.1 冲调粉对血清中MDA水平的影响
冲调食品对小鼠血清中MDA含量的影响如图4所示。
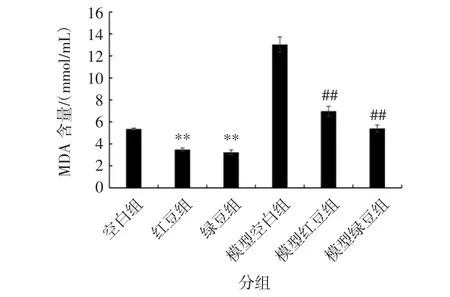
图4 各组小鼠血清MDA含量Fig.4 Determination of MDA in serum
由图4可知,空白组血清MDA含量低于模型空白组,表明高脂、高糖饮食会增大机体脂质过氧化程度。饲喂红豆冲调食品和绿豆冲调食品的各组小鼠血清MDA含量明显降低(p<0.01);与模型空白组比较,模型红豆组和模型绿豆组均可显著降低MDA水平(p<0.01)。
2.3.2 冲调粉对血清中T-AOC水平的影响
酶促体系和非酶促体系构成了机体的防御体系,它们通过减少氧自由基、使过氧化物分解和将催化反应的金属离子清除来起作用,测定T-AOC的高低可以反映机体防御体系抗氧化能力[13]。各试验组小鼠血清T-AOC测定结果见图5。
从图5可以看出各组小鼠血清中T-AOC水平,模型空白组低于空白组的血清T-AOC水平;饲喂红豆冲调食品的红豆组和模型红豆组血清T-AOC水平显著提高(p<0.01),而饲喂绿豆的组别,T-AOC水平提高,但无统计学意义(p>0.05)。
2.3.3 冲调粉对血清中GSH-Px活性的影响
各试验组小鼠血清GSH-Px测定结果见图6。

图5 各组小鼠血清T-AOC含量Fig.5 Determination of T-AOC in serum

图6 各组小鼠血清GSH-Px含量Fig.6 Determination of GSH-Px in serum
由图6可知,饲喂豆类冲调食品的组别组织中GSH-Px活性均呈增加趋势,其中绿豆组血清中的GSH-Px活性显著增高(p<0.01),红豆组血清GSH-Px活性显著提高(p<0.05),模型红豆组和模型绿豆组的血清GSH-Px活性有所提高,但在统计学中无意义(p>0.05)。
2.3.4 冲调粉对血清中SOD活性的影响
SOD是一种抗氧化酶,是机体内清除自由基的重要物质,它不仅可以保护细胞膜免受攻击,还可以修复受损的细胞。各试验组小鼠血清SOD活性测定结果见图7。
根据图7,模型空白组组织中的SOD活性低于空白组。红豆组、绿豆组和模型绿豆组血清SOD活性显著增加(p<0.01),模型红豆组的血清SOD活性也有所恢复,但不显著(p>0.05)。
2.4 红小豆或绿豆为基料的低GI值营养冲调粉对T2DM小鼠肠道微生物的影响

图7 各组小鼠血清SOD活性Fig.7 Determination of SOD in serum
乳酸杆菌是一种肠道内普遍存在的革兰氏阳性菌。它与其它肠道菌群配合可以分解食物中的多糖和纤维素,产生乳酸以促进消化,同时抑制有害菌的生长,消解其毒素。乳酸杆菌还可帮助在肠道内合成氨基酸、维生素并吸收一些微量元素[14]。大肠杆菌普遍被认为是一种机会致病菌,当肠道中有害菌的数量较多时,大肠杆菌会协助有害菌使肠道菌群失调[15]。因此,本文主要以粪便中乳酸杆菌和大肠杆菌的数量变化,分析冲调粉对小鼠肠道微生物的影响。
2.4.1 冲调粉对小鼠粪便中乳酸杆菌数量的影响
采用LBS培养基对各组小鼠粪便中乳酸杆菌的数量进行测定,结果如图8所示。

图8 各组小鼠粪便中乳酸杆菌数量Fig.8 Determination of Lactobacillus in fecal
如图8所示,绿豆组小鼠肠道内乳酸杆菌数比空白组高;与模型空白组小鼠相比,饲喂红豆或绿豆冲调食品的T2DM小鼠肠道内乳酸杆菌数量增加,且模型绿豆组的增加量高于模型红豆组。这可能是因为红豆和绿豆中营养成分具有改善肠道菌群的作用,如膳食纤维、抗性淀粉等成分有助于乳酸杆菌的生长[16]。
2.4.2 冲调粉对小鼠粪便中大肠杆菌数量的影响
采用EMB培养基对各组小鼠粪便中大肠杆菌的数量进行测定,结果如图9所示。

图9 各组小鼠粪便中大肠杆菌数量Fig.9 Determination of E.coil in fecal
从图9可以看出冲调粉对大肠杆菌数量的影响。与空白组相比,红豆组和绿豆组的小鼠肠道内大肠杆菌数量降低;模型红豆组和模型绿豆组的大肠杆菌数量也呈降低趋势。可以推测红豆、绿豆中的功能性成分抑制了其生长繁殖。有研究表明豆类中的低聚糖通过增殖益生菌,从而产生乳酸及短链脂肪酸,降低肠道内环境的pH值,抑制大肠杆菌的生长[17]。
2.5 红小豆或绿豆为基料的低GI值营养冲调粉对T2DM小鼠肠道SCFAs的影响
2.5.1 标准曲线的绘制
3种短链脂肪酸分离色谱图见图10。

图10 3种短链脂肪酸分离色谱图Fig.10 HPLC chromatogram of SCFAs
由图10可知,乙酸、丙酸、丁酸3种短链脂肪酸在高效液相色谱谱图上分离清晰,保留时间分别为5.453、11.539、31.493 min。以不同浓度的短链脂肪酸标准品溶液进行高效液相色谱分析,以峰面积,标准品浓度为横坐标,计算线性回归方程并进行相关性分析,结果如表3所示。
2.5.2 冲调粉对小鼠肠道内SCFAs的影响
从图11可以看出,与空白组相比,红豆组的小鼠粪便中乙酸含量提高程度明显(p<0.05),绿豆组小鼠粪便乙酸含量也有显著提升(p<0.01);模型空白组与模型绿豆组比较,模型绿豆组乙酸含量明显增高(p<0.05),模型红豆组也有所提高,但不具有统计学意义(p>0.05)。模型绿豆组丙酸含量显著高于模型组(p<0.01)。由于样品中丁酸含量较少,按照1.3.3中的色谱条件未能检测出。与空白组相比,红豆组和绿豆组小鼠粪便中总SCFAs含量显著增高(p<0.01);模型绿豆组的总SCFAs含量显著高于模型空白组(p<0.01),模型红豆组差异不具有显著性(p>0.05)。
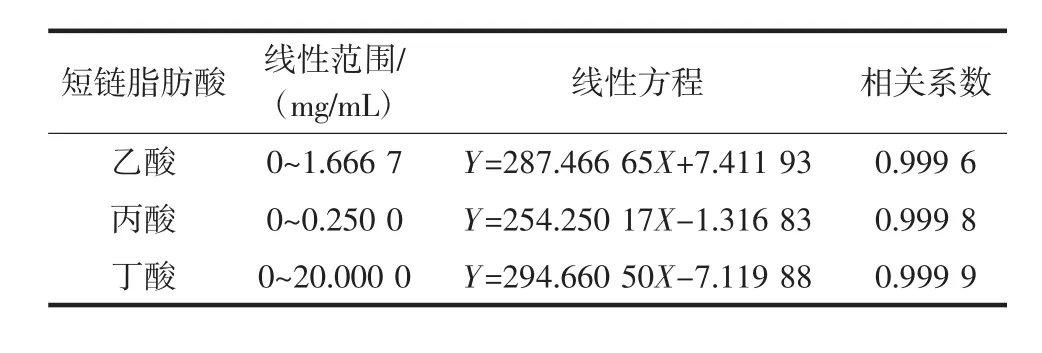
表3 3种短链脂肪酸线性范围、线性方程、相关系数Table 3 Linear range,linear equation,correlation coefficient of SCFAs

图11 各组小鼠粪便中SCFAs含量Fig.11 Determination of SCFAs in fecal
3 讨论与结论
本文测定了红小豆或绿豆为基料的低GI值营养冲调粉的营养成分,评价了营养冲调粉对正常小鼠和T2DM小鼠糖脂代谢、氧化应激、肠道微生物及肠道SCFAs水平的影响。结果表明:营养冲调粉是一种蛋白质和膳食纤维含量较高、血糖生成指数低的食品,适合糖尿病、肥胖人群食用。通过对其功能性研究发现,冲调粉可在一定程度上改善T2DM小鼠的血糖、血脂水平;且可使小鼠体内MDA含量显著降低,T-AOC水平、GSH-Px和SOD活性提高,部分组别改善效果明显(p<0.05),可见红小豆或绿豆为基料的低GI值营养冲调粉对机体内氧化应激水平有正向调节作用,这一结果也与Botero等的研究相符,即低GI值的膳食可以提高机体的总抗氧化能力[18]。其抗氧化作用可能与豆类中含有丰富的酚类、黄酮和花色苷[19]辅料中的麸皮含有较高的黄酮类、酚酸类物质有关[20];薏米中的多糖也是有效的抗氧化成分[21]。
本实验结果也显示出T2DM小鼠肠道乳酸杆菌数量降低,大肠杆菌数量升高;饲喂红豆、绿豆冲调食品的正常小鼠和T2DM小鼠,其粪便中有益的乳酸杆菌数量增加,而大肠杆菌数量降低。肠道在进行消化吸收时,肠道菌群发酵膳食纤维、抗性淀粉、低聚糖等成分的主要代谢物为SCFAs,SCFAs已被证实是肠道菌群向宿主传递生理效应最重要的信号分子之一,对改善结肠和宿主的健康起着至关重要的作用[22],其中乙酸和丙酸占比最高,主要在肝静脉系统中发挥功能,为肝糖异生等代谢提供近30%的能量[23]。试验中T2DM小鼠SCFAs总量(将乙酸和丙酸量的和看作总量)有所降低,饲喂红豆、绿豆冲调食品的正常小鼠或T2DM小鼠粪便中SCFAs总量提高(p<0.05),乙酸含量显著提高(p<0.05)。根据阚丽娇的研究,红豆和绿豆是膳食纤维和抗性淀粉的重要来源[19],实验证实膳食纤维和抗性淀粉可以提高肠道内SCFAs的含量,降低肠道pH值抑制病原菌生长和有害代谢产物形成,提高胰岛素敏感性[24-28]。因此该实验结果符合预期,推测红豆和绿豆冲调粉可以通过增加有益乳杆菌和SCFAs的水平调节肠道微生态。
因此食用该冲调食品不仅可以满足正常人群的营养需求,且可以增强机体的抗氧化水平和增加肠道有益菌、SCFAs的含量;而对于糖尿病人群,也可通过调节机体氧化应激水平和肠道微生态,缓解糖尿病等慢性疾病的发展。
