玉米萜类合成酶基因tps2的功能及其启动子功能区段鉴定
2020-12-21王丹李圣彦刘进平郎志宏
王丹 李圣彦 刘进平 郎志宏
(1. 海南大学热带作物学院,海口 570100;2. 中国农业科学院生物技术研究所,北京 100081)
玉米(Zea maysL.)是重要的粮食和经济作物,但虫害严重影响玉米的产量和品质[1]。防治害虫是保证玉米稳产和高产的关键因素。在漫长的进化过程中,植物对植食性昆虫形成了复杂的防御机制,以植物受到昆虫为害后采取的防御措施不同分为直接防御和间接防御[2-5]。植物通过产生有毒或不易消化的化合物等方式直接影响害虫的生理和行为,从而达到防御作用,这种方式被称为直接防御;间接防御是指植物受到昆虫为害后能够产生挥发性化合物,吸引害虫的天敌过来寄生或捕食,从而达到自我保护的防御方式。其中萜类化合物在玉米的防御反应中发挥着重要的作用[6]。
萜类化合物(异戊二烯类化合物)是植物产生种类最多的化合物,迄今为止报道的超过80 000种。萜类化合物在植物的生命活动中起着非常重要的作用,例如影响果实的风味[7],花的香味[8]和防御害虫[9-11]等。在植物的间接防御过程中,萜类化合物扮演着重要的角色,比如烟草(Nicotiana attenuata)通过释放挥发性萜类化合物(cis-3-Hexen-1-ol、linalool和cis-bergamot)吸引鳞翅目害虫的天敌,减少了鳞翅目害虫产卵率[12];玉米被鳞翅目幼虫啃食后会释放出大量的萜类挥发物,雌性寄生蜂会根据萜类挥发物来定位幼虫[13]。
植物的防御反应大多是通过不同的激素信号途径进行调控,植物萜类合成酶基因同样也受不同的激素信号途径调控。茉莉酸甲酯(MeJA)处理过的植物增加了挥发性萜类释放,吸引捕食者和寄生类动物:MeJA处理玉米幼苗,可提高叶片中tps10基因(Zm00001d024486)的表达,从而产生更多的(E)-β-farnesene和(E)-α-bergamotene[14];Yoshitomi等[15]发现JA诱导水稻(Oryza sativaL.)萜烯合酶tps24(Os04g27790)高表达,催化产生萜烯类挥发物并参与水稻防御系统。水杨酸(SA)可以直接被修饰形成其衍生物水杨酸甲酯(MeSA),MeSA也有类似的诱导萜类物质产生的功效[16]。用MeSA处理利马豆后增加了两个高萜类化合物的释放,它们能够吸引觅食的捕食螨(Tetranychus urticae)[17]。植物激素乙烯(ET)也在诱导萜类挥发物的产生和植物防御反应中发挥重要作用,在松树[18]、洋葱[19]和番茄[20]等多种植物中都观察到了昆虫危害后ET水平上升,用1-甲基环丙烯(一种乙烯感知抑制剂)阻止ET的感知可减少草食动物引起的挥发物释放[21],这表明ET在植物防御中发挥作用。
研究表明用机械损伤结合毛虫的口腔分泌物处理玉米幼苗,诱导tps2基因(Zm00001d015053)表达量显著升高[22],说明tps2基因与玉米的虫害应答相关。TPS2可以催化产生单萜烯、倍半萜烯和二萜烯——分别为芳樟醇(Linalool)、(E)-橙花叔醇((E)-nerolidol)和(E,E)-香叶基芳樟醇((E,E)-geranyllinalool)。橙花叔醇和香叶基芳樟醇可由P450单加氧酶CYP92C5(Zm00001d018839)和CYP92C6(Zm00001d007918)通过氧化降解转化为DMNT((3E)-4,8-dimethyl-1,3,7-nonatriene)和TMTT((E,E)-4,8,12-trimethyl-trideca-1,3,7,11-tetraene)。早 在1990年,Dicke等[23]发 现被螨虫侵害的利马豆(Phaseolus lunatus)能散发出DMNT和TMTT,吸引螨虫的寄生天敌——雌性智利小植绥螨(Phytoseiulus persimilis),之后又在多种植物中发现DMNT和TMTT的类似响应虫害的功效,为明确玉米TPS2的生物学功能及其表达调控机制,本研究以tps2基因及其启动子为研究对象,分析了植物激素(JA、SA、ET)和黏虫对tps2基因的诱导表达作用,利用转基因方法提高玉米中tps2基因的表达量,发现TPS2OE玉米植株对玉米螟的抗性提高,tps2启动子必需的功能区段在-183至-129之间,为下一步对tps2基因的调控机制研究打下基础。对TPS2生物学功能的研究,有助于我们在分子层面解析玉米的防御响应网络,了解植物防御害虫的机制,可以通过调控防御基因表达,使防御性化合物在植物中产生,以抵抗植食性昆虫攻击,为培育玉米抗虫抗逆新品种提供技术支持。
1 材料与方法
1.1 材料
玉米自交系B73种子由中国农业科学院生物技术研究所郎志宏课题组提供。
1.2 方法
1.2.1 玉米材料的种植 将营养土和蛭石按1∶1的比例混合均匀,装满小花盆(7×7×8 cm),每盆点播5粒玉米种子,深度约2 cm,托盘内浇足够的水。在人工气候室培养发芽,光周期设为16 h(L)/8 h(D),温度25℃,湿度40%左右,光照强度为12 000 lx。
1.2.2tps2生物信息学分析 玉米萜类合成酶进化树分析:在MaizeGDB(www.maizegdb.org/)网站上将玉米中已知的萜类合成酶基因的氨基酸序列下载,用MEGA7进行多序列比对,用Neighbor joining的方法做进化树分析。
玉米TPS2进化树分析:下载TPS2氨基酸序 列 在Phytozome(phytozome.jgi.doe.gov/)网 站 上BLAST,下载同源性相近蛋白的氨基酸序列。用MEGA7进行多序列比对,用Neighbor joining的方法做进化树分析。
1.2.3 植物材料的处理
1.2.3.1 植物激素处理玉米幼苗 选取两周大的玉米幼苗,分别用茉莉酸甲酯100 μmol/L,水杨酸30 μmol/L,乙烯利50 μmol/L(使用之前分别加入0.1%Tween20)进行处理。取样部位:叶片和根。用含0.1%Tween20的水喷施幼苗后立即取样,作为处理0 h样品,处理后2、4、6、8 h分别取样。取样后提取RNA,进行qRT-PCR检测。
1.2.3.2 虫害处理玉米幼苗 黏虫(Mythimna separata)卵块购自美延(北京)农业科技有限责任公司。卵块在28℃温箱中孵化出黏虫幼虫。用B73玉米叶片饲喂黏虫幼虫到3龄。选取两周大的玉米自交系B73幼苗进行虫害处理。在接种黏虫之前取样作为0 h。每棵玉米苗接一头黏虫幼虫,幼虫取食2、6、12、24 h时分别取玉米叶片和根提取RNA,进行qRT-PCR检测。
1.2.4 TPS2OE载体构建及转化 从Maize GDB(www.maizegdb.org/)网站下载玉米自交系B73的tps2CDS,用Primer Premier 5 软件设计无缝克隆引物,引物序列为:tps2-F:5'-TGTTGTTTGGTGTTAC TTCTGCAGATGTACTCTCTACCAGGAGC-3',tps2-R:5'- GAACGATCGGGGAAATTCGAGCTCTCAAAGCA CCAACATCATCG-3'。以JA处理2 h后的B73叶片cDNA为模板进行PCR扩增,50 μL反应体系:5×Buffer 10 μL,dNTP Mix 1 μL,正向和反向引物(10 μmol/L)各2 μL,模 板cDNA 1 μL,Phanta Super-Fidelity DNA Polymerase 1 μL,ddH2O 23 μL。PCR反应程序:95℃ 3 min;95℃ 10 s,60℃ 15 s,72℃ 90 s,33个循环;72℃ 10 min;15℃ 2 min终止反应。PCR 反应结束后,将产物进行1%琼脂糖凝胶电泳,回收并纯化目的片段(tps2CDS),无缝克隆试剂盒(Clone Smarter,美国)连接pCAMBIA3300-Ubi-nos载体,获得由玉米ubiquitin启动子驱动的tps2基因的双元载体pUTPS2N,转化玉米,获得阳性植株用于后续实验。
1.2.5 玉米叶片挥发物的GC-MS分析 测定材料为玉米自交系B73和转基因玉米TPS2OE。取两周大小玉米叶片20 mg,研磨成粉。42℃固相萃取45 min。采用GC-QTOF气质联用仪分析样品挥发物成分。色谱柱为EC5-MS色谱柱(长30 m,内径0.25 mm和厚度0.25 μm)。气相色谱参数设定如下:载气为氦气,流速1 mL/min,不分流模式。进样口温度设为220℃,升温程序:初始温度50℃ 2 min,以8℃/min升温至300℃,保持2 min。质谱参数设定如下:传输管温度270℃,离子源温度270℃,电离电位70 eV,扫描范围40-600 m/z。挥发性色谱图显示了总离子色谱图,其中包含同一扫描的所有质谱峰的强度总和。鉴别挥发性物质时,将MassHunter Qualitative DA Software与 质 谱 库Wiley8(Hewlett Packard)和Adams(Adams,2007)一起使用。一式三份进行测定,并通过软件(Aligent MassHunter Analysis)进行相对定量分析。
1.2.6 亚洲玉米螟行为选择实验 亚洲玉米螟(Ostrinia furnacalis)的虫蛹是由中国农业科学院植物保护研究所提供。自制纱网笼子(图1)的两侧分别摆放TPS2OE和对照B73玉米材料,中间位置摆放60个玉米螟蛹(40个雌蛹和20个雄蛹),设置3个生物学重复,并将纱网笼子放到光照培养箱中:设置光周期16 h(L)/8 h(D),光照强度12 000 lx,温度25-28℃,湿度40%-60%。
待蛹羽化成蛾后,在笼子里放3%蔗糖水,供成虫吸食补充营养。产卵结束后,成虫陆续死亡,再等5 d至幼虫孵化,啃食玉米幼苗,统计不同实验材料上的卵的个数、幼虫数目,并将每棵幼苗叶片分别拍照,根据照片中的比例尺,用Photoshop软件计算虫害面积(cm2)。对比实验组和对照组数据,使用SAS软件进行差异显著性分析,并用prism软件作图。

图1 玉米螟行为选择实验设计
1.2.7 启动子截短表达载体构建及原生质体瞬时表达分析 启动子截短及表达载体构建:在MaizeGDB(www.maizegdb.org/)网站下载tps2基因翻译起始位点上游1.5 kb的核酸序列,用Primer Premier 5软件设计无缝克隆引物(表1),PCR扩增获得5'端截短的不同长度tps2启动子,分别为968 bp、737 bp、485 bp、327 bp、227 bp、183 bp、129 bp、61 bp,将8个片段从大到小命名为F1-F8,通过无缝克隆连接到LUC双荧光载体pGreenⅡ 0800-Luc上。植物表达载体pGreenⅡ 0800-Luc上含有两个报告基因:海参荧光素酶基因(Ren)作为内参基因;萤火虫荧光素酶基因(Luc)作为目标启动子报告基因。通过两种荧光值的比值(Luc/Ren)来表征目标启动子的活性。
原生质体瞬时表达:根据李圣彦[24]描述的方案进行玉米叶片原生质体分离和PEG介导的转染,每次转化10-20 μg载体,每个载体进行3次生物学重复。孵育12 h后,收集原生质体细胞,并在液氮中速冻,用荧光素酶检测系统(Dual-Luciferase Reporter Assay System,Promega,美国)及化学发光检测仪(Promega GloMax,美国)测定双荧光值。
2 结果
2.1 玉米TPS2的生物信息学分析
玉米中已报道18个萜类合成酶,将18个萜类合成酶的氨基酸序列经进化树分析(图2)可以看出,有些序列相似性极高(图2),如tps4/tps5、tps6/tps11、tps2/tps3等,相似性在95%以上,只有个别氨基酸的差别,这些基因可能是基因组复制(Duplication)产生,基因功能是否存在冗余,将在下一步中研究。有些序列相似性很低,不同的萜类合成酶催化产生不同的单萜、二萜、倍半萜和多萜类物质,结构的不同导致各自的功能不尽相同,表达部位也存在差异,说明玉米萜类合成酶在进化上的复杂性。

表1 用于扩增不同长度tps2启动子的引物序列
在水稻、高粱、狗尾草、二穗短柄草和拟南芥中存在着与tps2基因相似性高的基因,通过同源检索,有Ostps、Sbtps14等基因与玉米tps2基因相似性高于90%,将这些基因与tps2基因进行进化树分析,tps2基因与来源于高粱、狗尾草和水稻的萜类合成酶基因聚在一起,并与双子叶植物拟南芥的萜类合成酶基因有很高的序列相似性(图3)。说明tps2基因在进化中具有高度保守性,TPS2能催化产生单萜、倍半萜和二萜烯类化合物,在植物防御反应中起着至关重要的作用。
2.2 不同激素和黏虫处理条件下tps2基因的表达模式
通过qPCR检测在3种激素处理条件下的不同时间点、不同组织部位中tps2的相对表达量(图4)。结果显示在B73中,tps2受JA、SA和ET诱导表达,表达部位主要是叶片,根部的表达量极低。其中,JA处理2 h时,叶片中tps2的相对表达量最高,升高了10倍左右(图4-A);SA处理4 h时,叶片中tps2的相对表达量达到最高,约升高了20倍(图4-B);ET处理6 h后,tps2的表达量达到顶峰,约升高了8倍(图4-C);黏虫(AW)危害2 h后tps2的表达量显著升高,约提高了15倍(图4-D)。植物的防御反应多是通过不同的激素信号途径进行调控,尤其是JA信号途径与防御害虫反应直接相关。实验结果表明JA、SA、ET都对tps2有诱导作用,但是其诱导反应的时间不同。虫害处理直接导致了tps2的高表达,说明tps2参与了防御害虫的信号通路。

图2 玉米萜类合成酶进化树分析
2.3 转基因玉米TPS2OE的获得及相关基因转录水平检测
为了研究tps2基因的生物学功能,构建tps2基因的超表达载体,利用农杆菌介导法转化玉米,共获得5个独立转化体,对5个转化体中tps2基因转录水平最高的TPS2OE-1转化体做进一步的分析。
TPS2OE幼苗通过实时荧光定量PCR(Quantitative Real-time PCR,qPCR)检测tps2的相对表达量,B73作为对照材料。检测结果显示与B73相比,TPS2OE叶片和根中的tps2的表达量均显著上升,在叶片中提高了12倍,在根中提高了143倍(图5)。结果表明在转录水平上tps2基因表达得到了显著提高。
TPS2诱导底物产生橙花叔醇和香叶基芳樟醇,再由P450单加氧酶CYP92C5和CYP92C6进一步氧化降解为DMNT和TMTT。qPCR检测cyp92c5和cyp92c6基因在转录水平的表达情况,结果表明cyp92c5在B73和TPS2OE中表达量极低;cyp92c6则有较高的表达量,且叶中表达量显著高于根;cyp92c6在B73和TPS2OE中的表达量无明显差异,说明tps2基因的过表达并未影响cyp92c5和cyp92c6基因的表达情况(图6)。
2.4 GC-MS检测TPS2OE的挥发性萜类表达量增高
B73和TPS2OE叶片材料用液氮研磨成粉,顶空吸附进样。用气质联用仪(GC-MS,Agilent 7200 Accurate-Mss Q-TOF)检测TPS2主要催化产物TMTT的含量差别。GC-MS检测结果显示:与对照组B73相比,TPS2OE中TMTT产量明显升高(图7)。
2.5 TPS2对玉米螟行为选择的影响
将亚洲玉米螟蛹置于B73和TPS2OE幼苗之间,玉米螟羽化成蛾后在B73和TPS2OE幼苗上的产卵数无显著差别,表明TPS2OE对成虫的产卵选择无影响(图8-A);然而B73幼苗上栖息的幼虫数显著高于TPS2OE(图8-B),由此推测TPS2OE产生过多的萜类挥发物抑制了玉米螟虫卵的孵化,或者对玉米螟幼虫有驱避作用;此外,TPS2OE幼苗受到的危害面积显著小于B73组(图8-C),说明过表达tps2基因能在一定程度上增强防御玉米螟的能力。
2.6 tps2启动子截短和植物表达载体的构建
PCR扩增不同长度的tps2启动子序列(图9-A),并且通过无缝克隆试剂盒连接到目的载体pGreenⅡ0800-Luc上(图9-B)。
2.7 tps2启动子的必需的功能区段为-183至-129
分析截短不同长度的启动子片段的荧光比值(Ratio)差异。当启动子长度大于等于227 bp时,Ratio基本保持在0.5左右;当启动子为183 bp时,Ratio达到最大值约1.5;但是继续截短到129 bp,则Ratio约为0,即该启动子片段没有启动转录的活性(图10)。说明tps2启动子必需的功能区段在-183至-129之间,并且-227至-183之间存在负调控元件,或者该区段能产生二级结构,对启动转录活动起到抑制作用。

图3 玉米TPS2和其他物种的萜类合成酶系统发育树
3 讨论
植物激素是调节生长发育的低浓度小信号分子,大量研究表明,它们在激活植物的自我保护系统中起着重要的作用[25-26],其中SA、JA和ET是针对多种病原体和植食性昆虫的抗性信号网络的关键调节因素[27-28]。萜类化合物是植物防御的关键次生代谢物,而植物的防御与植物激素代谢通路息息相关。在玉米自交系B73中,JA、SA、ET都对tps2有诱导作用,但是其诱导反应的时间不同,tps2参与植物激素信号通路的反应时间不同,可能与各信号途径之间的crosstalk相关。虫害处理直接导致了tps2的高表达,说明tps2参与了防御害虫的信号通路。已知JA、SA和ET的信号通路在各个节点之间相互作用,例如激素响应转录因子以调节植物防御反应[29]。但是,值得注意的是,植物在胁迫条件下适当防御反应和持续生长是适应环境的关键特征。而且,植物响应不同胁迫而激活的防御反应取决于激素信号传导途径之间的crosstalk(正向或负向),而不仅取决于每种激素的单独贡献[30]。例如,引发SA介导的防御反应的丁香假单胞菌感染拟南芥植物,通过抑制ET/JA信号传导途径,导致对坏死菌的抵抗力大大降低[31]。玉米tps2基因在JA、SA和ET不同激素信号通路中如何受多重调控以及在不同激素的crosstalk中如何行使功能需要进一步研究。
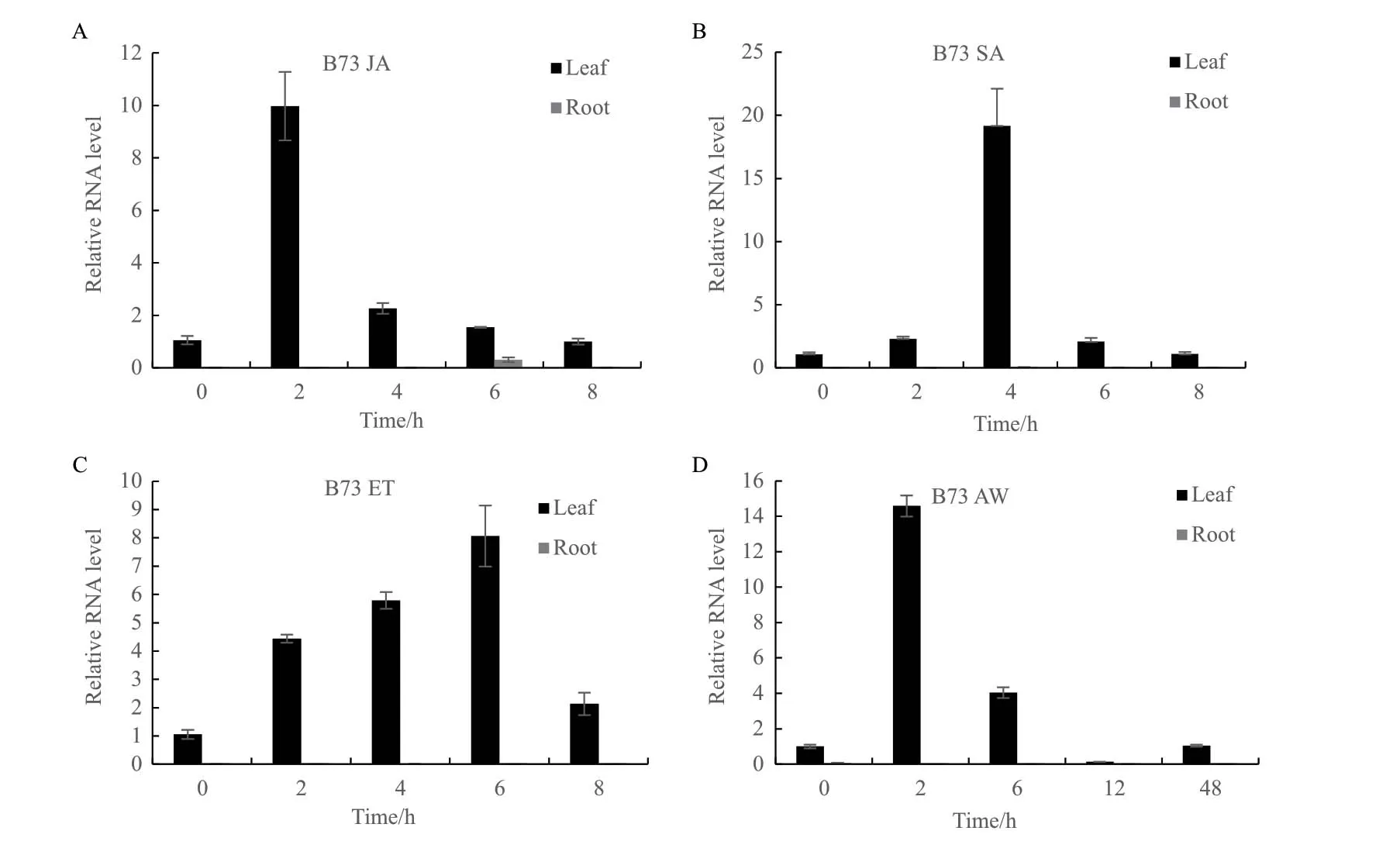
图4 不同植物激素(JA、SA和ET)和黏虫(AW)诱导tps2基因表达分析
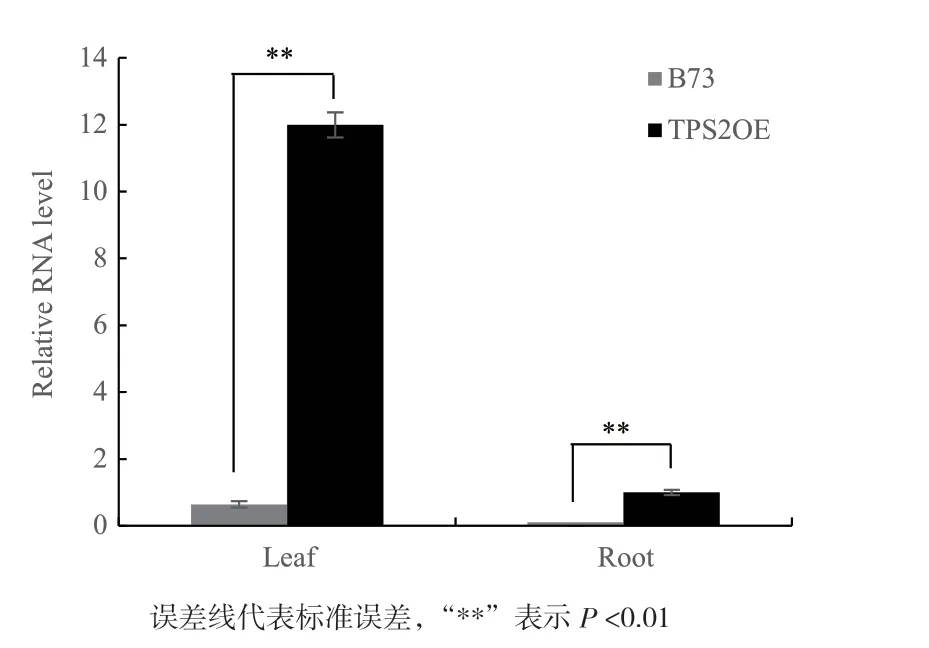
图5 在转录水平上B73和TPS2OE植株中tps2基因的表达情况
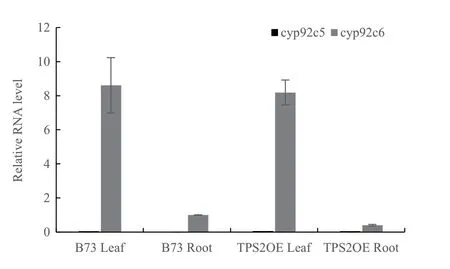
图6 cyp92c5和cyp92c6基因在B73和TPS2OE中的表达情况
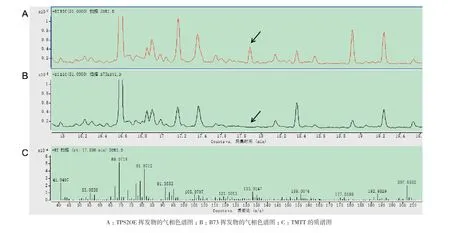
图7 TPS2OE和B73玉米中TMTT的GC-MS分析
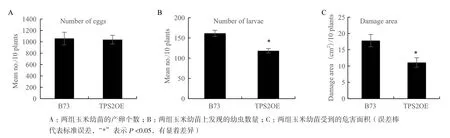
图8 玉米螟对B73和TPS2OE幼苗的行为选择
为了明确TPS2的功能,构建了tps2基因的超表达载体,转化获得转基因玉米TPS2OE,在TPS2OE玉米叶片中tps2转录水平较自交系B73增加了12倍,在根中表达量提高了143倍。同时TPS2的主要催化产物TMTT也得到显著提升。有研究表明,萜类化合物对一些害虫具有驱避性,如Bruce等[32]研究表明顺式茉莉酸处理后的棉花能够诱导TMTT产生,并且其对棉蚜有驱避作用。本研究发现TPS2OE和B73玉米对玉米螟幼虫数量和叶片的危害程度存在显著差异,说明TPS2在玉米的害虫防御中起着重要作用,但导致这一结果的原因是萜类挥发物抑制了玉米螟虫卵的孵化,还是对玉米螟幼虫有驱避作用还有待进一步研究。此外,前人研究发现植物产生的DMNT和TMTT还起到间接防御的作用。Turlings等[13]发现害虫褐边绿刺蛾(Latoia consocia)能诱导玉米产生DMNT和TMTT,并有效地吸引了雌性甜菜夜蛾盘绒茧蜂(Cotesia marginiventris)定位宿主并寄生;棉花被毛虫取食后都能够释放出DMNT和TMTT,并且强烈地吸引害虫天敌——雌性寄生蜂[33];DMNT和TMTT还诱导邻近的未受害虫侵害的植物发生防御反应,与未处理的利马豆植株相比,放在二斑叶螨诱导气体物质中的利马豆植株对二斑叶螨有更高的抗性[34]。下一步我们也将针对TPS2OE玉米植株对寄生蜂的行为选择进行研究。
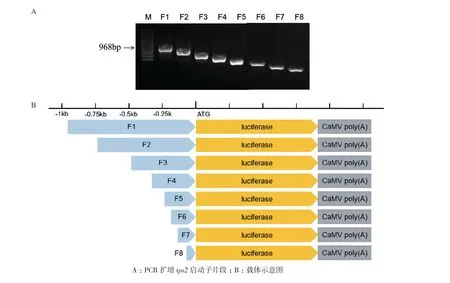
图9 截短tps2启动子系列载体示意图

图10 LUC双荧光分析tps2启动子活性
亚洲玉米螟是我国玉米的主要害虫,二代玉米螟多发生在抽丝盛期,对玉米籽粒危害严重。因此防治二代玉米螟对玉米籽粒的危害对玉米生产具有非常重要的意义。玉米苗期叶片中tps2基因受虫害诱导表达,产生DMNT和TMTT吸引害虫的天敌[33],那么在玉米花粒期中tps2基因是否也发挥着同样的作用?已有的研究表明正常条件下tps2基因在玉米籽粒中并不表达[35],但对于虫害或激素处理后玉米籽粒中tps2基因的表达情况并不清楚。在后续工作中我们将会对玉米雌穗(花丝、苞叶、籽粒)中tps2基因的表达模式进行研究,探究tps2基因在玉米花粒期的功能。
启动子区段的顺式作用元件与转录因子和调控小分子结合调控基因表达,tps2基因受多种激素诱导表达,在tps2的启动子区段是否存在调控的激活区或者抑制区需要对启动子进行分析,通过tps2启动子5'端截短实验发现tps2启动子的必需的功能区段为-183至-129之间,在-227至-183区段存在负调控元件[36],因为-227至-183区段的缺失使启动子活性提高了2倍。目前对负调控元件的研究并不多,可以通过tps2启动子3'端截短等方法,进一步确定其基元序列,从而进一步探究tps2的表达调控方式。
4 结论
Tps2是玉米防御反应中的重要基因,qPCR结果表明tps2受植物激素(JA、SA、ET)和黏虫的诱导表达。通过qPCR及GC-MS对超表达tps2基因玉米检测分析,TPS2OE植株中的tps2转录水平明显提高,且其主要催化产物TMTT也显著高于B73。玉米螟行为选择结果显示,TPS2OE幼苗对雌蛾的产卵影响不大,但TPS2OE幼苗上玉米螟幼虫较少,玉米叶片受到的危害较低,TPS2OE植株能够在一定程度上增加玉米的自我防御能力。Tps2启动子必需的功能区段在-183至-129之间,且-227至-183区段可能存在负调控元件。
