一株野生黑木耳菌株的鉴定及其栽培特性研究
2020-12-21刘岩岩刘俊杰
刘岩岩 张 敏 李 红 刘俊杰
(辽宁省农业科学院食用菌研究所,辽宁沈阳110161)
黑木耳又称木耳、光木耳、云耳、树耳、木娥等,真菌学分类中属担子菌门、银耳目、木耳科[1]。黑木耳是我国传统的出口商品之一,目前我国的黑木耳年产量占全球产量的90%以上。辽宁省是仅次于黑龙江、吉林的黑木耳生产大省,栽培品种黑29、8808、黑威系列、新科等多为野生种质直接驯化而来,杂交品种的亲本大多也是野生种质。野生黑木耳具有分布广泛、适应性强和抗性强等特点。野生黑木耳主要分布在黑龙江大兴安岭、小兴安岭,吉林长白山,辽宁东部山区,广西的桂西、桂西北地区、陕西大巴山和秦岭山脉、四川东部、西藏、新疆等地[2-3],其经过长期的进化和演变积累了丰富的遗传资源,遗传多样性好,弥补了栽培种质遗传背景单一的缺陷。黑木耳野生菌株的驯化,为黑木耳品种选育、复壮、改良提供了有效的生物资源,同时也为增加黑木耳的遗传多样性和创造新物种提供了可能[4]。
传统的真菌分类主要按照真菌的子实体的形态、颜色、气味以及孢子特征等。形态特征不仅容易受到生长环境的影响而表现出较大的差异,而且形态特征是易变的、模糊的,同时真菌的种类众多,个体多态性强,因此传统的分类学指标常常会得到错误的结果。相反,以DNA 核苷酸序列为基础的基因型则相对稳定,不易受环境影响,而且在生活史任何阶段均可获得,因而以DNA 分子序列进行种类鉴定其结果更加准确可靠[5]。rDNA 内转录间隔区(internal transcribed spacer,ITS)位于核糖体 rDNA中,包括18S 和28S 基因之间的区域片段,由于ITS区域片段较小,长度一般为650~750 bp,易于分析,是中度保守的序列,其表现为种内相对一致,种间具有高度特异性,且含有大量的通用引物。这些特征使ITS 在真菌物种的分类鉴定以及系统发育研究应用最为广泛。因此笔者也用ITS 对黑木耳野生菌株进行鉴定,为黑木耳的驯化栽培提供理论依据。
1 材料与方法
1.1 供试菌株
野生黑木耳菌株,来自辽宁省本溪市东营坊乡老边沟风景区。对照菌株为:黑29、纯黑山、黑威15,为辽宁省农业科学院食用菌研究所保存。
1.2 供试培养基
①综合马铃薯培养基(PDA):马铃薯200 g,葡萄糖20 g,MgSO42 g,KH2PO41.5 g,琼脂18 g,自来水定容至1 000 mL,pH 自然。用于野生菌株的分离、鉴定及分离菌株母种的制备。②栽培料:木屑85.5%,麸皮10%,豆饼粉2%,石膏1%,石灰1.2%,磷酸二氢钾0.3%,料含水量65%。用于分离菌株原种及栽培种的制备。
1.3 子实体形态观察
取子实体完整部分,观察并描述其表面性状、结构、颜色,并进行形态学特征初步鉴定。
1.4 野生菌株的分离及菌种的制备
用75%酒精棉球擦拭干耳片表面2~3 遍,将耳片四周边缘剪去后,剪取远离耳基最平整部位的耳片0.5 cm×0.2 cm,用镊子夹取该组织块在酒精灯火焰外焰上方来回快速穿梭2~3 次(每次1~2 s)后,插入PDA 斜面培养基中。23 ℃避光培养,待长出菌丝后转入空白PDA 斜面培养基上纯化培养,获得一级菌种即母种。
1.5 ITS测序及分析
1.5.1 DNA提取
取新鲜菌丝体0.3 g 左右,低温充分研磨后,采用E.Z.N.A.Fungal DNA Kit 试剂盒提取总DNA,提取物经1.0%琼脂糖凝胶电泳检测,分装后,于-20 ℃条件下保存[6]。
1.5.2 PCR扩增
采用真菌通用引物(ITS1:5'-TCCGTAGGT⁃GAACCTGCGG-3' 和 ITS4:5'- TCCTCCGCTTATT⁃GATATGC-3')进行扩增。扩增体系:总体积20 μL,其中2×Easy Taq Mix 10 μL,引物各1 μL,模板DNA 1 μL,ddH2O 7 μL。
PCR 扩增反应程序:95 ℃预变性4 min,95 ℃变性 30 s,57 ℃退火 30 s,72 ℃延伸 60 s,30 个循环,72 ℃延伸7 min。PCR 反应产物经1.0%琼脂糖凝胶电泳检测后,送检目的条带进行测序。测序公司:北京诺赛基因组研究中心有限公司,Sanger测序,双向测序。将测序获得的序列通过NCBI 进行Blast 比对分析,分析同源性[7]。
1.5.3 系统进化分析
应用Mega 6.0 软件,以Gene bank 中银耳科盘革耳属(Eichleriella deglubens)ITS 序列为聚类外群,bootstrap 次数 1 000,采用最大似然法(Maximum likelihood methods,ML)构建系统发育树。
1.6 拮抗试验
把分离菌株与主栽菌株进行拮抗试验,3 个一组进行组合,每个菌种用直径0.5 cm 的打孔器打取3 个菌丝块,交叉循环,设置3 个重复。每个平皿接种3 个菌株,按“品”字形排列。菌丝块间距3 cm 左右,置于23 ℃,黑暗条件培养。观察分离菌株与主栽菌株间拮抗线状态,分析相互间亲缘关系远近。
1.7 菌丝培养特性研究
1.7.1 母种培养阶段菌丝生长情况
将供试的菌株分别接到PDA 平板(直径9 cm)培养基上,23 ℃避光培养,每天测定并记录菌丝生长速度及长势。
1.7.2 原种培养阶段菌丝生长情况
将供试菌株母种接到原种培养基上,容器规格为500 mL 罐头瓶。每个菌株100 瓶,23 ℃避光培养,每天测定并记录菌丝定植及生长情况。
1.7.3 栽培种培养阶段菌丝生长情况
将供试菌株原种接到栽培种培养基上,容器规格为17 cm×33 cm聚乙烯塑料袋。每个菌株200袋,23 ℃避光培养,每天测定并记录菌丝定植及生长情况。
1.8 栽培特性研究
经过后熟期的栽培种菌袋,采用露地全光标准栽培模式管理,定时扎眼、催芽。观察记录催芽情况、污染袋数、满袋时间、子实体性状及产量等。
2 结果与分析
2.1 子实体形态特征
野生黑木耳菌株耳片深黑色,大部分耳状,厚度0.7 cm 左右,边缘圆正,少筋或无筋,干耳背面有纤毛,颜色灰白,稀疏。

图1 野生黑木耳生态照
2.2 ITS序列扩增
采用通用引物ITS1/ITS4进行序列扩增,均得到清晰的大小约为600 bp 的特异性条带,这与Gen⁃Bank 中所报道的黑木耳ITS 序列长度基本一致,可以进一步用于测序[8]。

图2 ITS-PCR琼脂糖电泳
2.3 系统进化分析
从聚类图(图3)可见,野生菌株 M 与LC373472.1(Auricularia villosula)的序列同源性较高,达100%。鉴定野生菌株为木耳属[7],黑木耳种。
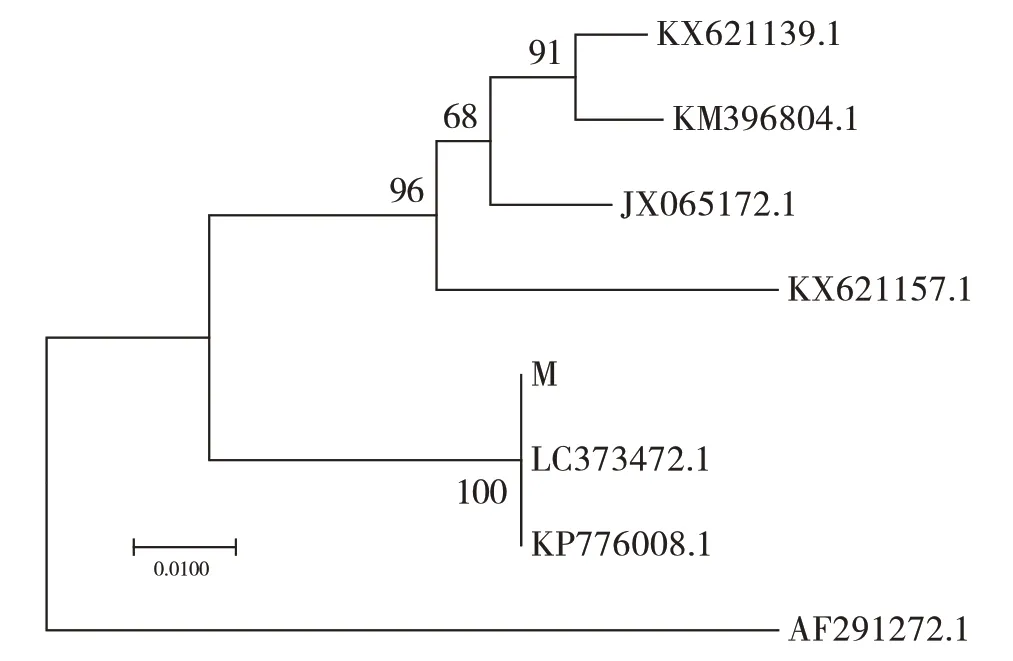
图3 基于ITS序列构建的系统发育树
2.4 拮抗试验
由表1 可以看出,野生黑木耳菌株与对照菌株均有明显的拮抗线,说明野生黑木耳菌株与本地主栽菌株亲缘关系较远,排除菌种漂移的可能性,是新的种质资源。
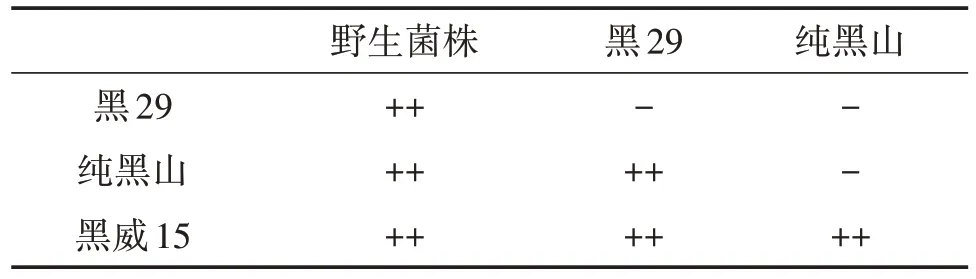
表1 拮抗试验结果

图4 供试黑木耳菌株拮抗状态
2.5 菌丝培养特性研究
2.5.1 母种培养阶段菌丝生长情况
由表2可以看出,野生黑木耳菌株菌丝浓白,菌落边缘整齐,无色素分泌,菌丝生长速度与其他三个主栽菌株无明显差异。

表2 供试菌株在母种培养阶段菌丝生长情况
2.5.2 原种培养阶段菌丝生长情况
由表3可以看出,野生黑木耳菌株菌丝洁白,长势浓密、粗壮,定植快,污染率较低,抗性强,菌丝生长速度与其他三个主栽菌株无明显差异。

表3 供试菌株在原种培养阶段菌丝生长情况
2.5.3 栽培种培养阶段菌丝生长情况
由表4可以看出,野生黑木耳菌株菌丝洁白,长势浓密、粗壮,定植快,污染率较低,抗性强,菌丝生长速度明显快于黑威15,与其他两个主栽菌株无明显差异。

表4 供试菌株的栽培种培养阶段菌丝生长情况
2.5.4 栽培特性研究
由表5可以看出,野生黑木耳菌株现耳时间短,出芽率较高,耳片单生,边缘圆正,耳片厚,颜色深,产量高等优良栽培性状,为黑木耳品种选育、复壮、改良提供了新的种质资源。
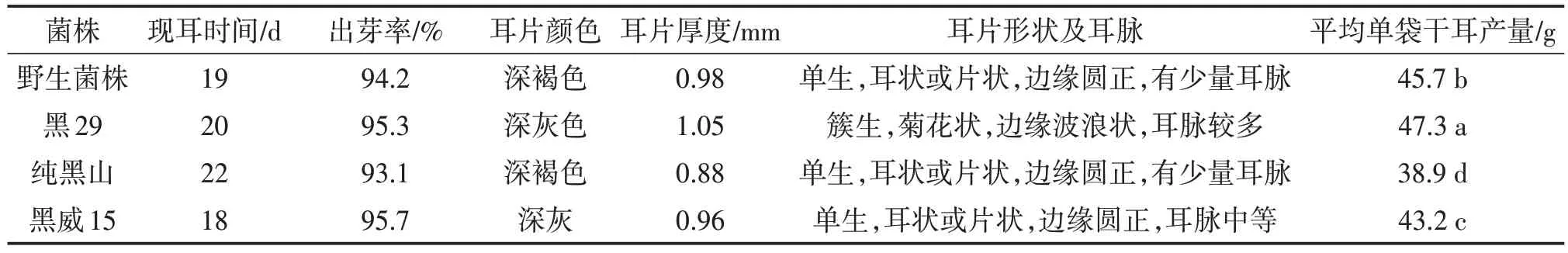
表5 供试菌株子实体的生长发育情况
3 小结
运用ITS 分子标记,成功地对一株野生黑木耳进行鉴定,确定该野生菌株为木耳属,黑木耳种,说明ITS 技术可以用来进行黑木耳的种类鉴定。经过鉴定的野生黑木耳菌株人工栽培获得成功。研究为黑木耳品种选育、复壮、改良提供了新的种质资源[9]。
