不同来源中国被毛孢菌株培养特性与化学成分差异
2020-12-21张一帆黄龙花杨颖茵何嘉豪陈少丹谢意珍杨小兵
张一帆 黄龙花 杨颖茵 何嘉豪 余 欢 陈少丹 谢意珍 杨小兵*
(1广东省微生物研究所 广东省科学院/华南应用微生物国家重点实验室/广东省微生物安全与健康重点实验室,广东广州510000;2 西藏康宝生物科技有限公司,西藏林芝850400;3广东粤微食用菌技术有限公司,广东广州510000)
中国被毛孢(Hirsutella sinensis)现已被证明是冬虫夏草的无性型[1-3],然而是否是唯一的无性型,目前尚无定论[4-7]。中国被毛孢可在培养基上生长并获得一定量的菌丝体[8-10],但尚未有报道发现中国被毛孢培养物能直接在一定培养条件下形成肉眼可见的子座。中华被毛孢菌丝体及其分生孢子均可侵染宿主虫体[11-12],当形成僵虫后,在适当的培养条件下可形成子实体[13]。
中国被毛孢与冬虫夏草有相似的内含物[14-15],但未见系统性研究,例如在建立冬虫夏草代谢物库的基础上,对同一来源两者的代谢物组进行比较,甚至对同一子实体上分离得到的中国被毛孢与其子实体的代谢物组进行比较等。有报道指出中国被毛孢的甘露醇、甾醇不如冬虫夏草含量高[16-17],也有报道指出,在一些脂类、蛋白质等营养物质方面优于冬虫夏草[18]。在利用宿主虫体的半人工培养条件下,冬虫夏草子实体形成率仍相当低(从成功侵染虫体到长出子实体少于千分之一)[19]。而中国被毛孢的菌丝体生物量却可通过优化培养条件,较便捷、较大量获得[9,20]。这使得中国被毛孢被认为是冬虫夏草子实体的一个较为理想的候选替代品。
不同来源的中国被毛孢有不同研究报道[21-23]。例如,一株来自西藏那曲市的中国被毛孢的多糖组分可通过调节肠道菌群,显著降低高脂喂食后小鼠的体重增加量,以及减少代谢紊乱[24];在培养基中添加一定量的锰离子,可使一株来自于青海省的中国被毛孢的多糖产量显著提高[25];来自西藏、青海、云南、四川的四株中国被毛孢的分生孢子大小相互间有显著差异[26];在同一个产地中,不同个体分离得到的中国被毛孢,在相同培养条件下,其分生孢子数量相互间有显著差异[27]。而不同来源中国被毛孢代谢物的相互比较尚未见报道。
因此,笔者对多个中国被毛孢菌株进行ITS 序列分析与鉴定,并选取其中三个不同来源的中华被毛孢菌株,对其生长特性进行了初步研究,并通过不同培养方法和提取方法,比较三个菌株中小分子代谢物整体组成的差异。
1 材料与方法
1.1 供试菌株
选用广东省微生物研究所食用菌研究与发展中心分离和保藏的菌株,代号 Z2、Z3、Z3-la、Z4、I15、XG、P1(其中Z 开头菌株分离材料来自西藏工布江达县,I15 来自那曲市,XG 来自云南香格里拉市,P1 为引进的蝙蝠蛾拟青霉)。另从中国普通微生物菌种保藏管理中心(CGMCC)购得中国被毛孢和蝙蝠蛾拟青霉各一株作为鉴定时参照菌株,菌株代号重新定为Z-YW和Ph-YW。
1.2 培养基配方
平板培养基配方为:蚕蛹15.0 g,蛋白胨10.0 g,酵母浸出粉10.0 g,葡萄糖15.0 g,硫酸镁0.5 g,磷酸二氢钾1.0 g,硫酸锌0.3 g,硫酸锰0.3 g,维生素B60.05 g,琼脂粉20.0 g,纯净水补足至1 000 mL,调节pH。液体培养基配方与固体培养基配方相同,配制时先将蚕蛹进行100 ℃水浴1 h,然后滤去蚕蛹颗粒,滤液混合其他成分。
1.3 菌种鉴定
取平板培养基菌丝体,使用试剂盒(Magen,Hi⁃Pure Fungal DNA Mini Kit II)提取总 DNA 模板,与ITS 通用引物(ITS1:TCCGTAGGTGAACCTGCGG,ITS4:TCCTCCGCTTATTGATATGC)进行 PCR,回收目的条带,送样华大基因测序,获得各样品ITS序列。
1.4 菌丝生长速度测定
将供试三个不同来源的菌株(Z4,XG,I15)接种平板培养基上,18 ℃避光培养,待菌落初步形成后,以划线法进行菌丝生长速度测定,每7 d 记录一次生长情况(菌落前端位置)。记录5 次生长区间,完成后用毫米直尺量取生长区间,取均值即为该菌株菌丝的生长速度。
1.5 质谱检测
1.5.1 质谱分析前样品制备
分别取相应菌株接种在平板培养基上和液体培养基中,18 ℃避光培养60 d,液体摇瓶培养转速120 r/min(哈东联DLHR Q200)。提取平板培养基上的菌丝体时,用镊子掀起培养基表面菌落,用移液器枪头刮去菌落背面的培养基,并用二级水漂洗去除残余固体培养基;提取液体培养基中的菌丝体时,用200 目滤网垫于布氏漏斗中,接抽滤装置,收集菌丝球并去除培养残液,并用二级水漂洗菌丝球至滤出液无明显颜色为止。所得的两种菌丝体冻干并粉碎,每种菌丝体样品再分别用超纯水、乙酸乙酯按0.90 g 样品、2.0 mL 溶剂进行超声提取(超声波清洗仪,AUTO SCIENCE AS10200BDT),工作频率40 kHz、功率300 W、水浴温度40 ℃、处理时间60 min。水提样品在提取后离心除尽样品残渣,上清液过水相滤膜(0.22 μm)后待上机;乙酸乙酯样品在提取后离心除尽样品残渣,上清液在室温下挥发至剩下少量黏稠状残余物,并且不再有乙酸乙酯气味,然后用2.0 mL 甲醇复溶黏稠状残余物,复溶后的溶液过有机相滤膜后(0.22 μm)待上机。
1.5.2 色谱与质谱条件
所用仪器为超高效液相——高分辨质谱联用仪(UHPLC-HRMS,仪器型号为Thermo Q Exacutive Focus)。色谱条件为:Thermo Hypersil GOLD™ C18色谱柱(2.1 mm×50 mm,1.9 μm),流动相(A)0.1%甲酸水溶液,(B)乙腈,梯度洗脱(0~12 min,10%~95%B;12~16 min,95%B),柱 温 25 ℃ ,流 速0.30 mL/min,进样量2 μL。质谱条件为:加热电喷雾离子源,鞘气流速45 单位,辅助气流速8 单位,喷雾电压3.00 kV,离子传输管温度320 ℃,辅助气流加热温度350 ℃,S-Lens RF 水平50%。数据采集模式为一级全扫描(正负模式切换扫描)。一级质谱条件:扫描70~1000.0 m/z,分辨率35 000,自动增益控制1e6,最大注入时间50 ms。
1.6 数据分析
1.6.1 聚类分析
ITS 序列输入软件ClustalX 中进行多重比对,再把数据文件导入软件MEGA 中,聚类法采用Neigh⁃bor-joining 法,Bootstraping 为 1000 次,模型为 p-dis⁃tance,构建聚类树。
1.6.2 质谱数据分析
样品原始数据文档导入软件工具MSConvert GUI,使用Peak Picking 对原始数据进行过滤,并转换文件格式为mzML。转换格式后的文件导入软件工具MZmine 中,按顺序进行质谱数据检测(Mass Detection)、谱峰构建(ADAP Chromatogram Builder)、谱峰反卷积(Chromatogram Deconvolution)、同位素峰归组(Isotopic Grouper)、谱峰比对(RANSAC Aligner)、比对表行信号过滤(Feature List Rows Filter)、比对表补缺(Gap Filling)后,获得比对文件。将比对文件峰面积数据导入软件工具SIMCA,设置保留时间为主要分类项(Primary ID),对各样品数据进行建模打分,获得主成分分析(PAC)结果。
2 结果与分析
2.1 菌株聚类分析与鉴定
基于ITS的聚类分析显示,中国被毛孢(H.sinensis)与蝙蝠蛾拟青霉(P.hepiali)所在分支分属两个不同簇。试验菌株Z2、Z3-1a、Z4、XG、I15、Z-YW与中国被毛孢、冬虫夏草归为一族,可基本判定属于同一个种;试验菌株P-YW、P1在聚类分析中与蝙蝠蛾拟青霉归为一簇,但P1 与蝙蝠蛾拟青霉同簇的Bootstrap支持率较低,经BLAST 分析,其序列与多孔木霉无性型(Tolypocladium inflatum,MK020177.1)相 似 度 为100%。Z3 与Z3-la 原是同一条冬虫夏草上分别从子座和虫体上分离得到的培养物,两者菌落外观相似,但经多次重复,其基于ITS 序列的聚类分析结果始终不与中国被毛孢归为一簇,而更偏向于蝙蝠蛾拟青霉。推测原因可能是,冬虫夏草是多种微生物共生体系,传统的菌种分类手段可能会因分离部位、培养基等原因而富集到某一个物种。
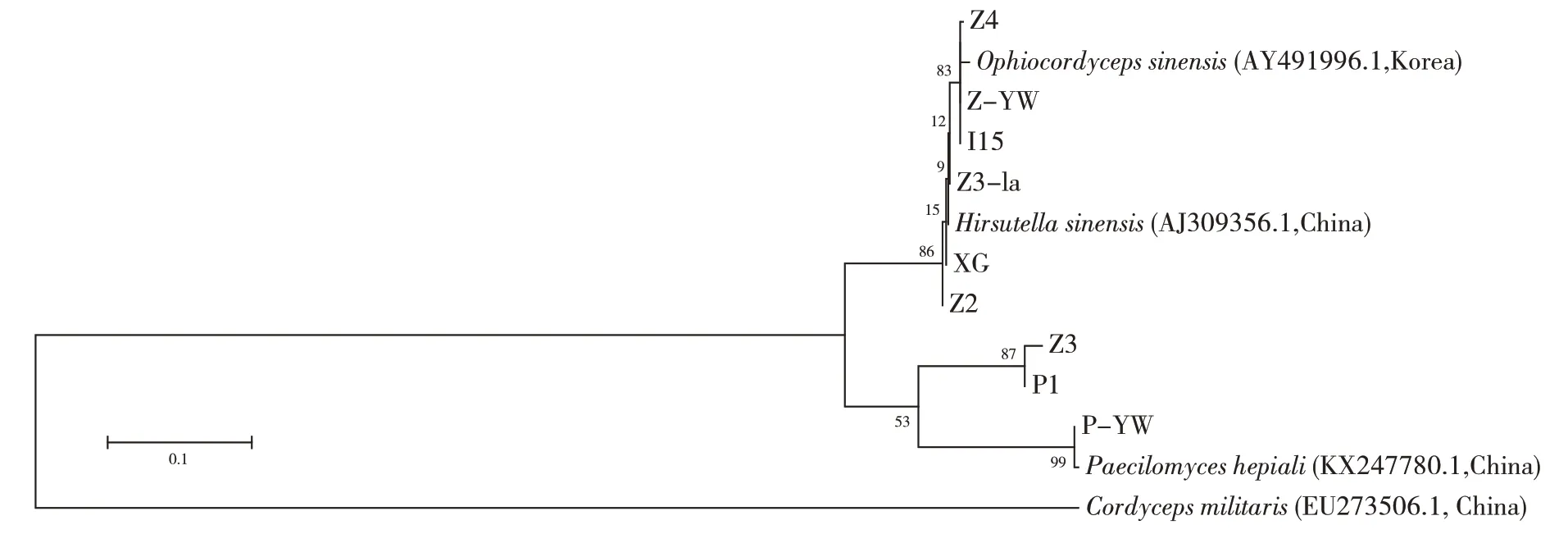
图1 供试菌株基于ITS的聚类分析

图2 三种不同来源中国被毛孢菌落形态(标尺5 mm)
如图2 所示,三种不同来源的中国被毛孢菌株菌落外观差别明显。来源于工布江达县的菌株Z4菌落灰白色(近似色号1631,2.5B 9/1,CBCC 中国建筑色卡,下同)、圆形、边缘整齐、脐突状隆起、表面放射状皱褶;来源于香格里拉市的菌株XG 菌落颜色偏黄(近似色号0022,8.1Y 9/2)、圆形、边缘整齐、扁平无隆起(接种点膨大除外)、表面密集发射状皱褶;而来源于那曲市的菌株I15 菌落颜色黄白(近似色号1305,2.5Y 9/1)、圆形、边缘整齐、凸透镜状隆起、表面无皱褶。
2.2 pH对中国被毛孢菌丝体生长速度的影响
随着培养基 pH 的升高(5.5~7.0),不同来源的中国被毛孢菌株菌丝体生长速度呈现不同的变化,如图3 所示。Z4 在较低的pH5.5 时菌丝生长较快,随着pH的升高,生长速度降低;I15则相反,随着培养基pH 升高,菌丝生长速度加快(0.15~0.20 mm/d);XG 在试验pH 范围内菌丝生长速度变化不明显。
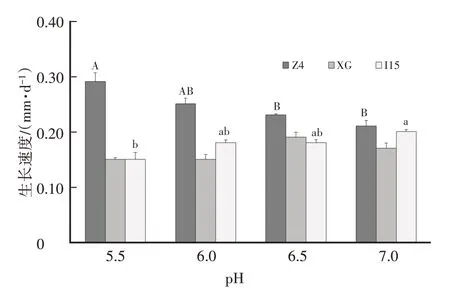
图3 中国被毛孢菌株菌丝体在不同pH平板培养基上的菌丝生长速度
2.3 代谢物组成差异分析
三个不同来源的中国被毛孢菌株,分别通过液体和平板培养基培养获得菌丝球和菌落两种材料,每种材料再分别使用水、乙酸乙酯进行提取,共获得12 种提取物。各种提取物经LC-MS 分析后,如图4 建立PCA 模型。图4 中两主成分累计解释率达65.4%(横轴解释率大于纵轴)。12种提取物的数据点,只要是提取溶剂(水或乙酸乙酯)以及材料获得方式(液体或平板培养)都相同,则相对聚拢在一起,使整体数据较明显地分为四组(图4中坐标轴四个象限内),每一组中都存在三个不同菌株的提取物数据点。另外,比较四个分组中样品数据点的靠近程度发现,平板培养基培养所得的提取物数据点(AQS、EAS)比液体培养所得的(AQL、EAL)分散程度高。
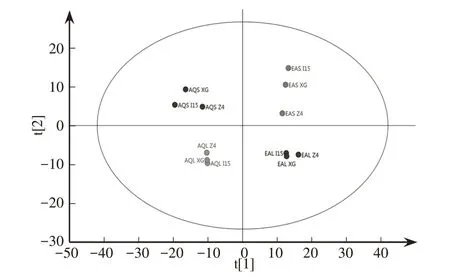
图4 中国被毛孢菌丝体代谢物的PAC得分分布图
3 小结与讨论
三个不同来源中国被毛孢菌株菌落外观形态存在明显差异(图2),但从ITS聚类分析结果来看,三者与已入库的中国被毛孢聚类分组较为接近(图1),说明三者都是中国被毛孢。何苏琴等曾对多个分离于甘肃的冬虫夏草中国被毛孢菌株进行培养,结果显示部分菌株在相同培养基上生长时,菌落外观也存在一定差别[28]。另外,观察发现三个菌株经多次传代,在平板培养基上仍展现出各自菌落相对稳定的特征。造成这种现象的原因可能是三者相互处于更次一级的分类学单位,或是基于ITS 的聚类分析精度未足够,又或是三者存在尚未研究清楚的表观遗传情况。
中国被毛孢菌株的不同来源也影响了他们各自对培养基pH 的响应。试验三个不同来源的中国被毛孢菌株的菌丝生长速度,在相同的培养基pH变化内呈现出三种不同的变化模式。不少文献发现中国被毛孢培养基的最适pH 为6.5[8-9,29],但同时也有研究通过单因素试验或正交试验等得出比6.5更低的最适pH[30-31]。另外,在王锦锋等的研究中,多个中华被毛孢菌株在同一种培养基上菌丝生长速度差异显著[32]。这提示在进行中华被毛孢的优选培养试验,尤其是深层发酵时,需根据所选菌株选择其最适pH培养基。
通过主成分分析发现,同一菌株使用同一种提取溶剂提取时,其代谢物整体组成因培养基固液状态存在明显差异。YU 等在研究中国被毛孢挥发性成分以及李淑林在分析中国被毛孢的代谢组学时,也发现存在这种差异[33-34]。由此可见,培养基固液状态对某些目标代谢产物可能有重要影响。另一方面,由于主成分分析中横轴的解释率约是纵轴2.5倍,而且四个分组数据点在横轴的距离更大,推测提取液差异对代谢物组成差异的贡献要大于材料来源方式,这也比较符合用乙酸乙酯提取样品小极性代谢物,而用水提取中大极性代谢物的特性。再者,使用两种溶剂提取时,都发现平板培养三个菌株所得数据点分散程度比液体培养的高,推测在比较不同菌株代谢物时,采用固体培养方式可能会发现更多或更明显的成分差异。
