肝纤维化形成与消退过程中氧化应激与ERK信号通路变化特点
2020-12-19平大冰崔红艳孙鑫黄恺彭渊陶艳艳刘成海
平大冰 崔红艳 孙鑫 黄恺 彭渊 陶艳艳 刘成海
肝星状细胞(hepatic stellate cells,HSC)是肝纤维化发生发展的重要细胞学基础,其活化与许多途径和介质密切相关,包括自噬、内质网应激、氧化应激反应等[1]。有研究证实,过量的活性氧(reactive oxygen,ROS)激活HSC诱发纤维化形成,氧化应激同时可以激活ERK通路,参与MAPK信号通路的传导,促进HSC的增殖和活化[2-4]。本研究采用二甲基亚硝胺(dimethylnitrosamine,DMN)诱导肝纤维化大鼠模型,观察肝纤维化发展与消退过程中过氧化损伤、ERK及HSC活化关系,探讨氧化损伤通过ERK信号通路诱导肝纤维化的可能病理机制。
资料与方法
一、实验动物
Wistar清洁级雄性大鼠74只,体质量为(150±10)g,由中国科学院上海实验动物中心提供。模型制备参照文献[5],以10 μL/kg剂量予大鼠腹腔注射DMN,每天1次,每周3 d,持续造模4周,分别在染毒后1 d、3 d、1周、2周、3周、4周末,与染毒停止后1周、2周、4周,共9个时间观察点处死模型大鼠。另设正常对照组大鼠10只,按相同剂量腹腔注射0.9% NaCl溶液。
二、试剂与抗体
DMN,羟脯氨酸(hydroxyproline,Hyp)标准品购自日本东京化成工业株式会社;超氧化物歧化酶(SOD)、谷胱甘肽(GSH)、谷胱甘肽S转移酶(GST)试剂盒均购自中国南京建成生物有限公司;明胶购自美国Amresco公司;Trizol购自美国Invitrogen公司;反转录及PCR扩增试剂盒为日本Takara公司产品。小鼠抗人α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)单克隆抗体购自美国Sigma公司;小鼠抗大鼠单克隆磷酸化ERK抗体、多克隆兔抗大鼠ERK1抗体购自美国Santa Cruz Biotechnology公司;小鼠抗人基质金属蛋白酶(MMP)-2单克隆抗体购自美国Antibody Diagnostica公司;小鼠抗人MMP-9单克隆抗体、小鼠抗人组织金属蛋白酶抑制剂(TIMP)-1单克隆抗体、小鼠抗人TIMP-2单克隆抗体均为美国NeoMarker公司产品。辣根过氧化物酶标记驴抗兔抗体和辣根过氧化物酶标记驴抗鼠抗体购自美国Amersham Pharmacia Biotech公司。
三、实验方法
(一)肝组织总RNA提取与mRNA表达 Trizol抽提肝组织RNA,然后将总RNA反转录为cDNA,荧光定量PCR仪进行cDNA扩增,以β-actin作为内参照基因。每个样本设置3个副管。引物由上海生工公司合成、纯化与鉴定,引物序列见表1。
(二)免疫组化染色观察α-SMA表达变化 大鼠肝组织切片脱蜡,0.3%H2O2孵育灭活内源性过氧化氢酶,柠檬酸盐缓冲液煮沸法抗原热修复,5%BSA封闭,一抗4 ℃过夜,二抗37 ℃孵育,DAB显色,Image Pro Plus软件进行半定量分析。
(三)明胶酶图法观察肝组织MMP-2、MMP-9活性 参考文献[6]的检测方法,肝组织100 mg匀浆裂解蛋白后定量,8%SDS-PAGE(含0.1%明胶)还原但非变性电泳,洗脱漂洗后,将凝胶置于孵育液中37 ℃孵育18~20 h,经考马斯亮蓝染色,可显示出MMP-2和MMP-9及活化的MMP-2位于蓝色背景下的透亮带。

表1 Collagen I mRNA扩增引物序列
(四)蛋白免疫印迹法检测肝组织α-SMA、MMP2/9、TIMP1/2、ERK/p-ERK蛋白表达 肝组织100 mg裂解蛋白后定量,10%SDS-PAGE凝胶上电泳分离,并转移到硝酸纤维素膜中,5%BSA封闭,4℃一抗(浓度均为1:200)孵育过夜,PBS缓冲液洗膜后将膜与相应荧光标记二抗室温孵育1 h后用Li-Cor奥德赛成像仪进行扫描拍照,每个实验重复3批不同样本。
(五)肝组织脂质过氧化测定 SOD、GST活性;GSH含量,按照试剂盒说明书步骤测定。
四、统计方法
结 果
一、模型大鼠肝组织胶原沉积变化
天狼猩红染色结果显示,染毒2周胶原纤维沉积,出现菲薄的纤维间隔,4周末时胶原纤维沉积明显,纤维间隔与假小叶形成,肝组织出现纤维化。停止染毒后肝脏胶原沉积减轻,肝纤维化有所消退,但直至8周末时仍可见轻微纤维间隔。染毒开始后,模型大鼠肝组织Hyp含量持续升高,染毒4周时含量为正常组的1.5倍,停止染毒后,Hyp含量开始下降,8周时仍高于正常水平(见图1,表2)。
二、模型大鼠肝组织α-SMA蛋白表达变化
免疫组化染色观察到正常大鼠肝组织α-SMA蛋白少量表达,散见于汇管区血管壁,肝小叶内未见阳性灶。随DMN染毒开始,α-SMA表达增加,主要见于肝窦壁和纤维间隔处。停止染毒后,α-SMA表达下降,但仍高于正常肝组织(见图2,表2)。
三、模型大鼠肝组织MMP-2和MMP-9活性变化
正常组大鼠MMP-2活性较弱。肝纤维化形成过程中MMP-2活性逐渐升高;停止染毒后,MMP-2活性逐渐减弱,8周时基本恢复至正常水平。正常组MMP-9活性极低,在DMN造模过程中MMP-9变化趋势与MMP-2相似(见图3,表2)。
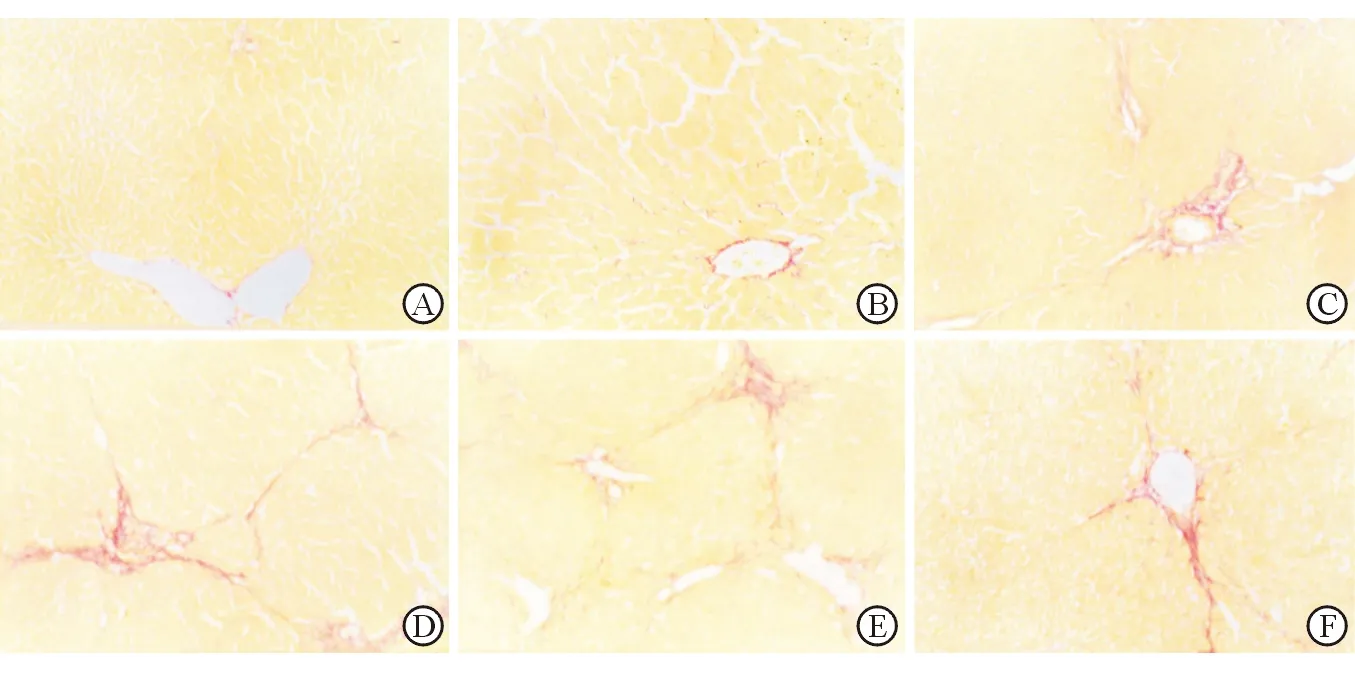
注:A 正常组;B 模型组1周;C 模型组2周;D 模型组4周;E模型组6周;F模型组8周
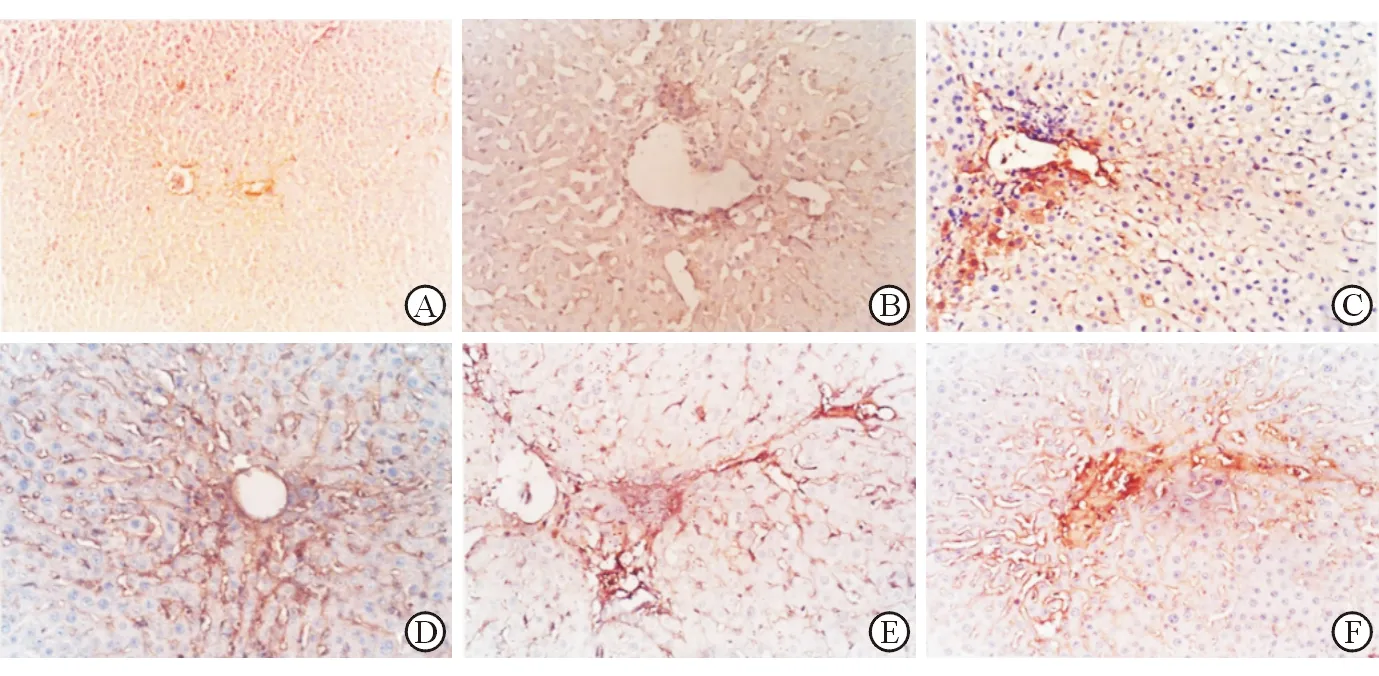
注:A 正常组;B 模型组1周;C 模型组2周;D 模型组4周;E模型组6周;F模型组8周

图3 大鼠肝组织MMP-2和MMP-9活性动态变化
四、模型大鼠肝组织Collagen I mRNA的表达变化
实时PCR结果显示,正常组大鼠肝组织仅少量表达collagen I,染毒3 d时表达明显升高,其后持续高表达,4周升高最明显,DMN染毒停止后,collagen I mRNA水平有所下降,但仍维持在较高水平(见表2)。
五、肝组织α-SMA、MMP-2/9、TIMP-1/2、ERK/p-ERK蛋白表达变化
正常组大鼠肝组织α-SMA、MMP-2/9、TIMP-1/2蛋白均少量表达。在肝纤维化形成过程中,各蛋白表达量逐渐增加,并随DMN染毒时间持续高表达。停止染毒后,各蛋白表达均逐渐减少,8周时MMP-2蛋白表达已接近正常水平,α-SMA、MMP-9、TIMP-1/2蛋白仍较正常组大鼠表达增多。ERK蛋白水平于正常组及模型组大鼠肝组织中无明显变化,然而ERK磷酸化(p-ERK)水平在染毒1 d时即有轻度增加,2周时表达升高至正常组的2倍。其后在整个造模过程中p-ERK持续高表达,4周达到最高峰。停止染毒后,p-ERK水平逐渐下降,但8周时仍高于正常水平(见图4,表3)。
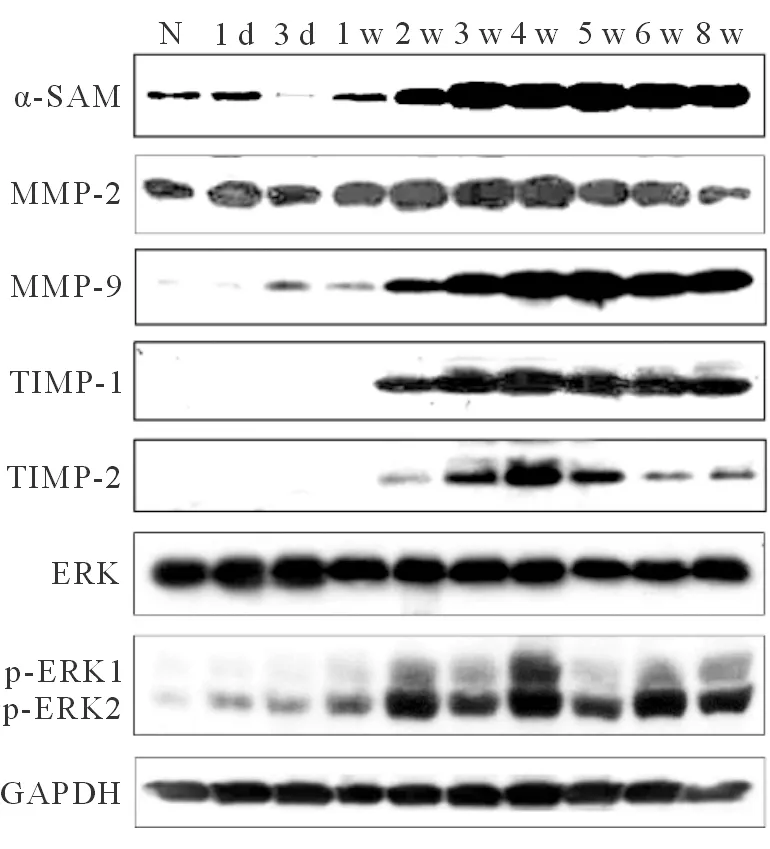
图4 大鼠肝组织α-SMA、MMP-2/9、TIMP-1/ 2、ERK/p-ERK蛋白表达变化

表2 大鼠肝组织胶原、α-SMA及MMP-2/9表达变化(±s)

表3 肝组织蛋白表达变化定量(±s)
六、模型大鼠肝组织脂质过氧化损伤动态变化
肝纤维化形成过程中,大鼠肝组织SOD、GST活性逐渐降低(P<0.05),停止染毒后,二者活性有所增高但仍低于正常水平。肝组织GSH含量在DMN染毒早期出现一过性增高,而后明显降低(P<0.05),在肝纤维化消退过程中,含量逐渐增加并接近正常水平(见表4)。
七、肝组织SOD活性与p-ERK蛋白表达及Hyp含量的相关性分析
直线相关分析表明,在肝纤维化形成和消退过程中,SOD活性与Hyp含量及SOD活性与p-ERK蛋白表达均呈明显负相关(P<0.05);p-ERK蛋白表达与Hyp含量呈明显正相关(P<0.01)。见图5。
讨 论
DMN是一种常见的具有肝毒性、基因毒性和免疫毒性的化学物质,其主要靶器官为肝脏,高剂量使用可引起肝组织坏死和肝纤维化[7,8]。肝纤维化的形成与HSC的活化关系密切,活化HSC转换为肌成纤维细胞,分泌大量的α-SMA和胶原沉积于肝脏,HSC还可以分泌MMP和TIMP,通过调节ECM的沉积和降解,影响肝纤维化的进展[9]。目前发现至少有4种TIMP存在,但仅有TIMP-1和TIMP-2在肝组织中表达[10],TIMP-1和TIMP-2可以分别与IV型胶原酶MMP-9和MMP-2前体结合,破坏正常肝脏基质,抑制间质胶原酶降解胶原纤维,促使HSC进一步增殖活化。本研究发现,DMN染毒开始,大鼠肝组织细胞出现损伤坏死,胶原纤维大量沉积,在肝纤维化形成过程中肝组织内α-SMA以及MMP-2/9和TIMP-1/2的表达量明显增加,MMP-2/9活性明显增高,停止染毒,肝纤维化逐渐消退,相关蛋白表达减少。
有研究发现,在DMN造模初期,会引起过多游离脂肪酸沉积于肝细胞,产生氧自由基激发脂质过氧化,激活HSC,加快肝纤维化的进程[11]。ROS是氧化还原过程中产生的化学活性分子,是细胞代谢,尤其是线粒体代谢的副产物,当细胞ROS量超过机体抗氧化能力时可引发脂质过氧化反应导致细胞受损。生理状态下,细胞会产生如SOD等抗氧化酶系维持正常的氧化平衡状态,以保护细胞和组织免受过量ROS攻击[12]。GST是GSH结合反应的关键酶,催化谷胱甘肽结合多种化合物和环氧化物,与肝细胞内存在的SOD和过氧化氢酶等酶类抗氧化剂和还原型GSH等非酶类抗氧化物质共同抵御ROS所致的细胞损伤。因此,酶类抗氧化剂与非酶类抗氧化物质常用作评估氧化应激水平的指标[13]。本研究发现,肝纤维化形成过程中,肝组织SOD活性、GST活性明显降低,GSH含量在早期出现一过性增高,染毒1周时开始明显降低,而停止染毒后,二者活性有所增高但仍低于正常水平。提示DMN诱导肝纤维化形成过程中,模型组大鼠体内出现氧化应激反应,机体抗氧化能力降低,在停止染毒以后,脂质过氧化损伤明显恢复,大鼠肝组织纤维化明显减轻,且氧化应激反应可能与DMN大鼠肝纤维化的形成和消退有关。

表4 肝组织SOD活性、GST活性及GSH含量的动态变化(±s)

图5 SOD活性与Hyp含量及p-ERK的相关性分析
既往研究发现,肝组织内ROS的过量累积,会通过脂质过氧化作用引起肝细胞、巨噬细胞等炎症细胞产生脂质过氧化物,从而介导HSC分化、增殖和胶原的形成[14]。还有研究认为,除上述旁分泌机制外,ROS还可以直接刺激HSC的活化和增殖[15]。为了探讨氧化应激反应如何刺激HSC增殖活化,本研究观察了近年来倍受关注的ERK信号通路。ERK通路是各种细胞因子影响HSC增殖和活化的重要通路之一,其有ERK1和ERK2两种异构体,磷酸化的ERK1/2(p-ERK1/2)可以转位至细胞核内,调节转录因子,刺激HSC增殖和活化[16-18]。本研究结果显示,肝纤维化形成过程中,ERK蛋白水平表达在正常组及模型组大鼠肝组织没有明显差异,而p-ERK1/2水平在肝纤维化形成过程中明显增加,整个染毒过程中持续高表达。停止染毒后,p-ERK1/2水平随肝纤维化消退有所下降,但仍高于正常水平。
综上所述,在DMN染毒过程中,模型组大鼠肝组织肝细胞损伤,抗氧化物质SOD、GST、GSH表达量明显下降,机体氧化应激反应明显,HSC活化,肝纤维化形成,同时伴有MAPK/ERK信号通路p-ERK1/2的高表达;在停止染毒后,肝纤维化明显消退,抗氧化物质及p-ERK表达均不同程度恢复。相关性分析发现,抗氧化物质SOD活性与Hyp含量呈负相关,p-ERK蛋白表达与Hyp含量呈正相关,同时肝组织SOD活性与p-ERK蛋白表达也呈负相关。表明氧化应激反应与DMN诱导大鼠肝纤维化的形成和消退有关,且其可能是通过ERK信号通路传导影响HSC活性和肝纤维化的进程。
