核酸标准物质定值的实验体系研究
2020-12-18王会如
李 达,王 军,杨 忠,王会如
(1.北京市医疗器械检验所,北京101111; 2.清华大学生命科学学院,北京100084)
1 引 言
人类基因组计划的实施,推动了分子生物学技术在医学和遗传学基础研究领域的应用。随着基因组序列信息的不断完善,人们对疾病的认识逐步深入到分子层面,分子检测结果在临床诊断指导中的作用越来越受到重视。虽然我国分子诊断产品市场占有率较小,但从2014年开始,每年的增速超过20%,成为体外诊断行业中发展最快的产品[1]。2015年,我国开展并实施了自己的“精准医疗”计划,由北京协和医院、中国医学科学院肿瘤医院、北京大学人民医院等作为第一批运用高通量基因测序技术进行肿瘤诊断与临床治疗的试点单位[2]。分子诊断行业产品涉及无创产前诊断、癌症早筛及伴随诊断、耐药基因检测、血液病检测、遗传易感基因检测、生殖医学检测和致病微生物检测等。随着基因测序数据和临床病例的结合,疾病在分子水平呈现出了相同的机制,如非小细胞肺癌患者中,肿瘤体细胞中出现EGFR、KRAS和TP53基因的突变[3],乳腺癌患者体细胞中发现BRCA1、BRCA2和HER2突变[4,5]。从碱基水平来看,基因的变异类型主要有拷贝数变异(copy number variations, CNVs)、单核苷酸碱基突变(single nucleotide polymorphisms, SNPs)、小片段碱基的插入或缺失(insertion-deletion, Indel)、基因融合、基因重排和甲基化修饰等。
随着分子体外诊断行业的发展,产品种类和数量与日俱增。然而,不同厂家产品的性能参差不齐,保证检验结果的可靠性需要依靠正确的参考方法和标准物质,通过溯源来实现标准化和一致化。目前,分子检测产品主要以聚合酶链式反应(polymerase chain reaction, PCR)、生物质谱、分子杂交和测序法为主。市场上常见的核酸定值平台有分光光度计、荧光染料定量仪、荧光定量PCR仪、数字PCR仪、杂交芯片、飞行质谱仪、电感耦合等离子体质谱和第二代高通量测序仪等。而核酸标准物质一般由各国政府机构和非盈利组织研制开发,大多采用多实验室合作定值方案。美国国家标准与技术研究院以荧光定量PCR和数字PCR作为定值的平台,研制了人巨细胞病毒(RM 2366a)、人类DNA定量标准品(RM 2372a)、HER2基因拷贝数(RM 2373)等标准物质[6,7];英国国家生物标准研究所研制的骨髓增殖性肿瘤驱动JAK2基因V617F突变标准品盘,采用了荧光定量PCR、数字PCR、生物质谱和高通量测序仪等作为定值的平台[8]。目前由于核酸标准物质的需求量大,商业公司纷纷进驻标准物质研制领域,如英国Horizon Diagnostics公司生产的高通量测序人类基因组分子诊断标准物质。该标准物质同样以数字PCR作为定值手段,根据不同测序平台和文库构建方式,基于基因覆盖率开发了不同等位基因频率的标准物质[9]。
核酸检测的优势在于从分子层面揭示了疾病的成因,但样品中较低的核酸浓度通常给检测带来了困扰。目前,分子诊断产品的性能和实际检测能力的正确评价,需要利用均匀稳定且量值可溯源的标准物质[10]。而核酸标准物质的研制过程,不仅需要正确地使用核酸检测仪器和试剂产品,更需要合理规范的实验设计和操作流程。本文从核酸的取样量、核酸的稀释、核酸定值方法和数据结果分析4个方面展开,探讨核酸标准物质定值的影响因素。
2 实验体系要点
2.1 核酸取样量
核酸作为生物体遗传信息的载体,存在于人体的各类生物样本中,如肿瘤组织细胞、血液白细胞、血浆、尿液、唾液和胸腹液等。从各种样本中提取核酸并进行检测,涉及到复杂的提取过程和随机取样过程。为了尽可能得到核酸,我们应尽量多收集样本。然而,临床样本的特殊性,限制了样本本身的取样量,从而进一步影响了被测样本的准确性。尤其是体液中游离核酸的检测,因样本取样量的限制,对检测结果造成很大的影响。依据阿伏伽德罗常数和分子量,将核酸质量换算成各物种核酸分子的拷贝数。如表1所示,在相同质量的样本下,样本基因组的大小与核酸拷贝数成反比,基因组越大,相同质量的核酸所含有的拷贝数越少。

表1 1 ng核酸分子拷贝数估计Tab.1 Estimation of copy number in 1 ng nucleic acid molecules
*艾滋病病毒为RNA病毒。
在做核酸检测时,检测的目标分子往往是稀有拷贝,这给样本的取样造成了很大的困扰。贝努利模型给出了检测的核酸分子数量与置信区间的关系:
Φ(μ,m)=1-(1-μ)m
(1)
式中:Φ为置信区间;μ为目标分子比例;m为检测分子数。
图1展示了在不同目标分子比例下,所需检测的核酸分子数量与置信区间的关系。
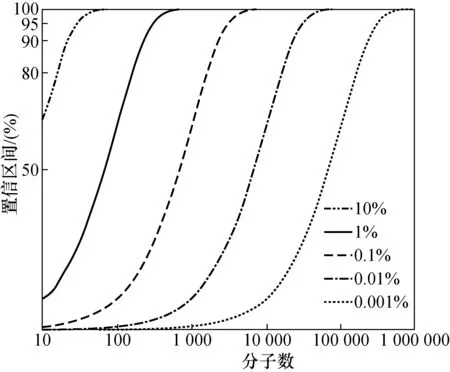
图1 检测分子数与置信区间的关系Fig.1 The relationship between the detecting molecular numbers and confidence intervals
当要求达到95%的置信区间,目标分子所占比例为1%时,至少要检测299个分子才能保证检测到1个目标分子;而要达到99%的置信区间,则至少需要检测459个分子才能保证检测到1个目标分子。假如目标分子比例不变,理论上检测500个分子中应该有5个目标分子被检测到,然而在实际的测量值有可能是4个或6个目标分子,最终用多次测量值的均值代表检测结果。
由于定量通常使用多次测量值来估计真实值,我们用变异系数来衡量测量值的离散程度,要求测量值有较小的误差。变异系数的表达式为:
(2)
式中:p为目标分子比例;n为检测分子数。
图2给出了5个不同比例的目标分子数下,测量的分子数与变异系数的关系曲线。

图2 测量的分子数与变异系数的关系Fig.2 The relationship between the quantitating molecular numbers and coefficient of variation
可以看出,随着测量分子数目的增加,变异系数逐渐减小,测量相同的分子数下,目标分子所占比例越高,变异系数越小。当目标分子所占比例为1%时,测量大于39 600个分子时,变异系数小于5%;而当目标分子所占比例为0.1%时,则需测量99 900个分子,变异系数才能降低到10%。因此,检测的样本和变异系数决定了实际的工作量。
稀有核酸样品对取样体积有着更高的要求,取样体积的大小直接影响着取样的均匀性,从而影响测量的正确性。如图3所示,假设样品中仅含有16个目标分子时,若按总体积的1/64取样,每次取到的突变分子数为0至2个;按总体积的1/9取样时,每次能取到1至3个突变分子;而只有按总体积的1/4取样时,每次取样才能得到一致的4个目标分子。所以,为保证取样的均匀性,稀有核酸分子的取样体积要尽可能大,甚至接近样品本身体积。

图3 稀有核酸样品的均匀性差异Fig.3 The uniformity differences of rare nucleic acid samples
2.2 核酸的稀释
为保证核酸检测的正确度、精密度和准确度,核酸检测仪器和试剂都限定了不同的核酸上样体积或上样量。在样品的制备过程中,核酸的稀释成为不可缺少的试验步骤。如图4所示,样品的稀释倍数和取样体积之间存在着紧密联系。假设100 ng/μL的人类基因组DNA样品,样品总体积为20 μL,按照1:10的比例梯度稀释DNA。不同的取样体积决定了样品可稀释的倍数。当取样体积为0.5 μL时,仅能稀释到1 500倍;而取样体积为10 μL时,能够稀释到30 000倍。由此可见,在一定的核酸浓度下,取样体积的大小应根据稀释倍数合理设定。
核酸稀释的另一个重要因素是移液误差,它影响取样量的准确度。假设一支10 μL移液枪的误差为±0.02 μL,当取样体积为10 μL时,取样误差的绝对值仅为0.2%;而取样量为0.5 μL时,取样误差的绝对值可达4%。随着移液次数的增加,取样误差逐渐积累;稀释次数的增加,同样也增大了取样的误差。所以,较大的取样体积、较少的移液次数和稀释次数,是提高取样准确度的有效手段。
2.3 定值方法的选择
在基因检测中,不同的技术方法可以得到不同的核酸量值,表2介绍了6种常用的核酸定值技术。

表2 基因检测常用的核酸定值方法Tab.2 Common methods for quantitation of nucleic acids in genetic testing
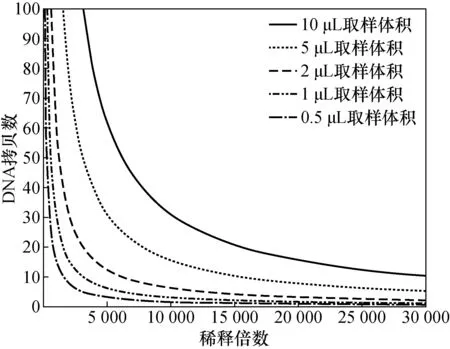
图4 取样体积和稀释倍数之间的关系Fig.4 The relationship between sampling volume and dilution factor
赛默飞世尔公司生产的NanoDrop和Qubit核酸定量仪,通过核酸对光谱的吸收原理,能够简单快速地定量核酸[11];荧光定量PCR技术由Applied Biosystems公司首先推出,该技术在PCR反应体系中加入荧光染料或荧光基团,利用荧光信号来实时监测整个PCR进程,通过产生的可被检测到的荧光信号所需的最小循环数,即Ct(cycle-threshold)值,来做标准曲线,定量核酸分子数[12];2012年,Bio-Rad公司推出了第一款商用微滴式数字PCR仪,该仪器为直接计数法,将待测样本稀释,可以将反应单元中的DNA模板达到单分子水平。通过PCR扩增,具有荧光信号的反应单元中至少含有一个拷贝分子[13]。生物质谱的发展基于软电离方式,1990年,AB SCIEX公司推出了第一款基质辅助激光解析电离飞行时间质谱(matrix-assisted laser desorption ionization time of flight mass spectrometry, MALDI-TOF-MS)。质谱在准确性方面具有优势, 通过等位基因特异延伸反应得到较短的寡核苷酸片段,检测寡核苷酸的分子量来确定样本的SNP和Indel,再通过质谱峰单位面积定量核酸[14];高分辨电感耦合等离子体质谱法(high-resolution inductively-coupled plasma-mass spectrometry, HR-ICP-MS)对痕量和超痕量元素具有良好的检测能力以及谱图识别性能,以磷元素来定量核酸具有很好的分辨率[15];1997年,斯坦福大学研制出了第一张酵母全基因组芯片,基因芯片基于核酸分子碱基互补配对原理,通过合成特定的寡核苷酸序列,利用杂交过程产生不同强度的荧光信号值来定量核酸[16];罗氏454测序系统开启了新一代的DNA测序仪市场,下一代测序技术一次能对几十万到几百万条DNA分子进行序列测定,通过对测序上样文库的定量,运用生物信息学分析技术,几乎可以得到样本里所有的核酸序列和丰度[17]。
不同方法有各自的仪器平台的优缺点,表2中总结了基因检测中常用的6种技术平台。其中,数字PCR方法由于不需要借助任何的标准品即可进行核酸的绝对定量,且在低丰度检测时具有更高的准确性[18],越来越被广泛接受为核酸溯源定值的标准参考方法。
2.4 数据结果分析
数据处理过程中,我们在判断阳性或阴性样品时,常常碰到假阳性和假阴性问题,如图5中指出的第I类错误和第II类错误。根据美国临床实验室标准化协会(Clinical & Laboratory Standards Institute, CLSI)EP17-A文中定义,由于实验过程的复杂性,空白样品有时会产生一个低值信号。当样品的浓度非常低时,低于空白限(limit of blank, LoB),容易产生假阴性。空白限由多次重复的有效上样量的阴性样品的数值来确定,在95%的置信区间内,空白限应根据式(3)确定数值。另外,由于系统误差的存在,实际的空白限设定应大于计算得到的空白限。
(3)

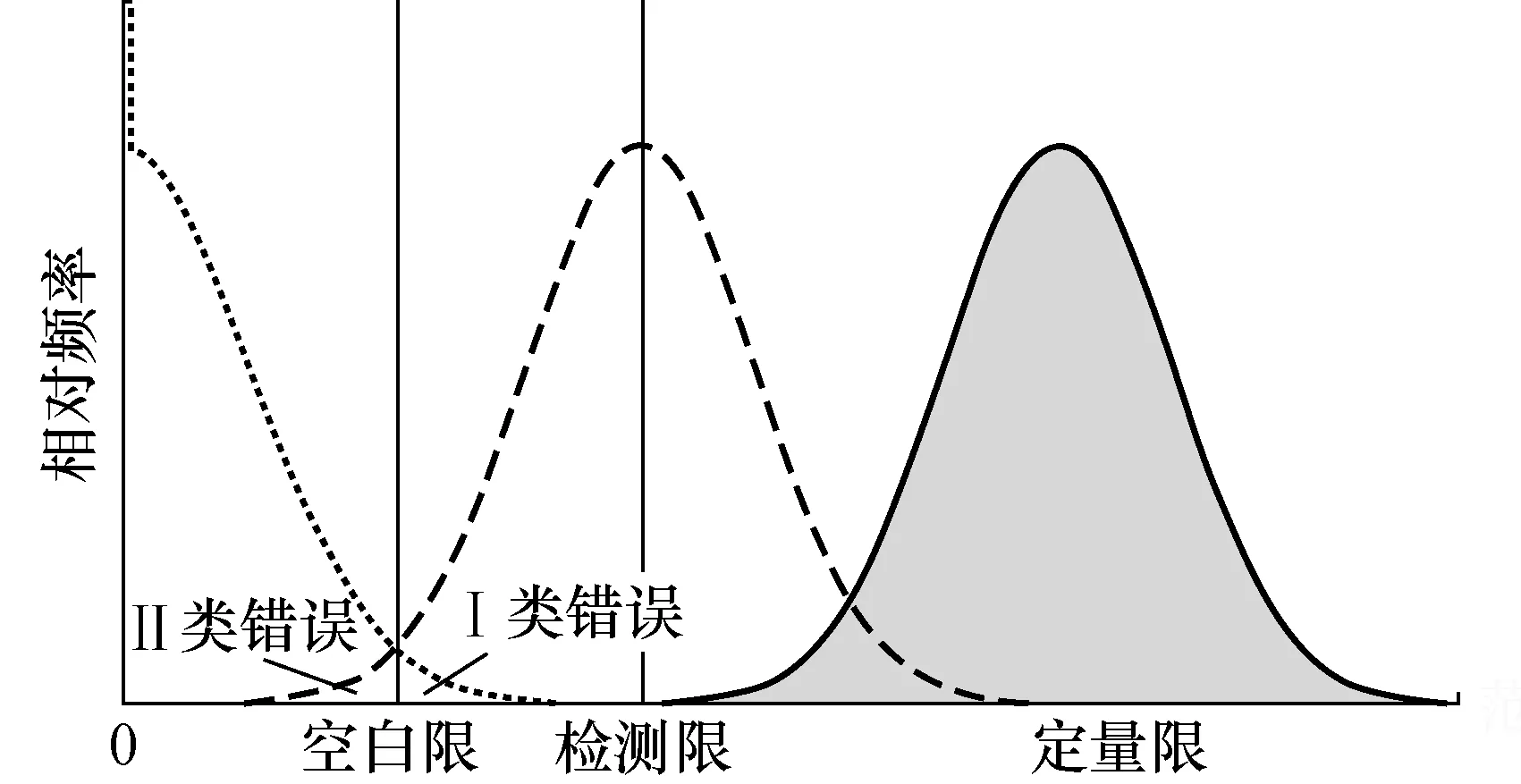
图5 空白限、检测限和定量限的关系分布Fig.5 Distribution relationship between LoB, LoD and LoQ
检测限(limit of detection, LoD)是能够真实区分空白限并能够得到合理的检测结果的样品最低浓度或起始量,标志着实验体系的最低检测能力。式(4)明确了检测限的计算方法。
LoD=LoB+1.645×SDLCsample
(4)
式中:SDLCsample为低值浓度样本标准差。
核酸定量要达到定量限(limit of quantitation, LoQ)的要求,定量限是指满足准确度、精密度和总误差的样品最小检测浓度或起始量。定量限一般要大于检测限,有时在数值上也可以等于检测限[19]。定量限的确定要考虑定量实验体系和测试样品的特点,测量值的标准差和线性相关系数是确定定量限的两个重要因素。一旦线性关系确立,就可以通过回归模型反推测量值代表的样品浓度或上样量。如图6所示,在定量限以上,测量值的标准差有明确的数值范围。随着样品浓度或上样量的增加,测量值的标准差逐渐减小,达到最小范围,即最佳定量范围,而只有在最佳定量范围内测量值才能更接近真实值。

图6 定量的准确度与线性回归分析Fig.6 The relationship between quantitative accuracy and linear regression analysis
我们以数字PCR定值方法为例,参考市场上常见的数字PCR仪型号。根据Dube等[20]人的研究,在95%的置信区间下,利用式(5)~式(9)模拟了5个不同数目的反应单元下,反映单元内平均分子数与相对误差的关系。如图7所示,随着反应单元数目的增多,相对误差逐渐降低。当反映单元内平均分子数为1.59时,对应的相对误差全部达到了最低值。即λ=1.59为数字PCR的最佳定量范围。
(5)
(6)
λmin=-ln(1-pmin)
(7)
λmax=-ln(1-pmax)
(8)
(9)
式中:λ为单元内平均分子数;λmin为单位内最小分子数;λmax为单位内最大分子数;p为平均阳性单元比例;pmin为最小阳性单元比例;pmax为最大阳性单元比例;C为单元数目;δ为相对误差。

图7 数字PCR反应单元中平均拷贝数与相对误差的关系Fig.7 The relationship between average number of copies per droplet and relative error in digital PCR
利用泊松分布计算单元内实际分子数为k的概率:
(10)
如图8所示,当λ=1.59时,实际的反映单元内为1个真实分子数的概率最大,为32.4%。
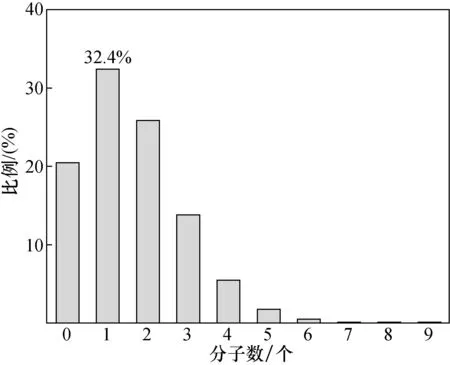
图8 变异系数最小时反应单元内含有不同分子数的概率Fig.8 The probability of average number of copies per droplet in minimum coefficient of variation
3 结 语
随着PCR技术的问世,以核酸为基础的生命科学研究和临床分子诊断得到了广泛应用。最早的核酸标准物质始于丙型肝炎病毒(Hepatitis C virus, HCV)RNA(NIBSC code 06/202;06/206)[21],自此医学检验科室和试剂厂家采用国际标准物质进行定量,建立了统一的定量单位,使得检测结果不仅具有可比性,而且有了溯源性,保证了临床检测结果的可靠性。
2017年11月,美国食品和药物管理局批准的高通量测序平台,能够一次对病人肿瘤中468个基因的突变和遗传变异进行快速、灵敏的检测。以高通量测序技术为依托的分子类体外诊断试剂和仪器产品的飞速发展,将传统的单一核酸检测项目逐步推向了全基因组水平的检测。随着分子诊断产品认可度的提高,分子诊断检测将有望从体细胞基因组、游离核酸逐步向代谢水平的核酸检测发展,届时核酸定值的重要性会越发突出[22]。因此,核酸标准物质的研制也面临着极大的挑战。
本文重点介绍了核酸标准物质研制实验过程中取样量、稀释、定值方法和数据结果分析4个关键因素,为合理优化实验体系、减小实验误差和避免错误结果提供了理论依据。但核酸标准物质的研制不仅要考虑实验设计,还要考虑制作工艺,满足标准物质的均匀性、稳定性、互换性和基质效应等要求[23]。另外,标准物质需要规定用途范围和适用仪器特点,在行业内具有实用性,能够起到规范和统一行业标准的作用。希望本文工作能够指导核酸标准物质的定值实验设计,为完善核酸标准物质的研制提供参考。
