RNA结合蛋白Roquin负调控STING依赖的果蝇天然免疫反应
2020-12-18杜倍倍刘磊朱洋洋
杜倍倍,刘磊,朱洋洋
RNA结合蛋白Roquin负调控STING依赖的果蝇天然免疫反应
杜倍倍,刘磊,朱洋洋
安徽农业大学生命科学学院,合肥 230036
果蝇()利用天然免疫反应来抵御外源病原菌的入侵,其分子调控机理在进化上非常保守,深入探究果蝇天然免疫调控机制对于人类天然免疫及相关疾病研究具有重要意义。为了发掘参与调控果蝇STING信号依赖的天然免疫反应的新因子,本研究采用双链RNA介导的基因表达沉默技术和双荧光素酶报告系统,在体外S2细胞中对()、()、()、()、()、()、()、()和()共9个编码泛素连接酶的基因进行双链RNA敲低实验,结果显示()与STING天然免疫信号水平呈现负相关。进一步通过过量表达的方法在S2细胞中过表达能显著抑制STING天然免疫信号。同时,通过李斯特菌感染实验表明,敲低显著提高果蝇感染后抗菌肽的表达,并抑制病原菌的增殖,从而提高果蝇感染后的存活率。本研究证明RNA结合蛋白Roquin是STING依赖的果蝇天然免疫反应的负调控因子,由于果蝇基因和人类基因存在高度相关性,因此本研究为进一步开发人类STING相关的天然免疫疾病治疗方法提供了理论基础。
果蝇;RNA结合蛋白Roquin;STING信号通路;天然免疫
免疫系统分为天然免疫(innate immune system)和获得性免疫(adaptive immune system)两大类。天然免疫与生俱来,其反应通常极其快速,且对病原的识别具有普遍性;获得性免疫由免疫细胞针对抗原发生特异性免疫应答与免疫记忆,往往出现于天然免疫之后,但作用时间长久[1,2]。果蝇()具有易于饲养、繁殖周期短、基因组序列丰富以及只能进行天然免疫等特点,并且由于天然免疫系统中的重要分子在各个物种中十分保守,因此果蝇是研究天然免疫信号转导途径的理想模式动物。果蝇天然免疫反应和人类天然免疫反应具有高度相似性,因此研究果蝇的天然免疫调控机制对人类天然免疫疾病治疗具有重要意义[3]。
果蝇天然免疫主要包括细胞免疫和体液免疫。细胞免疫主要是通过血淋巴中的浆细胞吞噬、包囊外来病原体;体液免疫则是由Toll和Imd信号通路组成,分别与哺乳动物的TLR4 (Toll-like receptor4)和TNF (tumor necrosis factor)通路类似[4]。Toll和Imd信号通路在果蝇体内协同抵御病原菌入侵,是果蝇天然免疫系统的重要组成成分[5]。当机体受到感染时,果蝇免疫细胞通过模式识别受体(pattern recognition receptor, PRR)识别病原微生物,从而激活Toll/Dif或Imd/Relish信号通路,诱导产生抗菌肽(antimicrobial peptides, AMPs) Attacin、Diptericin、Drosocin、Defensin等,清除体内病原物[6~8]。
干扰素基因刺激因子(stimulator of interferon genes, STING)是天然免疫信号通路中的关键调控分子。在哺乳动物中,环鸟苷单磷酸(GMP)-腺苷单磷酸(AMP)合酶(cGAS)可以识别细胞质中的DNA,并催化合成第二信使——环鸟嘌呤腺嘌呤(cyclic AMP- GMP, cGAMP)激活内质网上的跨膜蛋白STING,进而诱导I型干扰素的表达[9,10]。果蝇中存在哺乳动物STING直系同源物,果蝇STING在缺少cGAS同源物的情况下,可以直接与病原菌的环二核苷酸(cyclic dinucleotides, CDNs)结合,启动宿主细胞的天然免疫反应[11,12]。李斯特菌感染果蝇时,STING通过激活NF-κB转录因子Relish,诱导产生抗菌肽Attacin和Diptericin等,降低宿主的致死率和细菌载量水平[13]。
RNA结合蛋白Roquin已被证实在固有免疫中起到重要作用[14]。在人体内,Roquin通过识别靶基因3′非翻译区的特异性茎-环结构,然后募集CCR4-NOT腺苷酸酶复合物来介导mRNA降解,并参与自身免疫的预防,Roquin的缺乏或功能障碍与自身免疫和炎症有关[15]。在小鼠()中,Roquin抑制T细胞诱导型共刺激物(the inducible T-cell co-stimulator, ICOS)和干扰素-γ (interferon-γ, IFN-γ)表达以防止T卵泡辅助细胞(T follicular helper, Tfh)积累,以及在巨噬细胞中发挥作用来抑制肿瘤坏死因子(tumor necrosis factor, TNF),预防自身抗体介导的疾病[16]。在脊椎动物中Roquin蛋白负调控T卵泡辅助细胞分化和自身免疫[17,18]。在果蝇中,同样存在Roquin蛋白的同源物,由基因编码[19],但是其是否参与调控果蝇天然免疫反应目前还未见相关研究报道。
本研究在果蝇S2细胞中利用体外RNAi和荧光素酶报告基因系统,发现果蝇基因可能负调控STING天然免疫反应信号。经过生物信息学分析,的表达产物为Roquin蛋白。为了进一步证实RNA结合蛋白Roquin是否参与调控STING信号通路,在果蝇S2细胞系中进行敲低和过表达实验,结果显示Roquin是STING信号通路的负调控因子。同时利用李斯特菌感染敲低转基因果蝇也证实了在体内负调控STING依赖的天然免疫反应。综上所述,本研究结果表明RNA结合蛋白Roquin是果蝇STING天然免疫信号的负调控因子,为进一步研究人类STING天然免疫反应调控机制以及开发相关疾病治疗新药提供理论依据。
1 材料与方法
1.1 材料
果蝇S2细胞为本实验室保存,使用Sf-900TM Ⅱ SFM (赛默飞世尔科技(中国)有限公司)细胞培养基在27℃恒温培养箱中培养。敲低转基因果蝇(Sting RNAi)购自Bloomington果蝇库存中心(31565)。果蝇使用标准培养基培养,培养条件为:温度(25±1)℃,湿度(60±5)%,12 h光和暗交替光照。
1.2 引物设计与合成
引物设计借助于Primer Premier 5.0软件完成,由生工生物工程(上海)股份有限公司合成,引物具体信息见表1。
1.3 体外转录制备双链RNA
用Trizol试剂(南京诺唯赞生物科技有限公司)提取S2细胞的总RNA,用逆转录试剂盒(北京全式金生物技术有限公司)将RNA逆转录为cDNA,以cDNA为模板进行PCR扩增,再使用T7体外转录试剂盒(南京诺唯赞生物科技有限公司)合成、以及3对双链RNA,引物序列见表1。
1.4 S2细胞转染
取对数期生长期S2细胞以2~4×107个细胞/mL种植于12孔板中,加入双链RNA,于27℃培养箱孵育。待细胞生长汇合度达到50%~60%时,使用转染试剂Lipo2000 (美国英杰生命技术有限公司)将重组质粒转染至细胞,27℃培养箱中继续培养36 h[20]。
1.5 双荧光素酶报告基因检测
用各种dsRNA和pgl3-attp-luc转染S2细胞,其中荧光素酶编码序列位于启动子下方,pac5.1-renilla作为内部对照也转染到S2细胞[20]。收集转染后的S2细胞,加入50 μL Reporter Assay Lysis Buffer,冰上裂解20 min。4℃、13,000 r/min离心10 min。取上清液20 μL加入到白色不透明的96孔板中,分别依次加入50 μL Luciferase Assay substance或50 μL Renilla Assay substance,利用酶标仪检测荧光活性,进行荧光素酶活性分析或Renilla活性分析,按照(Luc-Control)/(Rel-Control)的方式作图分析数据。
1.6 荧光定量PCR
使用Trizol试剂(南京诺唯赞生物科技有限公司)提取总RNA,并用逆转录试剂盒(北京全式金生物技术有限公司)合成cDNA,按照SYBR®Premix EX TaqⅡ(北京宝日医生物技术有限公司)产品说明书,在iCycler iQ5荧光定量PCR仪(北京安诺伦生物科技有限公司)上进行PCR扩增,结果采用2–ΔΔCt法计算、mRNA相对表达量。反应程序:95℃预变性10 min;95℃变性15 s,60℃退火60 s,40个循环;溶解曲线为75℃到95℃,每20 s升温1℃。引物序列见表1。
1.7 蛋白质免疫印迹
收集转染后的S2细胞,加入适量1×PBS,4℃、5000 r/min离心2 min,弃上清获得细胞沉淀,按照100∶1的比例加入细胞裂解液和蛋白酶抑制剂PMSF (上海百赛生物技术有限公司)混合液提取蛋白。取10 μL蛋白液进行SDS-PAGE电泳,电泳结束后转移至硝酸纤维素膜上,5%脱脂奶粉封闭,一抗选用小鼠来源的anti-Flag和小鼠来源的anti- Actin (上海西格玛奥德里奇贸易有限公司);HR标记的二抗(美国英杰生命技术有限公司)。将发光显影液(赛默飞世尔科技(中国)有限公司)按1∶1的比例适量混匀,通过凝胶成像仪(北京安诺伦生物科技有限公司)显示特异性条带。

表1 引物信息
1.8 构建rouqin敲低转基因果蝇
敲低转基因果蝇为本实验室构建,即针对目的基因的CDS序列设计双链RNA,并使之带上酶切位点I/R I(NEB),由生工生物工程(上海)股份有限公司进行引物合成(引物见表1)。将UASp-KN质粒[21]用I/R I进行双酶切并回收。将酶切后的线性UASp-KN与双链DNA进行连接、转化、鉴定并提取shmiR质粒。将shmiR质粒与Δ2-3质粒混合,对果蝇胚胎进行显微注射,构建转基因果蝇[22]。
1.9 病原菌感染和果蝇存活率
将一根细针浸入浓缩的李斯特菌过夜培养物中,感染6 d龄的成年果蝇,对照组果蝇采用无菌PBS缓冲液进行感染。感染后,清除3 h内死亡的果蝇,每天更换果蝇培养管,并统计死亡个数。每管果蝇30~35只,总数不少于100只,并进行至少3个生物学重复。
1.10 测量细菌负荷
取10只感染后的果蝇在研磨器中加入1×PBS缓冲液充分研磨,10倍、100倍、1000倍梯度稀释并接种在LB琼脂板上,30℃培养48 h,然后统计菌落数。
1.11 统计学分析
本研究均做3组重复生物学实验。荧光素酶报告系统和qRT-PCR,结果统计分析使用平均值±SD表示。双尾学生检验统计不同样本之间显著差异;果蝇感染存活实验,结果统计分析使用平均值±SD表示。使用PASW Statistics 18软件通过LogRank test分析样本之间显著差异。*表示<0.05,有差异性;**表示<0.01,差异性显著;***表示<0.001,差异性极显著,N.S.表示不具有差异性。
2 结果与分析
2.1 体外双荧光素酶报告系统建立
在S2细胞中分别加入和双链RNA,之后转染pgl3-attp-luc和pac5.1-renilla质粒,并用c-di-GMP激活STING信号,通过检测荧光素酶的活性确定在体外是否成功构建了双荧光素酶报告系统。结果显示,STING依赖的双荧光素酶报告系统在体外S2细胞中构建成功(图1A)。另外,通过qRT-PCR检测的mRNA表达量,显示敲低成功(图1B)。
2.2 CG16807(roquin)是STING信号潜在负调控因子
为筛选可能调控STING免疫信号的泛素连接酶,在S2细胞中分别对()、()、()、()、()、()、()、()和()共9个编码泛素连接酶基因进行双链RNA干扰,再转染pgl3-attp-luc和pac5.1-renilla质粒并用c-di-GMP激活信号。通过检测荧光素酶活性,结果发现相较对照组,实验组沉默基因()后,荧光素酶表达水平显著升高。上述结果表明,敲低能明显提高c-di- GMP激活的天然免疫反应水平,暗示Roquin很可能是STING天然免疫信号的负调控因子(图2)。
2.3 Roquin在STING介导的天然免疫中起负调控作用
本研究在S2细胞中转染针对的3对双链RNA,qRT-PCR结果显示,这些双链RNA均能有效敲低S2细胞中的表达(图3A)。为了进一步证实RNA结合蛋白Roquin是否参与调控STING依赖的果蝇天然免疫反应,本研究在S2细胞中利用合成的3个双链RNA敲低表达水平,双荧光素酶实验结果表明,RNAi组荧光素酶活性显著上调(图3B)。进一步通过qRT-PCR检测S2细胞中抗菌肽基因的表达,结果与预期一致,与对照组相比,在S2细胞敲低,抗菌肽基因、的表达显著升高(图3:C,D)。上述结果表明,在S2细胞中Roquin是STING天然免疫信号的负调控因子。

图1 在S2细胞构建双荧光素酶报告系统及sting敲低检测
A:STING信号荧光素酶报告系统的建立;B:S2细胞敲低验证。**:<0.01;***:<0.001。

图2 CG16807(roquin)可能负调控STING天然免疫信号通路
荧光素酶报告系统检测S2细胞中9种泛素连接酶基因RNAi后对STING信号的影响。N.S.表示不具有差异性;**:<0.01。
2.4 过表达roquin抑制STING信号通路
在S2细胞中转染不同剂量的pac5.1-flag-roquin质粒,并用c-di-GMP激活信号通路,荧光素酶活性检测结果(图4A)表明,荧光素酶活性能被显著抑制且抑制效果与作用浓度呈正相关。为进一步验证该结论,本研究利用qRT-PCR检测在激活Imd信号后S2细胞中抗菌肽基因的表达量变化。结果表明在S2细胞中过表达,抗菌肽基因和的mRNA表达均显著下降(图4:B,C)。上述研究结果表明负调控果蝇STING信号通路。
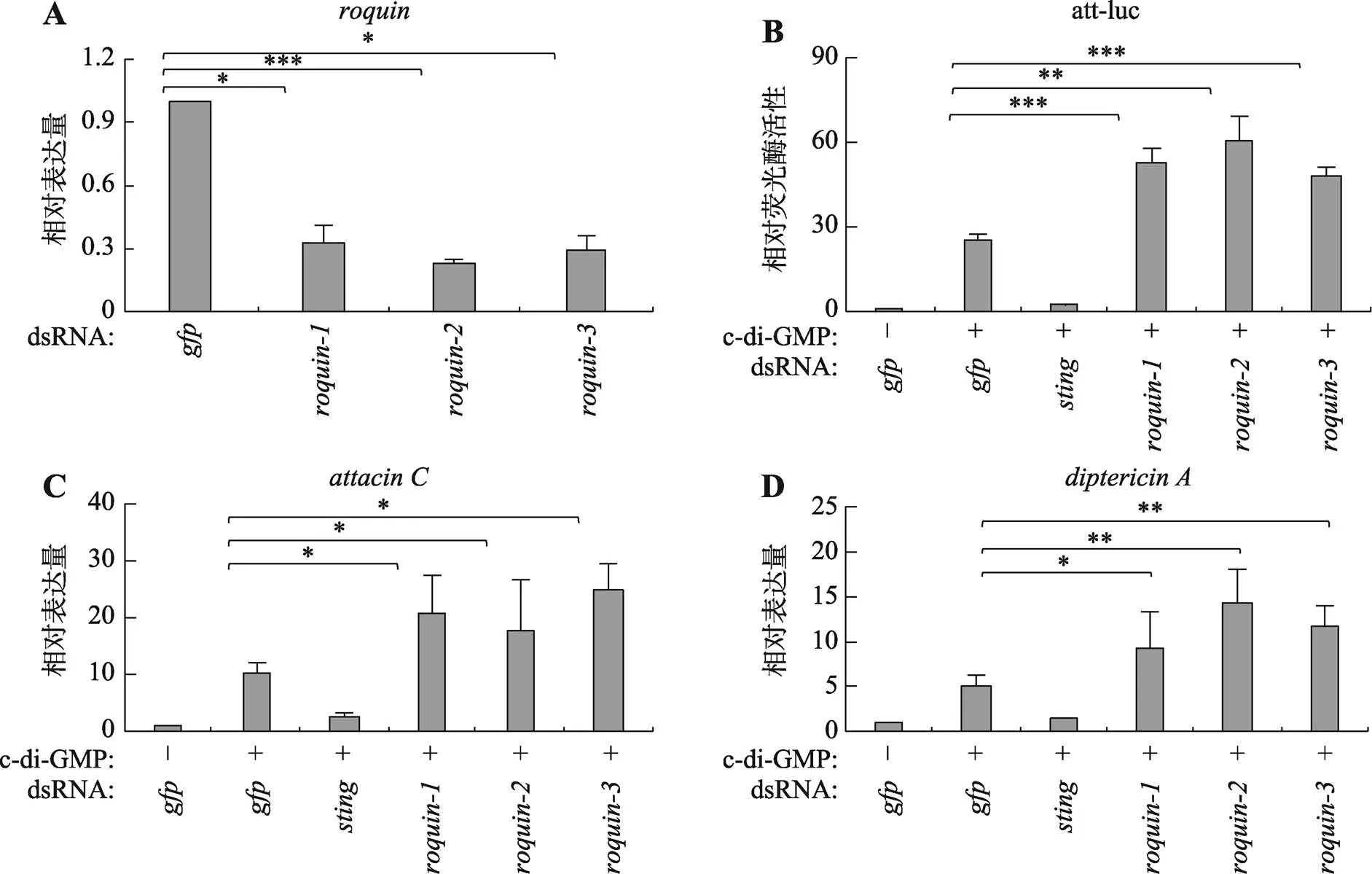
图3 Roquin负调控STING依赖的天然免疫反应
A:qRT-PCR检测双链RNA处理S2细胞后的mRNA水平;B:荧光素酶报告系统检测S2细胞中敲低后对STING信号影响;C、D:qRT-PCR检测S2细胞中敲低对抗菌肽基因、表达的影响。*:<0.05;**:<0.01;***:<0.001。

图4 过表达roquin抑制STING天然免疫信号
A:荧光素酶报告系统检测S2细胞中过表达对STING信号影响;B、C:qRT-PCR检测S2细胞中过表达对抗菌肽基因和表达的影响。N.S.表示不具有差异性;*:<0.05;**:<0.01;***:<0.001。
2.5 Roquin在体内负调控STING介导的天然免疫反应
为了确定Roquin是否在果蝇体内负调控STING依赖的天然免疫反应,本研究利用UAS-Gal4系统,通过与Ppl-Gal4杂交,获得在脂肪体组织特异敲低的转基因果蝇品系。为防止脱靶效应,本研究构建两种敲低转基因果蝇(Roquin RNAi-1#, Roquin RNAi-2#)。用李斯特菌感染6 d龄敲低(Sting RNAi)、敲低(Roquin RNAi-1#, Roquin RNAi-2#)以及对照组(Ppl-Gal4)果蝇,在脂肪体内检测下游抗菌肽基因和的mRNA表达水平。qRT-PCR检测结果表明,当用李斯特菌感染两种不同的敲低果蝇后,与对照组果蝇相比,体内抗菌肽的mRNA水平明显升高(图5:A,B)。
2.6 敲低roquin抑制果蝇感染李斯特菌后的病原菌增殖并提高存活率
本研究进一步检测敲低对果蝇感染李斯特菌后的存活率以及病原菌繁殖情况的影响。结果发现,敲低果蝇的死亡速度明显慢于对照组(Ppl-Gal4)果蝇(图6A),说明敲低能提高果蝇对李斯特菌的抵抗能力。在感染李斯特菌后的不同时间点(感染后0 d、1 d、2 d和3 d),对对照组和敲低果蝇的细菌滴度定量分析。结果表明,在果蝇体内敲低会抑制李斯特菌增殖(图6B)。综上所述,本研究结合体内外一系列实验结果表明,RNA结合蛋白Roquin负调控果蝇STING依赖的天然免疫反应。
3 讨论
由于果蝇的许多基因功能和信号通路在进化上与人类非常相近,其天然免疫系统中的重要分子在各个物种中十分保守,因此研究果蝇的天然免疫调控机制对人类先天免疫疾病的治疗有重要作用[23,24]。有研究报道,在果蝇中发现与哺乳动物相似的cGAS-STING通路,当果蝇被微生物感染,STING信号被激活,能够使Imd通路中Relish进入细胞核,产生抗菌肽,从而激活免疫应答[25]。不过,果蝇STING依赖的天然免疫反应的分子调控机理尚未有太多研究。
本研究利用RNAi和双荧光素酶报告基因系统,广泛搜寻可能参与调控STING信号的新因子,发现()可能负调控果蝇STING天然免疫信号。利用生物信息学方法在Flybase网站查询该基因表达产物为RNA结合蛋白Roquin。已有研究表明,在小鼠T细胞中缺失会增强Akt-mTOR信号和蛋白合成,导致小鼠更易患结肠炎,而抑制PI3K-mTOR信号通路可纠正缺陷型CD4+T细胞的分化[26],过表达影响CD4+T细胞的活化和增殖,并调节促炎和抗炎细胞因子IL-2和TNF-α的分泌[27]。为了探究是否参与调控果蝇STING信号通路,本研究在S2细胞中进行敲低和过表达实验,发现敲低能够提高STING信号通路的激活水平,过表达能有效抑制STING信号。上述体外实验证明在S2细胞中负调控STING介导的天然免疫反应。本研究进一步在果蝇体内鉴定Roquin的功能,发现在果蝇体内敲低后,下游抗菌肽基因和的mRNA表达量上调,果蝇体内病原菌的数量明显减少,其生存能力也有明显提高。体内实验证实RNA结合蛋白Roquin确实负调控STING依赖的天然免疫反应。

图5 敲低roquin提高果蝇感染李斯特菌后抗菌肽表达水平
A、B:qRT-PCR检测模拟感染或李斯特菌感染两种不同的RNAi果蝇后抗菌肽基因和的mRNA水平。 *:<0.05;**:<0.01。

图6 敲低roquin提高果蝇感染李斯特菌后的存活率并抑制病原菌增殖
A:在果蝇体内敲低可以提高果蝇感染李斯特菌后的存活率;B:在果蝇体内敲低能抑制李斯特菌增殖。***:<0.001。
综上所述,本研究揭示了一个调控果蝇STING天然免疫信号的新因子——RNA结合蛋白Roquin,为进一步探究人类STING在致病性感染过程中的调控方式以及开发治疗人类自身免疫性疾病新药提供了理论基础[28]。已有研究表明哺乳动物Roquin主要靶向免疫相关因子的mRNA[29],这为未来阐明果蝇Roquin负调控STING信号的分子机制提供方向和思路。
[1] Akira S, Uematsu S, Takeuchi O. Pathogen recognition and innate immunity., 2006, 124(4): 783–801.
[2] Bonjardim CA, Ferreira PC, Kroon EG. Interferons: signaling, antiviral and viral evasion., 2009, 122(1): 1–11.
[3] Bergman P, Seyedoleslami Esfahani S, Engström Y.as a model for human diseases-focus on innate immunity in Barrier Epithelia., 2017, 121: 29–81.
[4] Imler JL. Overview ofimmunity: a historical perspective., 2014, 42(1): 3–15.
[5] Hoffmann JA, Reichhart JM.innate immunity: an evolutionary perspective., 2002, 3(2): 121–126.
[6] Myllymäki H, Valanne S, Rämet M. TheImd signaling pathway., 2014, 192(8): 3455–3462.
[7] Troutwine BR, Ghezzi A, Pietrzykowski AZ, Atkinson NS. Alcohol resistance inis modulated by the Toll innate immune pathway., 2016, 15(4): 382–394.
[8] Han M, Qin S, Song XJ, Li YF, Jin P, Chen LM, Ma F. Evolutionary rate patterns of genes involved in theToll and Imd signaling pathway., 2013, 13: 245.
[9] Wu JX, Sun LJ, Chen X, Du FH, Shi HP, Chen C, Chen ZJJ. Cyclic GMP-AMP is an endogenous second messenger in innate immune signaling by cytosolic DNA., 2013, 339(6121): 826–830.
[10] Sun LJ, Wu JX, Du FH, Chen X, Chen ZJJ. Cyclic GMP-AMP synthase is a cytosolic DNA sensor that activates the type I interferon pathway., 2013, 339(6121): 786–791.
[11] Qiu Y, Zhou X. STING: from Mammals to Insects., 2018, 24(1): 5–7.
[12] Lee JJ, Andreazza S, Whitworth AJ. The STING pathway does not contribute to behavioural or mitochondrial phenotypes inPink1/parkin or mtDNA mutator models., 2020, 10(1): 2693.
[13] Martin M, Hiroyasu A, Guzman RM, Roberts SA, Goodman AG. Analysis ofSTING reveals an evolutionarily conserved antimicrobial function., 2018, 23(12): 3537–3550. e6.
[14] Athanasopoulos V, Ramiscal RR, Vinuesa CG. ROQUIN signalling pathways in innate and adaptive immunity., 2016, 46(5):1082-1090.
[15] Sgromo A, Raisch T, Bawankar P, Bhandari D, Chen Y, Kuzuoğlu-Öztürk D, Weichenrieder O, Izaurralde E. A CAF40-binding motif facilitates recruitment of the CCR4-NOT complex to mRNAs targeted byRoquin., 2017, 8: 14307.
[16] Pratama A, Ramiscal RR, Silva DG, Das SK, Athanasopoulos V, Fitch J, Botelho NK, Chang PP, Hu X, Hogan JJ, Maña P, Bernal D, Korner H, Yu D, Goodnow CC, Cook MC, Vinuesa CG. Roquin-2 shares functions with its paralog Roquin-1 in the repression of mRNAs controlling T follicular helper cells and systemic inflammation., 2013, 38(4): 669–680.
[17] Heissmeyer V, Vogel KU. Molecular control of Tfh-cell differentiation by Roquin family proteins., 2013, 253(1): 273–289.
[18] Schaefer JS, Klein JR. Roquin--a multifunctional regulator of immune homeostasis.2016, 17(2): 79–84.
[19] Athanasopoulos V, Barker A, Yu D, Tan AHM, Srivastava M, Contreras N, Wang JB, Lam KP, Brown SHJ, Goodnow CC, Dixon NE, Leedman PJ, Saint R, Vinuesa CG. The ROQUIN family of proteins localizes to stress granulesthe ROQ domain and binds target mRNAs., 2010, 277(9): 2109–2127.
[20] Ji SM, Luo YW, Cai QS, Cao ZJ, Zhao YY, Mei J, Li CX, Xia PY, Xie ZW, Xia ZP, Zhang J, Sun QM, Chen DH. LC domain-mediated coalescence is essential for Otu enzymatic activity to extendlifespan., 2019, 74(2): 363–377.
[21] Wang ZG. The guideline of the design and validation of MiRNA mimics., 2011, 676: 211–223.
[22] Ni JQ, Markstein M, Binari R, Pfeiffer B, Liu LP, Villalta C, Booker M, Perkins L, Perrimon N. Vector and parameters for targeted transgenic RNA interference inmelanogaster., 2008, 5(1): 49–51.
[23] Nainu F, Salim E, Asri RM, Hori A, Kuraishi T. Neurodegenerative disorders and sterile inflammation: lessons from amodel., 2019, 166(3): 213–221.
[24] Min KT.as a model to study human brain degenerative diseases., 2001, 7(3): 165–169.
[25] Liu Y, Cherry S. Zika virus infection activates sting-dependent antiviral autophagy in thebrain., 2019, 15(1): 174–175.
[26] Essig K, Hu D, Guimaraes JC, Alterauge D, Edelmann S, Raj T, Kranich J, Behrens G, Heiseke A, Floess S, Klein J, Maiser A, Marschall S, de Angelis MH, Leonhardt H, Calkhoven CF, Noessner E, Brocker T, Huehn J, Krug AB, Zavolan M, Baumjohann D, Heissmeyer V. Roquin suppresses the PI3K-mTOR signaling pathway to inhibit T helper cell differentiation and conversion of Treg to Tfr cells., 2017, 47(6): 1067–1082.
[27] Kim HJ, Ji YR, Kim MO, Yu DH, Shin MJ, Yuh HS, Bae KB, Park Sj, Yi JK, Kim NR, Park SJ, Yoon DH, Lee WH, Lee S, Ryoo ZY. The role of Roquin overexpression in the modulation of signaling duringandT-cell activation., 2012, 417(1): 280–286.
[28] Kato K, Omura H, Ishitani R, Nureki O. Cyclic GMP-AMP as an endogenous second messenger in innate immune signaling by cytosolic DNA., 2017, 86: 541–566.
[29] Tavernier SJ, Athanasopoulos V, Verloo P, Behrens G, Staal J, Bogaert DJ, Naesens L, De Bruyne M, Van Gassen S, Parthoens E, Ellyard J, Cappello J, Morris LX, Van Gorp H, Van Isterdael G, Saeys Y, Lamkanfi M, Schelstraete P, Dehoorne J, Bordon V, Van Coster R, Lambrecht BN, Menten B, Beyaert R, Vinuesa CG, Heissmeyer V, Dullaers M, Haerynck F. A human immune dysregulation syndrome characterized by severe hyperinflammation with a homozygous nonsense Roquin-1 mutation., 2019, 10(1): 4779.
RNA-binding protein Roquin negatively regulates STING-dependent innate immune response in
Beibei Du, Lei Liu, Yangyang Zhu
utilizes innate immune response to defend against exogenous pathogens. The molecular regulation mechanism of the process is evolutionarily conservedResearch of the regulatory mechanisms ofinnate immunity is greatly significantfor understanding the modulation of the human innate immunity and the pathogenesis of related diseases. To explore novel regulators in the STING-dependent innate immune response in, we utilized the double-stranded RNA-mediated gene expression silencing technique and the dual-luciferase
; RNA-binding protein Roquin; STING signaling pathway; innate immunity
reporter system in knockdown experiments on 9 genes encoding the ubiquitin ligase such as(),(),(),(),(),(),(),() and() in the S2 cells. The results suggested a negative correlation between() and the STING signaling pathway. Further studies showed that over-expression ofin S2 cells significantly inhibited STING innate immune signaling. Meanwhile,infection experiments showed that knocking down ofmarkedly elevated the expression levels of anti-microbial peptides and inhibited the proliferation ofthus increasing the survival rates post pathogenic infection. Taken together, our results suggested that the RNA-binding protein Roquin negatively regulates the STING-dependent innate immune response inIn view of the high correlation betweengenes and human genes, this study provides a theoretical basis for further development of treatments for STING-related innate immune diseases in humans.
2020-06-27;
2020-10-18
国家自然科学基金项目(编号:31871470)和安徽农业大学人才引进项目(编号:03080008)资助[Supported by the National Natural Science Foundation of China (No. 31871470), and Talent Introduction Project of Anhui Agricultural University (No. 03080008)]
杜倍倍,在读硕士研究生,专业方向:细胞生物学。E-mail: 1482565154@qq.com
刘磊,在读硕士研究生,专业方向:微生物学。E-mail: 13127281150@163.com
杜倍倍和刘磊并列第一作者
朱洋洋,在读博士研究生,专业方向:昆虫分子生物学。E-mail: zhuyyahau@163.com
10.16288/j.yczz.20-196
2020/12/8 9:14:06
URI: https://kns.cnki.net/kcms/detail/11.1913.R.20201204.1505.001.html
(责任编委: 严冬)
