链霉菌剂种子包衣对小麦幼穗分化及生物学特性的影响
2020-12-17刘玉涛马军妮温宏伟来航线薛泉宏
刘玉涛, 杨 斌,张 凯, 马军妮, 温宏伟,来航线, 薛泉宏
(1.西北农林科技大学资源环境学院, 陕西杨陵 712100;2.山西农业大学小麦研究所, 山西临汾 041000; 3.有机旱作山西省重点实验室, 山西太原 030000)
我国是全球最大的小麦消费国。随着人口持续增长与可利用耕地面积不断缩小,保障小麦单产水平对我国粮食安全的重要性日益突显[1]。化肥对小麦单产提高发挥了重要作用[2],但连年过量施用化肥使其利用率大幅降低[3],土壤板结及肥力下降,造成土壤生物多样性减少[4]、土壤和地下水污染等严重的环境问题[5-6]。在这种背景下,提高小麦产量且对生态环境友好的新型绿色生物技术受到了广泛关注[7]。
大量研究证实,接种有益菌可促进小麦生长。Zaheer等[8]发现,接种巴西固氮螺菌与根瘤菌能显著提高小麦产量、生物量、千粒重以及叶片表面蜡质含量。Danish等[9]研究表明,接种根瘤菌对小麦产量相关性状及叶片养分含量有正效应。Emami等[10]发现,接种假单胞菌显著提高了小麦生物量与微量元素同化率。Chandra等[11]在干旱胁迫条件下接种产ACC脱氨酶的荧光假单胞菌,发现小麦生物量、株高以及叶片养分含量均增加。Essiane-Ondo等[12]和Ma等[13]研究表明,接种丛枝菌根真菌可提高小麦产量与锌含量。
目前,关于微生物提高小麦产量的研究多集中于细菌及真菌,鲜有关于放线菌促进小麦生长的报道。作为放线菌的最大属,链霉菌主要被用于医用抗生素生产及农作物病害生物防治[14-15]。研究发现,链霉菌除了合成抗生素外,还能产生显著刺激作物生长的IAA等激素类物质,在微生物促生领域具有很大的应用价值与前景[16]。小麦的幼穗发育与分化受IAA、GA3等激素的调控,其含量直接影响成穗率、穗大小和结实性,最终对小麦产量形成产生重要影响。现有研究缺乏微生物对小麦穗发育进程及相关生物学特性影响的系统研究,难以对微生物的增产机理做出合理解释。因此,本研究利用具有产铁载体、IAA、ACC脱氨酶及解磷功能的2株链霉菌[17]发酵菌剂对小麦种子进行包衣,通过田间试验研究链霉菌种子包衣对小麦穗发育进程的影响,并对小麦不同生育时期的生物学、生理生化特性及产量相关性状进行研究,旨在探明链霉菌种子包衣对小麦的效应,为采用微生物技术提高小麦单产提供新思路。
1 材料与方法
1.1 材料与设计
供试小麦品种:小偃22号,由本课题组保存。
供试链霉菌:娄彻氏链霉菌(Streptomycesroche,D74)和密旋链霉菌(Streptomycespartum,Act12),由西北农林科技大学资源环境学院微生物资源研究室分离鉴定。链霉菌粉D74、Act12中的有效活菌数分别为3.5×1010cfu·g-1、2.3×108cfu·g-1,将其按质量比1∶1进行混合,得到混合菌剂。
种子包衣处理:参照刘玉涛等[18]方法进行。2015年,按种子质量的5%、10%(相当于每粒种子包衣量为2.5 mg、5 mg,分别用T2.5、T5表示)用量将D74与Act12混合菌粉撒入已加胶结剂的小麦种子中搅拌,使菌剂均匀包裹在小麦种子表面,晾干即可。2016年,减少包衣量,按种子质量的4%、8%(相当于每粒种子包衣量为2 mg、 4 mg,分别用T2、T4表示)进行包衣。
小区试验:2015年10月13日将对照(CK,种子不做任何处理)、包衣处理(T2.5、T5)的种子种植于陕西杨陵鹏程生物科技公司试验田。随机区组排列,3次重复,小区面积为34.2 m2(18.0 m×1.9 m),按照行距20 cm进行人工开沟点播,每行播70 g种子。底肥为复合肥(N∶P2O5∶K2O=15∶15∶15)1 020 kg·hm-2与有机肥(有机质含量≥40%)3 660 kg·hm-2,一次性施入。2016年,按照设计在原试验区重复种植方案。
1.2 测定指标与方法
1.2.1 生物学性状测定
分别在小麦分蘖期(2015年12月26日)与返青期(2016年2月25日),每小区随机选取10株代表性植株,测定单株鲜重、0~20 cm土壤根系鲜重、初生根与次生根数量和鲜重。分蘖数测定参照彭 静等[19]方法进行。
分别于灌浆中期(2016年5月19日)及灌浆末期(2016年5月24日),每个小区随机采10株小麦穗,统计每穗的小穗数、每个小穗的籽粒数、穗粒数、籽粒鲜重和干重。
1.2.2 光合特性及生理生化指标测定
在灌浆前期(2016年5月5日)、灌浆中期(2016年5月19日)采用SPAD-502叶绿素仪测定小麦旗叶叶片SPAD值;采用LI-6400P光合仪测定小麦旗叶的净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)及胞间CO2浓度(Ci),按公式(1)计算单叶水分利用率(Wue)。为保证试验一致性,SPAD与光合速率测定在同一片旗叶上进行,测定时间均为上午9:00-12:00。方法:每个小区随机选取8株具有代表性的小麦植株,在植株旗叶中部做好标记,先测定旗叶叶片SPAD值,后在相同部位测定光合速率。每处理共测定24片旗叶。
单叶水分利用率(WUE)=净光合速率(Pn)/蒸腾速率(Tr)
(1)
叶片过氧化物酶(POD)、苯丙氨酸解酶(PAL)、多酚氧化酶(PPO)和硝酸还原酶活性及可溶性蛋白含量、MDA含量及根系活力测定参照赵 娟等[20]方法。植物样品:分蘖期样品以2015年12月26日测定分蘖期生物学性状所采全植株为供试材料;灌浆期以2016年5月19日测定光合作用的植株旗叶(每小区取5株)为供试材料。植株与叶片处理方法:分蘖期,将每个小区5株幼苗的所有叶片剪下,洗净剪碎后充分混匀,每个小区1个混合样,从3个重复小区共得到3份小区叶片混合样;灌浆期,将每个小区所采5株小麦的旗叶剪下,洗净后剪碎混匀,共得到小区旗叶混合样3份。3次重复。
按以上方法采样,所得生物学与生化性状测值均来自相同植株;叶片SPAD值、光合速率及生化特性测值均来源于相同叶片,以保证生物学与生化特性相关分析所用材料相同。
1.2.3 穗发育进程观察
在小麦幼穗发育特征比较明显的生长锥形成期、单棱期、二棱期、护颖分化期、小花原基分化期和雌雄蕊原基分化期,分别从田间选取长势均一、具有代表性的CK、T2.5及T5处理的小麦幼苗主茎,在解剖镜下观察幼穗结构,计数各种类型的原基数,并用ToupView软件拍照。
1.2.4 产量相关性状测定
收获期样品采集及产量测定:在小麦收获前1天采样。2015年,每个小区随机选取2个1 m2的样区收获,测定穗性状(单位面积有效穗数、每穗小穗数、穗粒数、千粒重)和产量;采样区外小麦实收,单独脱粒、晒干称重,与取样区籽粒合并,计算实际产量。2016年,每小区随机选取1行收获(每行面积均为3.8 m2),带回实验室,剪下麦穗,混匀,按10%抽样,所抽样品用于穗性状分析,剩余部分晒干脱粒称干重,合并计算产量。
按单穂质量>2 g为大穗、1~2 g为中穗、<1 g为小穗划分标准,统计每个处理中的大、中、小穗数量及所占比例;统计每穗中4、3、2、1粒小穗的个数及其所占比例。
1.3 数据处理
采用Excel 2010和SPSS 20进行数据处理,测定结果用“平均值±标准差”表示。
2 结果与分析
2.1 链霉菌包衣对小麦幼穗分化的影响
链霉菌包衣可加快小麦幼穗分化,使分化期提前。如图1A显示,在生长锥伸长期,链霉菌包衣处理的生长锥的长度较对照明显增加,生长锥的长度呈现T2.5>T5>CK的趋势。从图1B可看出,在单棱期,链霉菌包衣处理的小穗原基的凸起程度明显高于对照,当T2.5和T5处理生长锥上的小穗原基凸起已相当明显,且出现多个小穗原基时,对照的生长锥仍然保持光滑状态,尚无明显的小穗原基形成;小穗原基凸起程度呈现T5>T2.5>CK的趋势。
从图2A和图2B可看出,在二棱期至护颖分化期,对照中已完成分化的小穗原基较少,链霉菌包衣处理的小穗原基数量明显多于对照。当对照的幼穗正处在二棱期,小穗原基上还未分化出其他穗结构时,链霉菌包衣处理幼穗上的大部分小穗已进入护颖分化期,小穗原基上面已明显分化出小穗顶端生长锥、小花原基、外稃、颖片等结构。
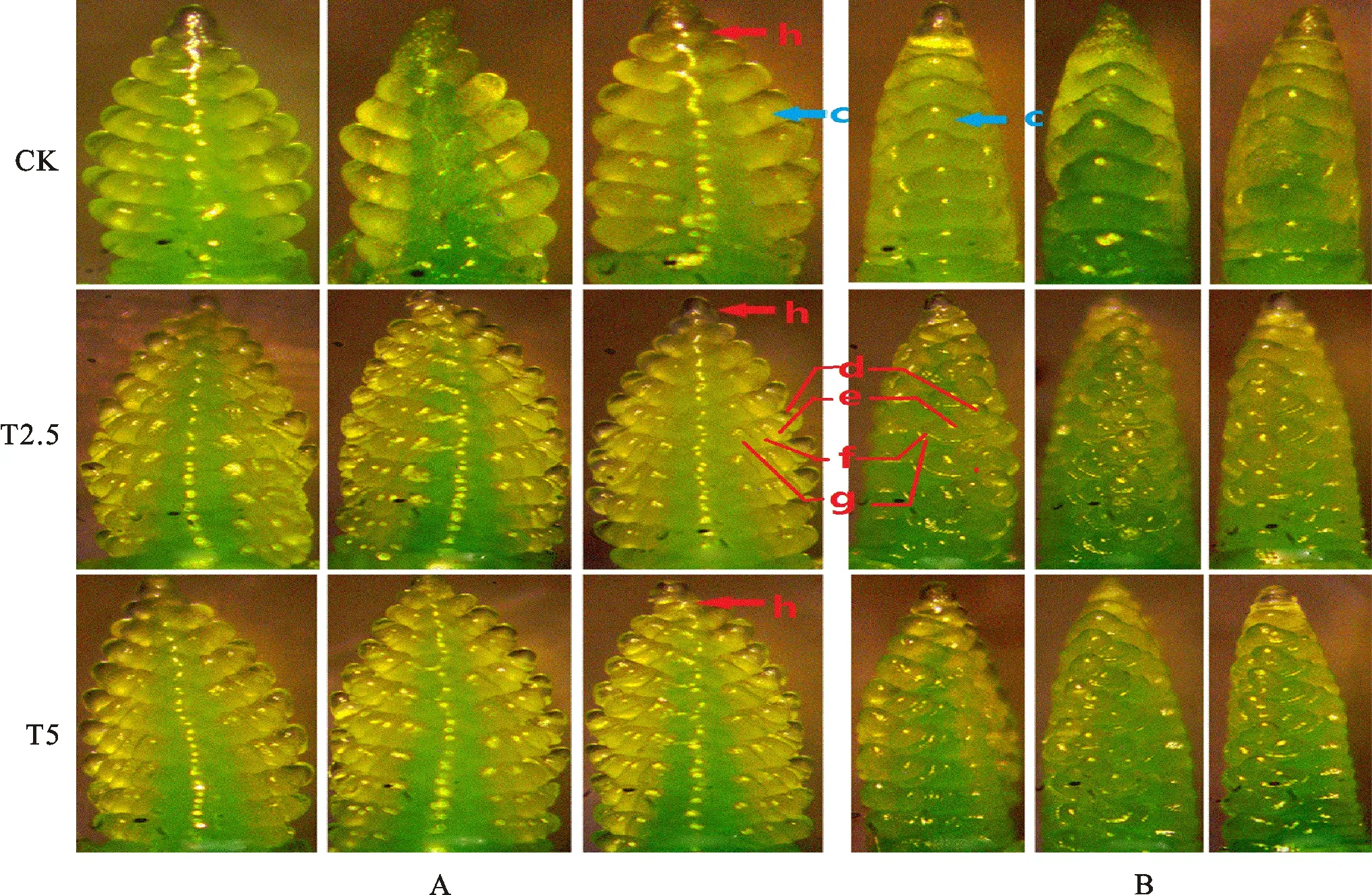
c:小穗原基;d:小穗顶端生长锥;e小花原基;f:外稃;g:颖片;h:顶端小穗。
由图3A和图3B可看出,在雌雄蕊原基分化期,对照和菌剂包衣处理的小穗原基上的部分小花原基虽然都有雌蕊原基、雄蕊原基分化形成,但对照小花原基上分化出的雌、雄蕊原基数量较少,且分化程度低;从对照小穗原基的第一朵小花原基上分化出的雌、雄蕊原基数量少,而从链霉菌包衣处理小穂原基上的第一朵小花原基上分化出的雌、雄蕊原基数量多。
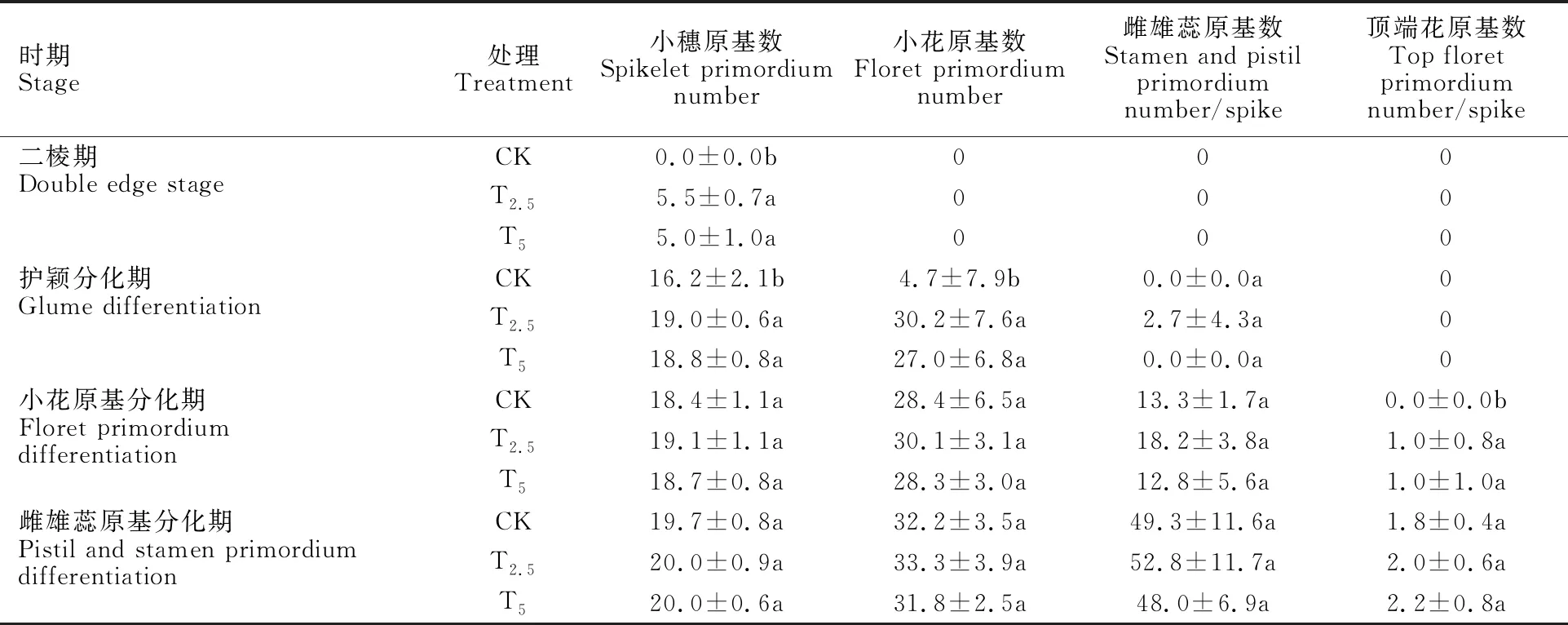
表1 链霉菌种子包衣处理对小偃22单个幼穗分化的影响Table 1 Effect of seed coating treatment of Streptomyces on single panicle differentiation of Xiaoyan 22
由表1可知,在小麦幼穗分化过程中,与对照相比,链霉菌包衣处理小麦在二棱期分化出的小穗原基数显著高于对照(P<0.05),在护颖分化期,链霉菌包衣处理T2.5和T5处理的小穗原基数、小花原基数均较对照显著增加(17.3%和 16.0%、542.6%和474.5%,P<0.05)。在小花原基分化期,链霉菌包衣处理小麦较对照的顶端花原基数显著增加(P<0.05)。说明链霉菌包衣处理显著加速了小麦幼穗的分化进程,使各分化期提前。随着幼穗继续分化,到雌雄蕊原基分化期包衣处理小麦较对照的雌雄蕊原基数和顶端花原基数差异均不显著,说明链霉菌包衣处理仅加速了幼穗的分化进程,使各分化期提前,但对小穗数量无显著影响。
2.2 链霉菌包衣对小麦生物学特性的影响
由表2可知,链霉菌包衣对小麦不同生物学特性影响程度不同。在分蘖期,T2.5处理植株总鲜重及根系鲜重分别较对照增加29.4%及 50.0%,差异均显著(P<0.05)。在返青期,T2.5和T5处理的根系鲜重均较对照增加75.0%,差异均显著(P<0.05)。其余被测指标在各处理间差异均不显著。
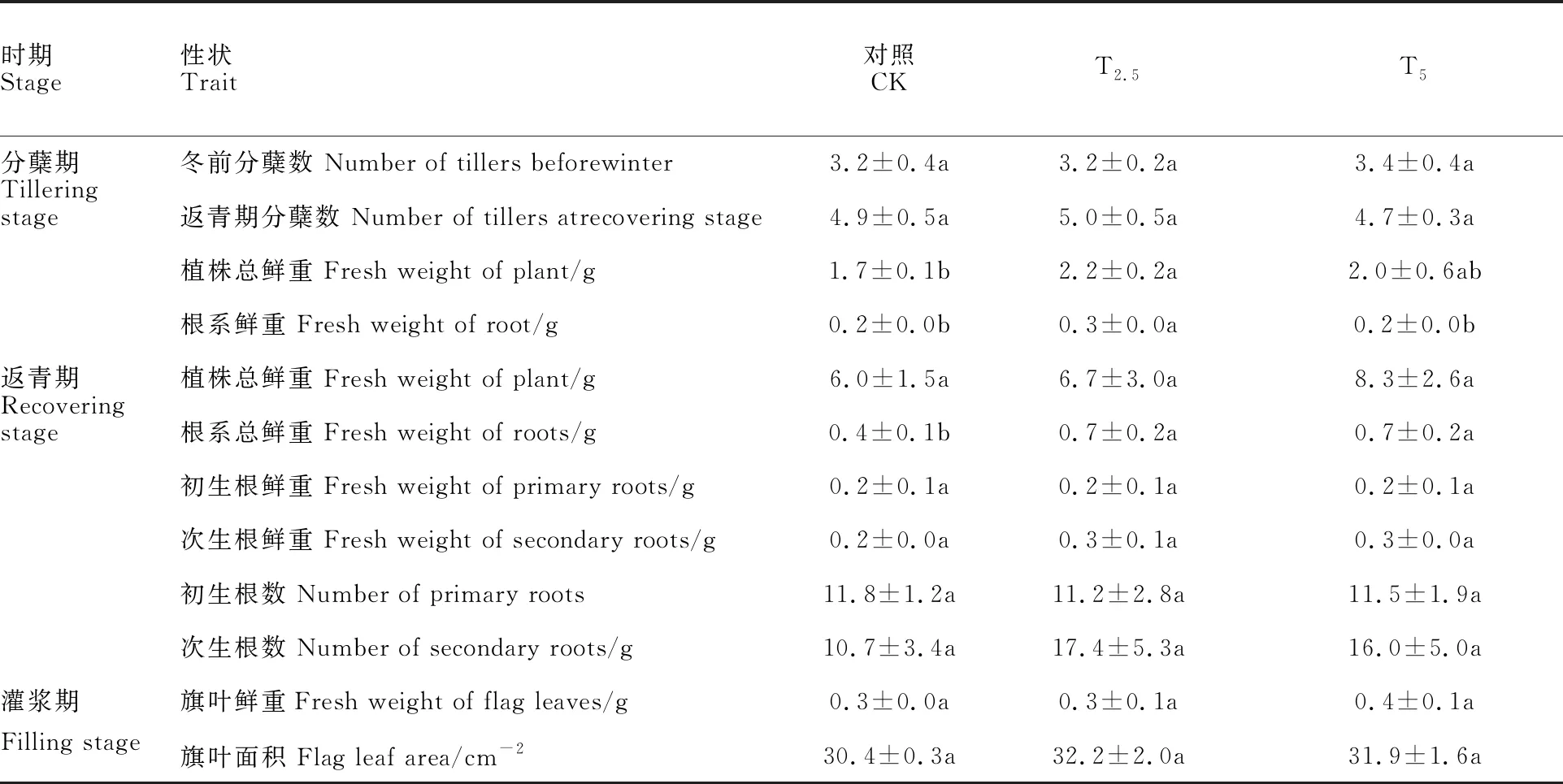
表2 链霉菌包衣对小麦单株生物学特性的影响(N=30,2015)Table 2 Effect of Streptomyces inoculation on biological characteristics of single wheat
2.3 链霉菌包衣对小麦叶片生化特性及根系活力的影响
由表3可知,在分蘖期,T2.5处理的小麦叶片POD活性较对照提高21.2%,差异显著(P< 0.05);灌浆期,T5处理的小麦旗叶PPO活性较对照提高29.4%,差异显著(P<0.05)。其余菌剂包衣处理对小麦叶片POD、PPO、PAL活性均无显著影响。
由表3可知,在灌浆期,包衣处理对小麦旗叶MDA含量、硝酸还原酶活性及根系活力有明显影响,其中,T5处理的小麦旗叶MDA含量较对照降低36.8%,差异显著(P<0.05);T2.5和T5处理的小麦旗叶硝酸还原酶活性较对照分别提高37.4%、65.9%,差异均显著(P<0.05);T5处理小麦根系活力较对照增加24.3%,差异显著(P<0.05);两种包衣处理的小麦旗叶可溶蛋白含量较对照均有增加,但差异不显著。在分蘖期,包衣处理的叶片MDA含量及根系活力与对照均无显著差异。
2.4 链霉菌包衣对小麦光合特性的影响
链霉菌剂包衣在灌浆期对小麦叶片各光合参数均具有一定程度的影响(表4)。在灌浆初期,除胞间CO2浓度之外,T2.5和T5处理的其余被测指标均高于对照,其中T5处理的净光合速率较对照显著提高(41.6%)。在灌浆中期,所有被测指标在两种包衣处理与对照间的差异均不显著。

表3 链霉菌包衣处理对小麦叶片生化特性及根系活力的影响(N=15,2015)Table 3 Effect of seed coating with Streptomyces on biochemical characteristics of wheat leaves and root activity
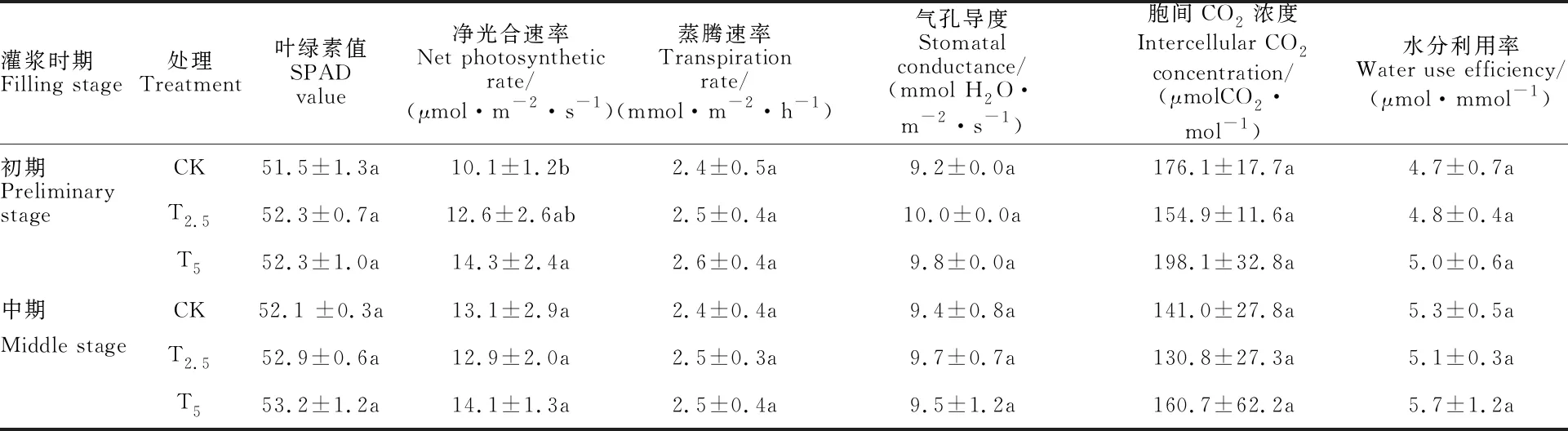
表4 接种链霉菌对小麦光合特性的影响(N=24,2015)Table 4 Effect of Streptomyces inoculation on photosynthetic characteristics of wheat
表5 链霉菌菌粉种子包衣处理对小麦穗性状的影响(N=30, 2015)Table 5 Effect of seed coating treatment of Streptomyces on spike characters of wheat
2.5 链霉菌包衣对小麦产量及相关性状的影响
从表5可知,灌浆末期,T2.5和T5处理的穗粒重(鲜重)较对照分别增加14.8%和11.1%,差异均显著(P<0.05)。链霉菌包衣对有效穗数、千粒重和小穗数均无显著影响,但对穗粒数影响明显,T2.5处理的大、中、小型穗穗粒数均较对照增加,其中大型穗的穗粒数增幅最大。尽管链霉菌包衣处理对穗粒数的影响从统计学角度未达到显著水平,但T2.5处理的产量较对照提高了 4.9%,差异显著(P<0.05),这是由于小麦的群体很大,虽然单位面积有效穗数和千粒重没有明显变化,但穗粒数的微小增加也会引起小麦单产较大幅度地提高。
由图4可知,不同处理群体中的大、中、小型麦穗所占比例不同,其中,T2.5处理的大型穗所占比例较对照增加30.8%,差异显著(P<0.05),中型穗比例略有增加,小型穗所占比例较对照降低22.7%,差异显著(P<0.05)。由表6可知,在灌浆末期,T2处理的大型穗比较对照增加 50.9%,差异显著(P<0.05),小型穗占比较对照减小;在收获期,T2和T4处理的大穗占比均较对照增加,小型穗占比均较对照减小。
从图5a看出,菌剂包衣处理对小麦穗中不同粒数小穗所占比例影响明显。在灌浆中期,T2.5和T5处理的4粒小穗分别占其小穗总数的19.9%和23.0%,较对照分别提高27.6%和 47.4%,差异均显著(P<0.05);2粒小穗所占比例较对照分别增加10.7%和3.1%,前者差异显著(P<0.05);1粒小穗所占比例较对照分别下降9.5%和39.3%,后者差异显著(P<0.05),表明菌剂包衣能提高小麦结实数,增加多粒小穗比例。从图5b看出,灌浆末期的测定结果整体具有类似趋势。
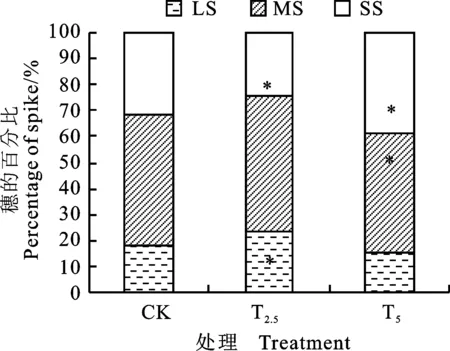
SS:小穗; MS:中穗; LS:大穗;CK:对照;*表示处理与对照间差异在0.05水平达到显著。下同。
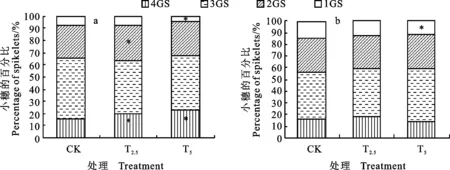
4GS:4粒小穗; 3GS:三粒小穗; 2GS:二粒小穗; 1GS:1粒小穗,下同。
从图6可知,菌剂包衣影响大、中、小型麦穗中不同粒数小穗所占比例。在大型穗中(图6a),T2.5和T5处理的4粒小穗所占比例较对照分别增加43.2%和降低24.8%,差异均显著(P< 0.05),1粒小穗所占比例较对照分别降低34.5%和增加45.1%,差异均达显著水平(P<0.05)。在中型穗中(图6b),T2.5处理的4粒小穗较对照降低 64.0%,差异达显著水平(P<0.05)。在小型穗中(图6c),T2.5和T5处理3粒小穗所占比例均较对照有所增加,1粒小穗所占比例均较对照有所减少,但差异均未达显著水平。说明适量菌剂包衣可提高不同穗型中多粒小穗的比例,从而增加穗粒数;但菌剂使用量过大,则会降低多粒小穗的数量。
从表6可知,灌浆末期,T2和T4处理的穗粒重(干重)分别较对照增加16.9%和13.1%,差异均显著(P<0.05);T2处理的大穗百分比较对照提高50.9%,差异显著(P<0.05)。T2和T4处理的产量均较对照有所提高。结合两年试验结果(表5、表6)分析可知,适当浓度的链霉菌包衣可以提高小麦产量,穗粒数的增加是增产的主要途径,链霉菌包衣量过大则有抑制作用。
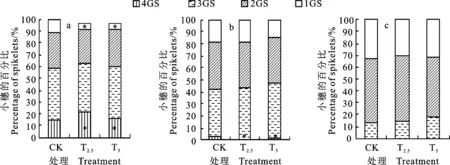
图6 链霉菌剂对大(a)、中(b)、小型穗(c)的穗粒数影响Fig.6 Effect of Streptomyces on the number of grains per spike of large(a), medium(b) and small panicle(c)

表6 链霉菌菌粉种子包衣处理对小麦穗性状的影响(2016)Table 6 Effect of seed coating treatment with Streptomyces on spike characters of wheat
3 讨 论
研究表明,微生物促进作物生长的可能机制为:产生IAA、CTK等植物激素类物质,促进植株生长[10, 21-22];生物固氮或溶解土壤中不能利用的磷、钾和铁等矿质元素,提高土壤养分的可利用性[8, 10, 23-27];产生ACC脱氨酶、胞外多糖等物质,提高作物对干旱、盐胁迫等逆境的抗性[9, 11, 28-31]。
本试验所用两株链霉菌系本项目组分离筛选自中国西北极端生境,其中,Act12能产IAA和ACC脱氨酶,并具有解磷和产铁载体的能力[17]。前期盆栽试验发现,接种Act12和D74混合菌剂有效提高了小麦种子发芽率和发芽指数,对苗期小麦叶片酶活力提高有明显促进作用[18]。本研究进一步开展田间试验并发现,采用Act12和D74菌剂进行小麦种子包衣,能加速小麦穗分化过程。
小麦幼穗分化过程一般分为生长锥伸长期、单棱期、二棱期、护颖分化期、小花分化期、雌雄蕊形成期、药隔形成期和四分体形成期[38]。其中,二棱期至顶小穗形成期对小麦产量影响最大[39]。本研究发现在穗发育过程中,接种链霉菌不仅在二棱期至雌雄蕊原基分化期能够加快穗发育进程(图1-3),这对促进穗器官的建成具有重要意义。推测该促进作用的可能原因:接种链霉菌刺激了小麦根系尤其是次生根和根毛的生长,促进其对N、P等矿质养分的吸收,充足的养分为穗器官形态建成提供了必要的物质[40];链霉菌Act12和D74除了产IAA、ACC脱氨酶、解磷和产铁载体的能力之外,还产生6-苄氨基嘌呤、激动素及脱落酸等(待发表),这些植物激素可能对小麦穗分化过程产生影响;供试菌还可能产生赤霉素等代谢产物,而适宜的赤霉素浓度可促进小穗、小花分化,但浓度过高则抑制小穗、小花分化[41]。本研究中,处理T2.5(低浓度)增加了小花原基和雌雄蕊原基数量,但处理T5(高浓度)降低了小花原基和雌雄蕊原基数量,从侧面证实了植物激素的存在及其作用的推论。
本研究表明,链霉菌Act12和D74混合菌剂包衣,在分蘖期对小麦根系鲜重具有显著促进作用,且在返青期对根系鲜重的促进作用更为明显。在返青期,接种链霉菌剂的小麦初生根条数较对照减少,但次生根条数和鲜重大幅度增加,植株总鲜重也较对照有所提高。研究发现,促生细菌通过产生IAA刺激小麦根系生长发育[32],降低初生根的生长速度[33],增加次生根的数量和长度[34-35],并刺激根毛生长[36],增加对矿质元素和水分的吸收,最终促进整个植物生长[32, 37]。这种促生效应随着作物的生长发育具有累积性[37],在小麦生长早期尤为明显[37]。
本研究发现,链霉菌包衣提高了小麦叶片POD、PPO活性和可溶性蛋白含量,降低了MDA含量,这4个生化指标与植物抗逆性密切相关,其中,POD和PPO具有清除活性氧的能力;可溶性蛋白增加可提高细胞渗透调节能力;MDA降低有利于维持细胞膜结构的完整性。这4个指标的变化反映出链霉菌包衣可诱导小麦氧化损伤修复机制,提高了小麦抵御逆境的能力。Qin等[42]与Zaheer等[8]的研究也得到了类似的结果。叶片硝酸还原酶和根系活力与氮素同化利用及养分吸收密切相关[37],本研究发现,链霉菌包衣显著提高了灌浆期小麦旗叶硝酸还原酶活性和根系活力,根系活力的提高对小麦吸收土壤养分、灌浆能力提高及产量增加有重要作用,这也与前期根系生物量的显著增加结果吻合。此外,旗叶硝酸还原酶活性与蛋白质合成及籽粒形成呈正向关系,即酶活性愈高,产量愈高[46]。
旗叶是小麦灌浆期最主要的光合器官,其净光合速率反映了光合能力[8],最终决定了小麦产量[43]。本研究发现,在灌浆初期,链霉菌包衣显著提高了小麦旗叶的净光合速率,有效提高了叶片的光合能力。Ahmed等[44]和Zaheer等[8]发现接种细菌也能有效提高叶片净光合速率。
本研究发现,链霉菌包衣可增加小麦穗中多粒小穗比例及大穗率,通过增加穗粒数提高小麦产量,但对小穗数和千粒重没有明显影响。其他研究表明,接种促生细菌对小麦千粒重、单位面积穗数和穗粒数均有促进作用[8, 24, 32, 45]。造成这种差异的机制尚待进一步研究。
4 结 论
采用适宜浓度的链霉菌剂进行种子包衣对小麦生育前期生物学特性影响显著,能提高小麦叶片酶活性与光合能力;加速小麦穗分化进程;通过增加穗粒数提高小麦产量。
