黄芪丹参配伍提取物在大鼠缺血性心肌中的调控作用及机制
2020-12-16李梦华张瓅方
李梦华, 张瓅方
(1.南阳医学高等专科学校, 南阳 473061; 2.南阳理工学院, 河南省张仲景方药与免疫调节重点实验室, 南阳 473004)
因冠状动脉梗阻诱发心肌梗死(myocardial infarction,MI),是导致心律失常甚至心力衰竭的重要原因之一,MI已成为心血管死亡的主要原因[1]。有研究证实心肌纤维化、氧化应激和炎症反应可明显促进MI的发生,因缺血缺氧导致心肌细胞死亡是MI的主要特征[2-3]。近些年,关于血管新生在MI中的积极作用已被肯定。据报道,基于血管新生在MI模型中的新疗法,如给予外源性血管生成因子、诱导多能干细胞、移植间质干细胞等,可有效促进MI中血管新生改善心肌重塑[4]。血管内皮生长因子(vascular endothelial growth factor,VEGF)是当前已知的促血管再生中活性最高的特异性生长因子,VEGF及其受体在整个血管生成、迁移等血管新生过程中发挥重要的调节作用[5]。
课题组在前期研究中发现中药经典配伍药对黄芪和丹参提取物可显著提升MI大鼠骨髓源性内皮祖细胞的促血管再生作用[6]。基于中医“益气化瘀生新”理论与现代血管新生疗法的相似之处,在本研究中,将复制MI大鼠模型,假设通过低氧诱导因子(hypoxia-inducible factor 1 alpha,HIF-1a)和下游重要靶基因VEGF有关通路调节血管再生功能,研究黄芪丹参配伍提取物在缺血性心肌中的潜在修复作用。
1 材料
1.1 动物
10周龄清洁级雄性SD(Sprague Dawley)大鼠,体重(220±30) g,购自上海义森生物科技有限公司[合格证号SCXK(沪)2018-003]。饲养于12 h明暗交替、室温23~26 ℃、空气湿度55%~65%的环境中,实验动物及过程符合人道主义原则并经南阳理工学院动物伦理委员会批准(批准号:NYISTEEC-2017026)。
1.2 主要药物、试剂和仪器
中药黄芪和丹参提取物已在国家自然科学基金项目“黄芪丹参提取物配伍调控PKD1-HDAC5/HDAC7-VEGF轴促血管新生的作用机制研究”(No.81473438)基础上完成提取,其中测得黄芪总苷含量71.3%,丹参总酚酸含量66.4%。HIF-1a抗体(货号:PB0245,上海启明生物科技有限公司);血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)抗体、磷酸化血管内皮生长因子受体2(phosphorylated vascular endothelial growth factor receptor 2,p-VEGFR2)抗体(货号:Y1169、Y1175,巴傲得生物科技有限公司上海分公司)、蛋白质丝氨酸苏氨酸激酶(v-akt murine thymoma viral oncogene homolog,AKT)抗体、磷酸化蛋白质丝氨酸苏氨酸激酶(phosphorylated v-akt murine thymoma viral oncogene homolog,p-AKT)抗体(货号:ybP004、ybP001,上海钰博生物科技有限公司)、Isolactin B4抗体(货号:fl-1201,Vector Laboratories,美国);Masson染色试剂盒(货号:SG542-1,上海古朵生物科技有限公司)、二辛可宁酸(bicinchoninic acid,BCA)蛋白质检测试剂盒(货号:P2359,上海碧云天生物技术有限公司)、Trizol试剂(货号:FE4256,北京华迈科生物技术公司);动物超声成像仪(S-Sharp Prospect,上海迪博斯生物科技有限公司)、生物病理切片机(型号:徕卡TD45,上海聚慕医疗器械有限公司)、荧光显微镜(型号:TL3201,上海缔伦光学仪器有限公司)。
2 方法
2.1 MI模型复制及分组给药
MI大鼠模型复制选用结扎冠状动脉左前降支的方法造模[7]。通过向大鼠腹腔注射戊巴比妥钠(60 mg/kg)进行麻醉,以仰卧位固定头部及四肢在动物手术台上,进行气管插管保持呼吸道通畅。大鼠胸部备皮后沿左侧第三肋间依次切开直至暴露心脏。用9-0手术线穿过肺动脉根部和左心耳之间的左前降支进行结扎,可见左心室广泛前壁色泽由红变灰白成为梗死区。假手术组穿线不结扎,造模成功后逐层缝合,术后为预防感染持续3 d选用青霉素钠80万单位行腹腔注射。实验大鼠随机分为黄芪丹参配伍提取物组[H+D组,40 mg/(kg·d)]、假手术对照组(Sham组,等量生理盐水)和模型组(MI组,等量生理盐水)各15只,采用尾静脉药物注射连续4周。
2.2 超声心动图检测
在药物干预的第2周和第4周采用30 MHz超声探头进行超声心动图测量,评估各组MI大鼠的心脏功能。测算左心室收缩分数(left ventricular fractional shortening,LVFS)和左心室射血分数(left ventricular ejection fraction,LVEF)。
2.3 Masson染色法测量
MI大鼠心脏摘除后固定于10%的甲醛24 h,石蜡包埋切成4 μm厚度切片。采用Masson染色试剂盒复染后测量MI大鼠心肌纤维化程度,使用Image Pro Plus图像处理分析软件(6.0版)测算MI心肌胶原的纤维化面积,并按整个心室面积的百分比进行计算。
2.4 免疫荧光法检测
将心肌载玻片在4 ℃下用标记的Isolectin B4(1∶50)荧光素孵育过夜,并用染料DAPI封闭。荧光显微镜放大200倍下对心肌载玻片进行盲检。使用Image Pro Plus图像处理分析软件(6.0版)分别在心肌的梗塞区、周围梗塞区和边缘区三个区域的组织切片中采集分析B4抗体阳性细胞。
2.5 免疫组织化学染色
心肌石蜡切片进行脱蜡、脱水处理,然后用磷酸盐缓冲液(PBS)在微波炉加热进行抗原修复后,用3%的过氧化氢蒸馏水中培养阻断内源性过氧化物酶活性。4 ℃黑暗环境下加入HIF-1a抗体、p-VEGFR2抗体和p-AKT抗体孵育12 h,切片用苏木精复染,中性树脂封闭。
2.6 蛋白质印迹法(western blot)分析
采用RIPA裂解液溶解MI大鼠心肌组织,4 ℃下以12 000 r/min的速度离心8 min后,吸取上清液,采用BCA蛋白检测试剂盒依照产品说明书操作步骤进行检测蛋白浓度。经过十二烷基黄硫酸钠-聚丙烯酰胺凝胶电泳后分离蛋白后移动至聚偏二氟乙烯膜。常温下选用适量的三羟甲基氨基甲烷盐酸盐缓冲盐溶液洗膜,将细胞膜与甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(1∶1 000)、HIF-1a抗体(1∶200)、VEGFA抗体(1∶1 000)、AKT抗体(1∶1 000)、P-AKT抗体(1∶1 000)在4 ℃孵育过夜。将膜与辣根过氧化物酶结合的二抗在室温环境下共同孵育1 h后,磷酸盐缓冲溶液每次洗膜3 min,反复3次。加入化学荧光试剂后,曝光显色成像,采用定量分析系统读片。
2.7 定量实时聚合酶链反应(qPCR)分析
取MI大鼠心肌组织进行匀浆离心后,采用Trizol试剂提取组织中的核糖核酸(ribonucleic acid,RNA),反转录扩增为互补脱氧核糖核酸(complementary DNA,cDNA)。引物设计如下:HIF-1a上游引物5′-CCGGTAGGCTTGCTT-3′,下游引物5′-TGCGGACTCAGCCT-3′;VEGFA上游引物5′-TCCTAACAGCAGCAGGCG-3′,下游引物5′-ACCGGTCAAGGCTAATCC-3′;GAPDH上游引物5′-CTACCGGCTGACCGGACC-3′,下游引物5′-ATGGTTCCGGATCGCCTT-3′。参照聚合酶链式反应(polymerasechain reaction,PCR)扩增后2%琼脂糖凝胶电泳进行图像摄录分析,各目标基因与内参GAPDH基因灰度片段比值作为自身基因信使核糖核酸(messenger RNA,mRNA)的表达量。
2.8 统计分析

3 结果
3.1 黄芪丹参配伍提取物对MI大鼠心功能的影响
药物干预4周后,模型组存活12只,黄芪丹参配伍提取物组存活14只,假手术对照组无死亡。在实验过程的第2周和第4周,采用超声心动图测量各组MI大鼠的左室射血功能,评价心肌收缩力。与假手术对照组第2周和第4周相比,模型组和黄芪丹参配伍提取物组的LVFS和LVEF明显降低(P<0.05)。在心肌梗死后的第2周,模型组和黄芪丹参配伍提取物组的LVFS和LVEF相比无明显差异(P>0.05)。4周后,与模型组相比,黄芪丹参配伍提取物组的LVEF和LVFS均明显升高(P<0.05)。表明经过4周的药物干预,黄芪丹参配伍提取物对MI大鼠的左室射血功能和心肌收缩力有一定改善,如图1所示。
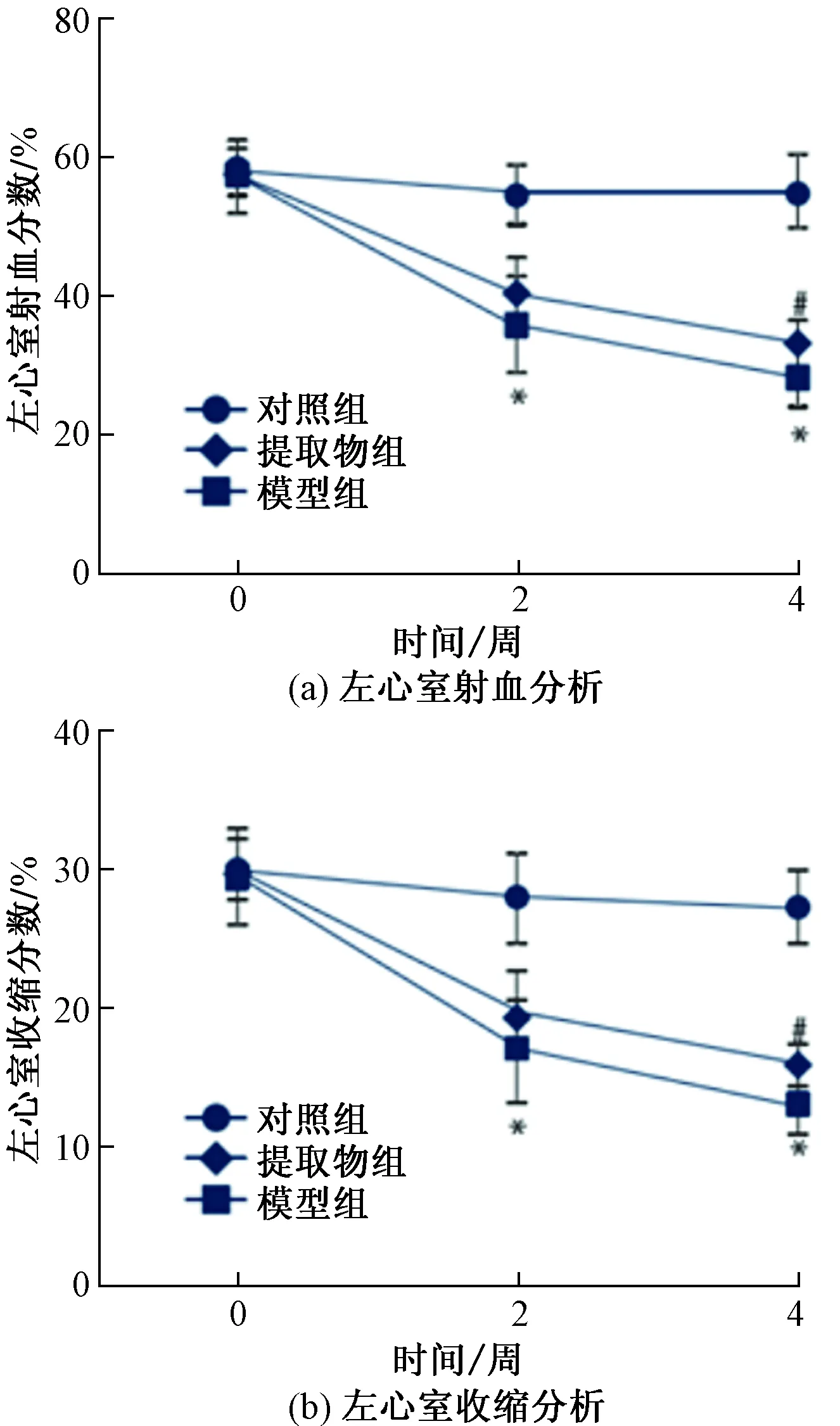
与Sham组相比,*表示P<0.05;与MI组相比,#表示P<0.05图1 各组MI大鼠心功能表现Fig.1 Cardiac function of MI rats in each group
3.2 黄芪丹参配伍提取物对MI大鼠心肌纤维化的影响
实验第4周结束时,采用Masson染色法检测MI大鼠的心肌纤维化水平。与假手术组相比,模型组和黄芪丹参配伍提取物组心肌蓝色胶原纤维显著增加(P<0.05);但与模型组相比,黄芪丹参配伍提取物组蓝色胶原纤维沉积明显较少(P<0.05)。表明黄芪丹参配伍提取物可有效降低MI大鼠的心肌纤维化,如见图2所示。
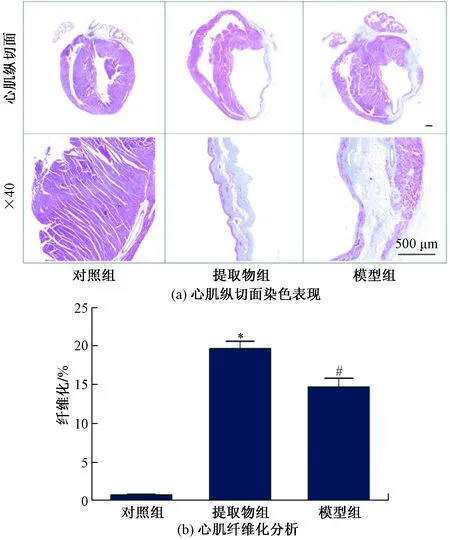
与Sham组相比,*表示P<0.05;与MI组相比,#表示P<0.05图2 各组MI大鼠心肌纤维化表现Fig.2 Myocardial fibrosis in MI rats of each group
3.3 黄芪丹参配伍提取物对MI大鼠心肌血管生成的影响
Isolectin B4用于标识血管内皮细胞,在药物干预4周后,选用Isolectin B4抗体染色测量MI大鼠心肌内毛细血管的密度,评价MI大鼠的血管生成作用。与模型组相比,心肌梗死的梗塞区和周围梗塞区中Isolectin B4阳性细胞明显增加(P<0.05)。表明通过黄芪丹参配伍提取物干预后,可促进MI大鼠心肌中的血管新生,如图3所示。
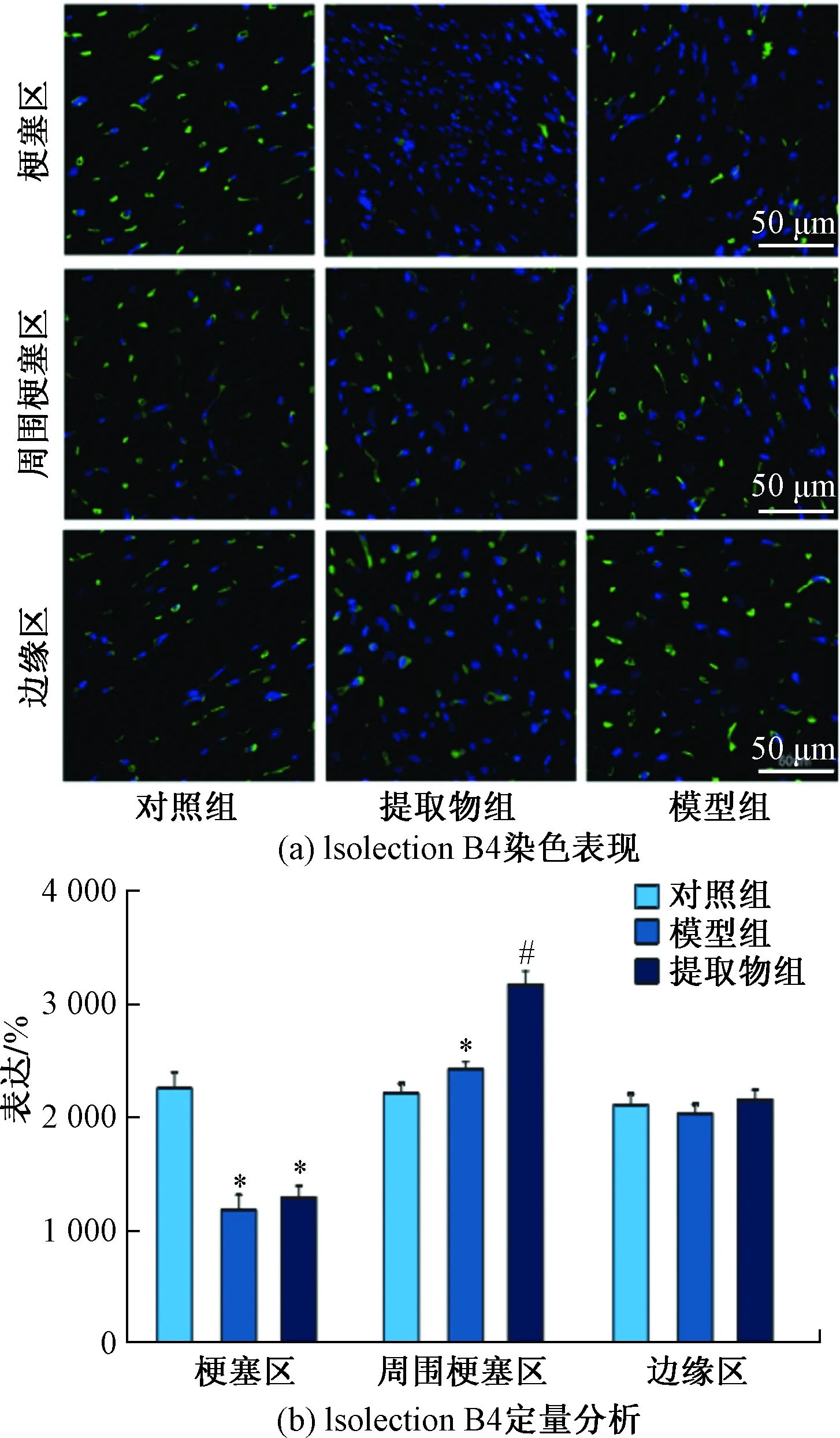
与Sham组相比,*表示P<0.05;与MI组相比,#表示P<0.05图3 各组MI大鼠毛细血管密度表现Fig.3 Capillary density of MI rats in each group
3.4 黄芪丹参配伍提取物对HIF-1a、VEGFA和p-AKT表达的影响
为进一步阐明黄芪丹参配伍提取物对MI的作用机制,观察了4周后MI大鼠心肌中HIF-1a、VEGFA和p-AKT表达的水平。采用免疫组化染色法检测HIF-1a、p-VEGFR2(主要由VEGFA激活)和p-AKT的分布,根据细胞形态学特征显示HIF-1a阳性细胞和p-AKT阳性细胞分布在心肌细胞中,p-VEGFR2阳性细胞分布在模型组和黄芪丹参配伍提取物组的血管内皮细胞。药物干预4周后,与模型组相比,黄芪丹参配伍提取物组中HIF-1a、VEGFA、p-AKT/AKT的蛋白和mRNA表达均显著上调(P<0.05)。表明黄芪丹参配伍提取物可上调MI大鼠心肌中HIF-1a、VEGFA和p-AKT的表达水平,如图4所示。
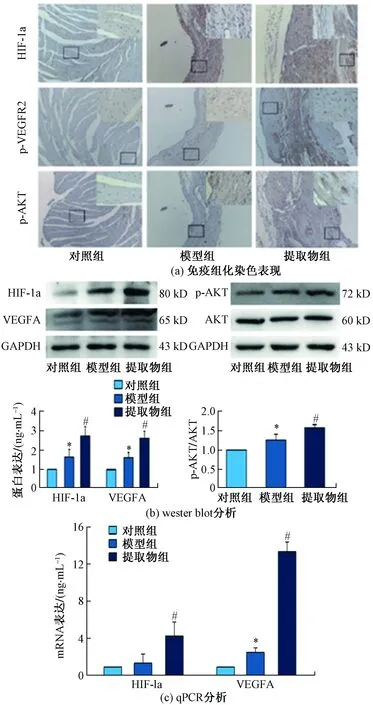
与Sham组相比,*表示P<0.05;与MI组相比,#表示P<0.05图4 各组MI大鼠HIF-1a、VEGFA和p-AKT表达Fig.4 Expression of HIF-1a, VEGFA and p-AKT in MI rats of each group
4 讨论及结论
研究发现黄芪丹参配伍提取物在MI大鼠缺血性心肌中具有促血管新生的积极作用。课题组前期研究工作已证实黄芪丹参提取物协同使用可有效增强心肌舒缩功能,减轻心室重塑[8]。在此次实验中,通过超声心动图检测以及Masson染色法显示再次证实,MI大鼠模型构建成功,黄芪丹参配伍提取物对保护MI大鼠受损心肌具有积极作用。经过黄芪丹参配伍提取物干预4周后,MI大鼠心肌组织中HIF-1a、VEGFA和p-AKT的表达明显上调。
AKT是磷脂酰肌醇3激酶(phosphatidylinositol 3-kinase,PI3K)信号通路的特征性靶点,磷酸化后的AKT具有抑制MI心肌细胞的凋亡、促进血管再生的作用[9]。心肌细胞凋亡发生在MI的早期阶段,实验中通过免疫组化染色发现,p-AKT主要分布于心肌细胞,黄芪丹参配伍提取物可上调p-AKT表达,说明该组配伍药可通过抑制细胞凋亡保护心脏功能,进一步预防心力衰竭。HIF-1a是调节细胞对缺氧环境作出反应的重要转录因子,提高HIF-1a表达可以减少MI的梗死面积,改善心脏功能[10]。研究表明,心肌细胞在缺血缺氧环境下,HIF-1a可直接诱导VEGF增加,促进心脏梗死的修复。具有酪氨酸活性的p-VEGFR2是介导VEGF的主要活性受体之一,具有促进血管内皮细胞再生、增加血管通透性等功能,广泛分布于血管内皮细胞、造血干细胞等处,代表着血管的新生程度[11-12]。研究发现通过黄芪丹参配伍提取物干预4周后,可明显上调HIF-1a及其下游VEGF因子的表达,表明该组配伍药通过HIF-1a/VEGFA信号通路促进MI的血管生成,从而改善心脏功能。
综上所述,本次实验肯定了中药黄芪丹参配伍提取物在缺血性心肌中的促血管新生作用,通过上调HIF-1a/VEGFA信号通路参与血管生成,为中医药防治此类疾病提供了有效的实验数据和研究思路。
