基于无人机高光谱和数码影像数据的冬小麦生物量反演
2020-12-14李天驰冯海宽朱贝贝范园园金丽妍成倩李倩雨
李天驰 冯海宽 朱贝贝 范园园 金丽妍 成倩 李倩雨


摘要 生物量是作物生长过程中重要的生物参数之一,能较好地反映作物长势情况。本研究获取了冬小麦开花期数码影像数据、高光谱数据和实测生物量数据,运用相关性分析筛选出对冬小麦生物量相关性高的数码影像指数和植被指数,分别使用多元线性回归分析和逐步回归分析法建立生物量反演估算模型,最后将最优模型估算结果进行可视化空间分析。结果表明,与冬小麦生物量相关性高的数码影像指数有VARI、MGRVI、b等,植被指数有NDVI、SR、LCI、OSAVI等。建立的冬小麦生物量反演模型估算效果较好,其中精度最高的模型为高光谱数据多元线性回归模型,其验证模型均方根误差为0.904 1 t/hm2。可视化处理结果能直观地显示试验区冬小麦生物量分布情况,为生长监测及种植管理提供有效依据。
关键词 无人机;冬小麦;生物量;植被指数
中图分类号 S129 文献标识码 A
文章编号 1007-5739(2020)20-0001-05 开放科学(资源服务)标识码(OSID)
Abstract Biomass is one of the important biological parameters in the process of crop growth, which can better reflect the growth of crops. Digital image data, hyperspectral data and measured biomass data of winter wheat at flowering stage were obtained in this study, and correlation analysis was used to select the biomass parameters that are important to the growth of the crop. Multiple linear regression analysis and stepwise regression analysis was used respectively to establish the estimation model of biomass inversion, and finally the results of the optimal model estimation were analyzed by visual spatial analysis. The results showed that the digital image indexes with high correlation with winter wheat biomass were VARI, MGRVI, b, etc., and the vegetation indexes were NDVI, SR, LCI, OSAVI, etc. The established winter wheat biomass inversion model has a good estimation effect, and the hyperspectral data multiple linear regression model has the highest accuracy, and the root mean square error of the verification model is 0.904 1 t/hm2. The visualized processing results can intuitively display the winter wheat biomass distribution in the test area, which provides an effective basis for growth monitoring and planting management.
Keywords UAV; winter wheat; biomass; vegetation index
作物在生長过程中易受到环境、水分、氮素等因素影响,进而对作物长势及最终产量造成影响,因而可以根据植株生物量和氮含量等农学参数对作物生长状况进行监测[1],为必要的田间管理、病虫害监测及农肥施用提供重要依据[2]。随着遥感技术的发展与应用,相关学者将其应用于农作物监测方面。贾玉秋等[3]利用高分1号卫星和Landsat-8卫星获取了许昌地区遥感影像,并选取数个监测指标,建立玉米叶面积指数反演模型。结果表明,高分1号卫星数据建立的反演模型精度要高于Landsat-8卫星数据建立的模型。赵晓庆等[4]利用无人机搭载的高光谱传感器获取了大豆不同生育期数据,首先建立了多个植被指数,并对植被指数进行方差分析,随后采用偏最小二乘法建立不同采样空间尺度的大豆产量估算模型。通过验证模型发现,当采样区域面积为9.03~10.3 m2时产量估算精度最高。孙小香等[5]获取了水稻冠层光谱反射率及叶片全氮浓度数据,通过分析植被指数与叶片全氮浓度的相关性筛选出敏感参数,并使用多元线性回归和BP神经网络方法构建叶片全氮浓度估算模型。结果表明,BP神经网络对水稻氮素含量具有较好的估算能力。
基于现有研究,本文利用无人机同步搭载高光谱成像仪和数码相机,获取了冬小麦高光谱数据和数码影像数据,并基于这些数据构建了数码影像指数和植被指数。通过分析数码影像指数和植被指数与冬小麦生物量的相关性,筛选出相关性高的指数,利用多元线性回归分析和逐步回归分析法构建生物量反演估算模型,探究最优冬小麦生物量估算模型,以期为监测冬小麦长势提供技术支持。
1 材料与方法
1.1 研究区概述
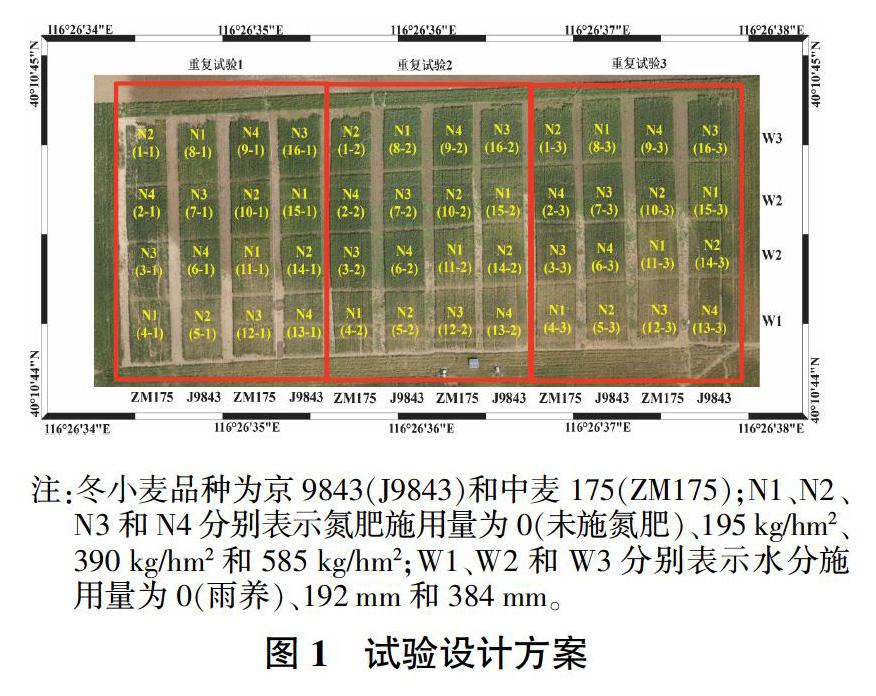
试验于2014—2015年在北京市昌平区小汤山国家精准农业研究示范基地进行,该基地地处北纬40°00′~40°21′,东经116°34′~117°00′,平均海拔36 m。试验设计方案如图1所示,将选取的试验区域划分为48个小区,16个小区一组,共3组。其中,32个小区用于建立生物量反演模型,16个小区用于模型验证。
1.2 试验数据获取
1.2.1 数码影像数据与高光谱数据获取及预处理。试验于冬小麦开花期(2015年5月13日)获取数据。无人机数码影像由八旋翼无人机航拍获取,相机为Canon PowerShot G16,使用CMOS传感器,当无人机飞行高度为50 m时,地面分辨率为0.016 dpi。为避免外界环境对数据获取造成影响,选择晴朗天气于12:00—13:00对试验区进行影像拍摄。获取数码影像数据后使用Agisoft PhotoScan Professional软件进行拼接等预处理,包括建立纹理、生成试验区正射影像图和数字地形图等。同时,无人机同步搭载Cubert UHD185 Firefly型高光谱成像仪,其光谱范围为450~950 nm,光谱分辨率为8nm@532nm,通道数为125,采样间隔为4 nm。
1.2.2 冬小麦生物量获取。在固定尺寸的试验小区内,选取20株冬小麦植株作为样本,经过器官分离、称定质量等操作后放入纸袋中,置于烘箱内以105 ℃杀青30 min,随后设置75 ℃烘干,直至质量恒定(48 h以上),最终计算单位面积的冬小麦生物量。
1.3 试验指数选取
对于无人机数码影像数据,利用影像红、绿、蓝通道的像元值进行算术运算,同时根据现有研究成果,选取10个数码影像指数对冬小麦生物量进行反演估算,具體见表1。
对于高光谱数据,通过对不同波长的反射率进行算术运算,并参考现有研究,选取16个植被指数对冬小麦生物量进行反演估算,具体见表2。
1.4 研究方法
1.4.1 多元线性回归。在回归分析中多元线性回归一般用于包含2个或2个以上的自变量的模型中。通常情况下因变量会受到多个因素的影响,而且各个因素的影响程度并不相同。此时使用单一因素对因变量进行反演预测,可能会产生预测不准确的现象,而使用多个自变量的最优组合对因变量进行预测会更有效且符合实际。
1.4.2 逐步回归分析。逐步回归分析作为一种选取回归模型自变量的方法,能较好地保留对因变量解释能力较强的变量,同时不存在严重的多重共线性。其主要思想是将自变量逐个引入所建立的模型,引入一个自变量后对模型进行F检验,同时对已经引入的自变量进行t检验。当前期引入的自变量变得不再显著时将其剔除,以确保回归模型中的自变量是显著的。
1.4.3 精度评定。本文选择决定系数(R2)和均方根误差(RMSE)2个精度指标对冬小麦生物量反演模型进行精度评价,公式如下:
式中,xi为实测冬小麦生物量,yi为预测冬小麦生物量,x、y分别为冬小麦实测和预测生物量的平均值,n为样本总数。决定系数R2表示了模型拟合效果,RMSE反映了预测值和实测值之间的偏离程度。一般R2越高,RMSE越低,模型拟合效果就越好。
2 结果与分析
2.1 数码影像指数与冬小麦生物量相关性分析
将选取的数码影像指数与冬小麦生物量进行相关性分析,结果见表3。可以看出,所选取的数码影像指数与冬小麦生物量均存在极显著相关(P<0.01),相关系数绝对值在0.545~0.725范围内。其中,与生物量相关性最高的数码影像指数是r,其相关系数绝对值为0.725;与生物量相关性较差的数码影像指数是b,其相关系数绝对值为0.545。
2.2 植被指数与冬小麦生物量相关性分析
将选取的植被指数与冬小麦生物量进行相关性分析,结果见表4。可以看出,所有植被指数与生物量均存在极显著相关(P<0.01),相关系数绝对值在0.722~0.815范围内。其中,VOGa与生物量相关性最高,其相关系数绝对值为0.815;与生物量相关性较差的是DCNI,其相关系数绝对值为0.722。
2.3 冬小麦生物量反演
2.3.1 冬小麦生物量反演模型建立。根据相关性分析结果,选取数码影像指数VARI、MGRVI和r+b等用于构建生物量反演模型,选取植被指数SR、NDRE、VOGa和SRPIa等用于建立冬小麦生物量反演估算模型,具体模型建立及精度评价见表5。分析可得,基于数码影像数据建立冬小麦生物量反演估算模型精度要低于由高光谱数据建立的反演估算模型。其中,建模精度最高的是基于高光谱数据建立的多元线性回归模型,其决定系数R2为0.757 9,RMSE为1.010 3 t/hm2;基于数码影像数据的逐步回归模型精度最低,其决定系数R2为0.533 5,RMSE为1.402 5 t/hm2。
2.3.2 冬小麥生物量反演模型验证及可视化分析。将已建立的反演模型应用于小区数据验证,其模型验证精度结果见表6和图2。由表6和图2综合分析,大部分模型验证数据的实测值与估算值分布在1∶1线附近,有少量生物量被低估。其中,高光谱数据建立的多元线性回归模型验证精度最高,其RMSE为0.904 1 t/hm2;数码影像数据建立的逐步回归模型验证精度最低,其RMSE为1.421 0 t/hm2。
选取模型验证精度最高的高光谱数据多元线性回归模型应用于无人机数码影像上,得到生物量估算值空间分布图(图3)。由图3可知,大部分试验小区的估算生物量高于5.6 t/hm2,而且由验证结果可知实测值与估算值较为均匀地分布在1∶1线附近。反演填图结果表明,利用高光谱数据构建的多元线性回归模型能较为准确直观地反映试验区内冬小麦生物量分布情况,为种植管理提供依据。
3 结论与讨论
本研究通过筛选出与冬小麦生物量相关性高的数码影像指数或植被指数,使用多元线性回归和逐步回归分析法建立生物量反演估算模型,研究主要结论如下:①根据相关性分析选取数码影像指数VARI、MGRVI、b和(r+b)用于构建生物量反演模型,选取植被指数NDVI、SR、LCI、OSAVI、SPVI、MTCI、GNDVI、NDRE、PSDNa、VOGa、SRPIa、SPRIc、PSDNc和MTVI2用于建立冬小麦生物量反演估算模型。②在建立的生物量反演模型中,基于高光谱数据建立的多元线性回归模型精度最高,其验证模型R2为0.785 2,RMSE为0.904 1 t/hm2。同时,将该模型应用于无人机数码影像上,能直观地显示各试验小区冬小麦生物量分布空间状况。
目前,利用高光谱数据进行作物生物量反演的研究较多。贺 佳等[24]获取了不同生育期冬小麦冠层反射率数据,通过相关性分析、回归分析等处理,建立了基于不同植被指数的冬小麦生物量分段遥感监测模型,结果表明,模型验证精度均高于0.9,反演估算效果较好。范云豹等[25]使用高光谱辐射仪获取了芦苇和香蒲2种植物的冠层高光谱数据,利用一元线性回归、逐步多元回归和偏最小二乘法等建立反演估算模型,经过交叉检验,结果表明,反演模型估测精度高于90%。本研究使用无人机数码影像数据和高光谱数据对冬小麦生物量进行反演估算,结果显示,基于高光谱数据建立的模型效果优于数码影像数据,这与高光谱数据中所包含的光谱信息较多有关,同时经过多个植被指数最优组合进行回归模型构建,能较好地对生物量进行估测。同时,本研究仅使用了一期冬小麦生物量数据,未来应对不同年限不同生育期的生物量数据进行深入研究。
4 参考文献
[1] 杨长刚,柴守玺,常磊,等.不同覆膜方式对旱作冬小麦耗水特性及籽粒产量的影响[J].中国农业科学,2015,48(4):661-671.
[2] 宋明丹,李正鹏,冯浩.不同水氮水平冬小麦干物质积累特征及产量效应[J].农业工程学报,2016,32(2):119-126.
[3] 贾玉秋,李冰,程永政,等.基于GF-1与Landsat-8多光谱遥感影像的玉米LAI反演比较[J].农业工程学报,2015,31(9):173-179.
[4] 赵晓庆,杨贵军,刘建刚,等.基于无人机载高光谱空间尺度优化的大豆育种产量估算[J].农业工程学报,2017,33(1):110-116.
[5] 孙小香,王芳东,赵小敏,等.基于冠层光谱和BP神经网络的水稻叶片氮素浓度估算模型[J].中国农业资源与区划,2019,40(3):35-44.
[6] 何彩莲,郑顺林,万年鑫,等.马铃薯光谱及数字图像特征参数对氮素水平的响应及其应用[J].光谱学与光谱分析,2016,36(9):2930-2936.
[7] MEYER G E,NETO J C.Verification of color vegetation indices for auto-mated crop imaging applications[J].Computers & Electronics in Agriculture,2008,6(5):23-45.
[8] GITELSON A A,KAUFMAN Y J,STARK R,et al.Novel algorithms for remoteestimation of vegetation fraction[J].Remote Sensing of Environment,2002,8(5):225-431.
[9] BENDIG J,YU K,AASEN H,et al.Combining UAV-based plant height from crop surface models,visible,and near infrared vegetation indices for biomass monitoring in barley[J].International Journal of Applied Earth Observations and Geoinformation,2015,39(6):324-429.
[10] ZHOU X,ZHENG H B,XU X Q,et al.Predicting grain yield in rice usin-g multi-temporal vegetation indices from UAV-based multispectral and digital imagery[J].ISPRS Journal of Photogrammetry and Remote Sensing,2017,54(7):130-142.
[11] WU C,NIU Z,TANG Q,et al.Estimating chlorophyll content from hyperspectral vegetation indices:Modeling and valida-tion[J].Agricultural and Forest meteorology,2008,148(8/9):1230-1241.
[12] BARET F,GUYOT G,MAJOR D J.TSAVI:A vegetation index which minimizes soil brightness effects on LAI and APAR estimation[C].in 12th Canadian Symposium on Rem-ote Sensing Geoscience and Remote Sensing Symposium.1989.
[13] DATT B.A new reflectance index for remote sensing of chlorophyll content in higher plants:tests using eucalypyus leaves[J].Plant Physiol,1999,24(5):124-223.
[14] APARICIO N,VILLEGAS D,ARAUS J L,et al.Relationship between growth traits and spectral vegetation indices in durum wheat[J].Crop Science Madison,2002,42(6):1547-1555.
[15] ROUJEAN J L,BREON F M.Estimating PAR absorbed by vegetation from bidirectional reflectance measurements[J].Remote Sensing of Environment,1995,5(3):375-384.
[16] M VINCINI,E FRAZZI,ALESSIO P D.Angular dependence of maize and sugar beet VIs from directional CHRIS/Proba data[J].Cuore.2005,113(8):566-648.
[17] CHEN P F,HABOUDANE D,TREMBLEY N,et al.New spectral indicator assessing the efficiency of crop nitrogen treatment in corn and wheat[J].Remote Sensing of Environ-ment,2010,114(9):1987-1997.
[18] DASH J,CURRAN P J.The MERIS terrestrial chlorophyll index[J].International Journal of Remote Sensing,2004,25(23):5403-5413.
[19] GITELSON A A,KAUFMAN Y J,MERZLYAK M N.Use of a green channel in remote sensing of global vegetation from EOS-MODIS[J].Remote Sensing of Environment,1996,58(3):289-298.
[20] FITZGERALD G J,RODRIGUEZ D,CHRISTENSEN L K,et al.Spectral and thermal sensing for nitrogen and water status in rainfed and irrigated wheat environments[J].Precision Agriculture,2006,35(4):346-368.
[21] BLACKBURN G A.Spectral indices for estimating photosy-nthetic pigment concentrations:a test using senescent tree leaves[J].International Journal of Remote Sensing,1998,58(4):125-213.
[22] CURRAN P J,DUNGAN J L,PETERSON D L.Estimating the foliar biochemical concentration of leaves with reflecta-nce spectrometry:testing the Kokaly and Clark methodolog-ies[J].Remote Sensing of Environment,2001,76(3):349-359.
[23] VOGELMANN J E,ROCK B N,MOSS D M,et al.Red-edge spectral measurements from Sugar Maple leaves[J].Inter-national Journal of Remote Sensing,1993,56(2):239-323.
[24] 賀佳,刘冰峰,郭燕,等.冬小麦生物量高光谱遥感监测模型研究[J].植物营养与肥料学报,2017,23(2):313-323.
[25] 范云豹,赵文吉,宫兆宁,等.基于高光谱信息的芦苇和香蒲地上干生物量反演方法研究[J].湿地科学,2016,14(5):654-664.
