顶空气相色谱法测定大豆异黄酮提取物中有机溶剂残留
2020-12-14白旭东周兆梅黄媛谷岩
白旭东 周兆梅 黄媛 谷岩


【摘要】 目的:建立顶空气相色谱法测定大豆异黄酮提取物中有机溶剂残留的检测方法。方法:采用顶空毛细管气相色谱法,DB-624毛细管气相色谱柱(30 m×0.32 mm,0.25 μm),氢火焰离子化检测器,载气为氮气,流速为2 mL/min;顶空进样,顶空平衡温度为80 ℃,平衡时间为30 min,进样体积为1 mL。结果:测定的11种有机溶剂完全分离,线性关系良好,平均回收率在92.5%~101.2%;RSD均小于5%。结论:该方法快速、准确、灵敏,适合测定大豆异黄酮提取物中的有机溶剂残留量。
【关键词】 大豆异黄酮提取物;顶空气相色谱法;有机溶剂残留
【DOI编码】 10.3969/j.issn.1674-4977.2020.05.020
Determination of Residual Organic Solvents in Soybean Isoflavone Extract by Headspace Gas Chromatography
BAI Xu-dong,ZHOU Zhao-mei,HUANG Yuan,GU Yan
(Liaoning Inspection,Examination & Certification Centre,Shenyang 110036,China)
Abstract: Objective Establish a headspace gas chromatography method for detecting the residual organic solvents in Soybean Isoflavone extract. Methods Headspace capillary gas chromatography,DB-624 capillary gas chromatography column (30 m×0.32 mm,0.25 μm),hydrogen flame ionization detector,carrier gas is nitrogen,flow rate is 2 mL/min;headspace sampling,headspace the equilibrium temperature is 80 ℃,the equilibrium time is 30 min,and the injection volume is 1 mL. Results The measured 11 kinds of organic solvents are completely separated,with a good linear relationship,the average recovery rate is 92.5%~101.2%;RSD is less than 5%. Conclusion The method is fast,accurate and sensitive,and is suitable for determining the residual amount of organic solvents in soybean isoflavone extract.
Key words: soybean isoflavone extract;headspace gas chromatography;residual organic solvent
大豆異黄酮是黄酮类化合物的一种,是大豆生产过程中的次生代谢产物,包括大豆甙、黄豆黄素、染料木甙、大豆黄素、黄豆黄素甙元、染料木素等12种成分[1]。研究表明, 大豆异黄酮具有对血管的防护作用、类似女性雌激素作用以及抗激素作用、抑菌活性和预防骨质疏松症等多种生理功能, 最近还有研究证实它可能作为一种天然抗氧化剂, 而许多天然的抗氧化剂都具有抗肿瘤功效[2]。大豆异黄酮提取物的制备方法有机溶剂萃取法、加热回流法、超声波提取法、微波提取法和超临界CO2萃取法等[3-6]。
随着人们对保健食品的关注和青睐,以大豆异黄酮提取物为主要成分的保健食品越来越多,为了有效控制产品的质量和保证用药安全,按照2020版《中国药典》四部的要求和任用药品注册技术要求国际协调会(ICH)中药品有机溶剂残留量测定的指导原则,对大豆异黄酮提取物中残留的有机溶剂进行检测。本文采用顶空毛细管气相色谱法测定甲醇、乙醇、乙酸乙酯、正丁醇、异丙醇、三氯甲烷、二氯甲烷、正己烷、丙酮、苯及2-丁酮11种有机溶剂残留。该方法操作简单,结果准确、可靠,为制定大豆异黄酮提取物的质量标准提供了实验依据。
1 材料与方法
1.1 仪器与试剂
GC-2010气相色谱仪(日本岛津公司,配有FID检测器和顶空进样器);SPB-3全自动空气源(北京中惠普分析技术研究所);SGH-300高纯氢气发生器(北京东方精华苑科技有限公司)。
甲醇、乙醇、乙酸乙酯、正丁醇、异丙醇、三氯甲烷、二氯甲烷、正己烷、丙酮、苯及2-丁酮均为色谱纯;DMSO为分析纯。
11批大豆异黄酮提取物分别为不同的厂家来源(浙江、陕西、广州、河南等地)。
1.2 试验方法
1.2.1 溶液配制
混合标准溶液的制备:取甲醇、乙醇、乙酸乙酯、正丁醇、异丙醇、三氯甲烷、二氯甲烷、正己烷、丙酮、苯及2-丁酮精密称定,用DMSO制备成质量浓度为0.3,0.25,0.05,0.5,0.25,0.125,0.1,0.01,0.05,0.035 mg和0.05 mg的混合对照品溶液。精密吸取混合对照品溶液5.0m L,置于20m L顶空瓶中, 加盖密封。
1.2.2 样品前处理
取本品1 g,精确称定,置10 mL量瓶中,加DMSO稀释至刻度,摇匀,精密吸取5 ml置于10 mL顶空瓶中,加盖密封。
1.2.3 仪器条件
色谱柱:安捷伦DB-624毛细管柱(30 m×0.32 mm,0.25μm);程序升温:起始温度为40 ℃,保持10 min,以8 ℃/min升温至130 ℃,保持10 min;载气为高纯氮气,流速为2 mL/min;检测器为FID,检测器温度为250 ℃。
顶空进样器条件:顶空瓶平衡温度为80 ℃,平衡时间为30 min。
2 结果与分析
2.1 色谱柱的选择与顶空条件的选择
试验中考察了DB-624、DB-5、DB-WAX三款毛细管色谱柱,并对程序升温条件进行优化,通过试验对比发现色谱柱DM-624分离效果最好,峰型对称良好,所有溶剂均能有效检出,最终选用色譜柱住DM-624。
考考察不同顶空平衡温度(60,70,80,90 ℃)及不同平衡时间(20,30,40 min)对各待测溶剂色谱峰面积的影响,试验发现随着温度的升高,各主成分峰的峰面积逐渐变大,但在80 ℃之后基本不变,考虑到温度越高,越易产生干扰峰,确定平衡温度为80 ℃。在80 ℃下,通过平衡不同时间发现,在30 min时,所要研究的溶剂已全部检出,且峰面积大,分离度较好,所以确定平衡时间为30 min。
理论板数以乙醇计应不低于10000,11中化合物全部分离,色谱图见图1。
2.2 溶剂的优化
样品经过优化的提取条件提取后,选用MCX固相萃取小柱对目标物进行净化,MCX柱填料克服传统硅胶基质混合型固相萃取吸附剂的局限性,利用顶空进样方式进行样品残留溶剂的检测常用的溶剂主要为水、N,N-二甲基甲酰胺、二甲亚砜及其他适宜溶剂。由于大豆异黄酮提取物在水中不易溶解,易溶于DMSO,故以DMSO作为溶剂,结果显示待测各成分的峰形好,分离度符合要求,对测定结果不产生干扰。
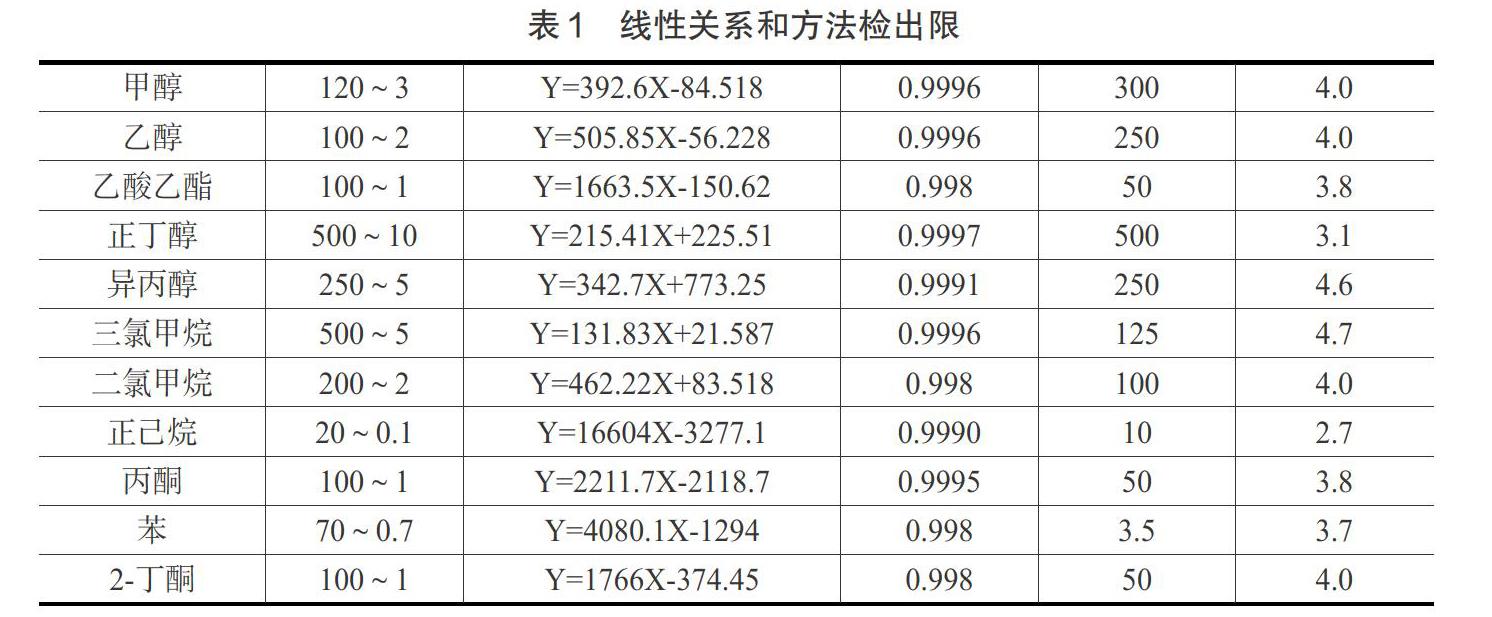
2.3 方法的线性范围及检出限
空白基质的制备:按照“1.2.2”项下制备空白基质。
精密量取混合标准贮备液,用空白基质稀释成系列标溶液,以浓度为横坐标,以峰面积为纵坐标,绘制标准曲线得线性方程及相关系数,方法检出限及重复性见表1。
2.4 回收率实验
精密称取已测定各有机溶剂残留量的大豆异黄酮提取物样品9份,各约1 g,分别置于10 mL量瓶中,精密加入已知量混合对照品溶液,每个质量浓度3份,加DMSO稀释至刻度,摇匀,各精密量取5.0 mL,置于20 mL顶空瓶中,加盖密封,按“1.2.3”项下方法进行测定,结果见表2。
2.5 实际样品测定
取11批大豆异黄酮提取物样品各1 g,精确称定,置10 mL量瓶中,加DMSO稀释至刻度,摇匀,精密吸取5.0 mL置20 mL顶空瓶中,加盖密封,按“1.2.3”项下方法进行测定。11批购自不同生产厂家的样品检出的溶剂残留有甲醇、乙醇、正丁醇、乙酸乙酯、丙酮。其中有1批样品的甲醇超标,3批乙醇超限,其他各有机溶剂残留量均在限度范围内,2020年版《中国药典》四部规定的溶剂残留限量见表3。
3 讨论
1批样品检出甲醇,甲醇为二类溶剂,主要原因可能为乙醇中的甲醇残留或为降低成本直接使用含大量甲醇的工业酒精提取甚至直接使用甲醇提取。乙醇由于是工艺中正常引入,为三类溶剂,毒性较小,环境污染小。由于目前市场上大豆异黄酮没有统一的质量标准,所以本实验分别同11个不同的生产厂家采购样品,以考察市场上大豆异黄酮提取物有机溶剂残留的情况,从实验结果看出大豆异黄酮甲醇和乙醇限量存在一定超标的风险,因此,制定大豆异黄酮提取物有机溶剂残留的限量十分必要。
【参考文献】
[1] 郭嘉.大豆异黄酮的营养探究[J].现代食品,2016(18):32-33.
[2] AHUJA V,MIURA K,VISHNU A,et al. Significant inverse association of equol-producer status with coronary artery calcification but not dietary isoflavones in healthy Japanese men[J].British Journal of Nutrition,2017,117:260-266.
[3] 范兆军.大豆异黄酮的提取技术[J].科技信息,2011(16):588-589.
[4] 王丹.脱脂豆粕中大豆异黄酮提取工艺的研究[J].食品研究与开发,2017(6):52-55.
[5] 卢丞文,王玲.大豆异黄酮提取方法的研究进展[J].吉林农业月刊,2017(8):111-111.
[6] 彭游,余盛禄.大豆异黄酮提取研究最新进展[J].大豆科学,2012(2):320-323.
【作者简介】
白旭东(1973-),男,副主任中药师,学士,研究方向为食品,药品和医疗器械的检验与审评。
周兆梅(1965-),女,教授级高级工程师,学士,研究方向为保健食品检验。
黄媛(1983-),女,硕士,研究方向为食品检验与食品安全。
通讯作者:谷岩(1975-),女,硕士,研究方向为食品检验与食品安全,E-mail:591131710@qq.com。
