水文连通性对西洞庭湖大型底栖动物群落结构的影响
2020-12-14王玉玉雷光春薛彬林陈乾阔
董 芮,王玉玉,吕 偲,雷光春,薛彬林,陈乾阔
北京林业大学生态与自然保护学院, 北京 100083
洪泛平原是地球上最独特的景观特征之一,其特点是生物多样性和生产力高[1]。然而,它们也是世界上受威胁最严重的生态系统之一[2],其栖息地的生态可持续性直接与河道和洪泛区之间持续的横向水文连通程度有关。大型底栖动物是食物网中重要的一环,为较高营养级的鱼类和鸟类提供食物资源[3]。同时大型底栖动物具有生命周期长、对外界干扰反应敏感的特点,是水环境监测的重要指示生物,因此,对大型底栖动物群落结构的更好理解对于制定洪泛平原的有效保护和管理策略具有重要意义[4- 5]。

图1 西洞庭湖采样点分布图Fig.1 Spatial distribution of the sample sites in West Dongting Lake T1:沅水,Yuan river;T2:澧水,Li river;CL:连通湖泊,Connected lakes;IL:阻隔湖泊,Isolated lakes;MM:改造洲滩,Modified mudflat
水文连通性以直接或间接的方式影响了大型底栖动物群落结构,与河道之间的自由水交换为底栖动物的生存创造了有利条件。以往研究中,大型底栖动物的丰富度和丰度随着水文连通性的增加而增加[6],而香农多样性则表现出单峰的响应。也有研究表明,由于水文连通性,大型底栖动物的丰富度增加,在中连接度的地点会达到顶峰[7]。但大多数研究只关注α多样性,关于β多样性的研究较少。β多样性指不同群落间物种组成的差异[8- 10],可以分为物种周转(或替代)和嵌套(或丰富度差异)两个部分,不同的组成部分揭示了构建群落的不同机制。
三峡大坝运行后,长江中下游水文节律发生了变化,西洞庭湖位于洞庭湖上游,是洞庭湖3个湖区中淤积最严重的湖区,受上游洞庭湖水系降雨及所连通的长江干流水情的影响,洲滩面积出露时间增加,是受江湖关系变化影响最为直接的区域之一[11]。本研究于2019年4月对西洞庭湖大型底栖动物进行了调查,通过分析水文连通性对大型底栖动物群落结构的影响,为西洞庭湖的生态环境管理和生物多样性保护提供科学数据支撑。
1 材料与方法
1.1 研究区域与采样点设置
西洞庭湖位于湖南省汉寿县境内,承接松滋、虎渡、藕池三口和沅江、澧水等五支入流,是洞庭湖水文过程最复杂的区域[12]。该区属中亚热带季风气候,区内湿地类型丰富,为众多野生动植物提供了理想的栖息地,特别是对越冬候鸟保护具有重要意义,属于国家级自然保护区,并于2002年被列为国际重要湿地[13]。
本研究于2019年4月在西洞庭湖选取54个采样点(采样点设置如图1)。其中,连通湖泊无堤坝阻隔,阻隔湖泊有自然或人工堤坝阻隔,改造洲滩指湖区内曾以杨树种植为主的洲滩,采取挖沟抬垄等措施降低淹水带来的不利影响,使西洞庭湖自然洲滩大面积减少[14]。依照洞庭湖多年淹水频率遥感图像[15]将各个样点的淹没频率(Freq,Frequency)提出,并将阻隔生境的外围最低点的淹没频率记为该阻隔生境的连通频率(HC,Hydrological connectivity)。样点特点代号和分组情况见(表1)。

表1 西洞庭湖生境类型与采样点设置
1.2 生物数据采集与鉴定
1.2.1底栖动物样品采集与鉴定
使用1/16 m2的彼得森采泥器采集底泥, 每个样点3次重复。将采集到的泥样用60目网筛筛洗, 并转入白磁盘中。将所有大型底栖动物逐一挑出,并用10 %甲醛溶液固定保存。依据相关的文献资料[16- 19], 在显微镜或解剖镜下进行分类和计数, 样品尽量鉴定到属或种,并用电子天平称重,称重前用滤纸吸去表面固定液[20]。
1.2.2环境因子测定
采用手持声纳测深仪SM- 5A测定水深(WD,Water depth),赛氏盘测定透明度(Tran,transparency),计算SI(Shade index,透明度与水深比),透明度与水深比。FP311直读式流速仪测定流速(V,Velocity);采用YSI ProPlus手持式多参数水质分析仪现场测定电导率(Cond,Conditivity),酸碱度(pH),氧化还原电位(ORP, Oxidation-reduction potential)。根据标准测定方法, 在实验室内测定水样的总氮(TN,Total nitrogen)、总磷(TP,Total phosphorus)、悬浮物固体(SS,Suspended solids)、叶绿素a(Chl-a,Chlorophyll-a)。目测2 m×2 m样方内沉水植物盖度(SPC,Submerged plants coverage)和挺水植物盖度(EPC,Emergent plants coverage),将底质类型(Sub,Substrate)分为泥(Mud),泥沙(Muddy Sand)和沙(Sand)[5]。
1.3 数据处理
检查各样区之间密度及湿重的变化,若符合方差齐性,用单因素方差检验,通过LSD进行配对比较。若不符合方差齐性,通过Kruskal-Wallis检验,然后通过Bonferroni校正的Mann-Whitney配对比较来评估差异[5]。
对物种变量进行对数转换至近似正态性,以降低密度或生物量占优势的个别物种对群落结构的影响权重。环境变量进行Z-标准化转换。确定了群落结构的简单描述,包括物种丰富度(Species Richness),优势种, Shannon-wiener指数、Simpson指数、Pielou指数和Margalef指数。基于Sørensen距离计算各生境的β多样性及其周转部分与嵌套部分[9]。为了可视化不同生境之间的 β 多样性关系,利用配对计算的相异性矩阵进行非度量多维尺度分析(NMDS)[20];使用广义线性模型(Generalized Linear Models,GLM)拟合环境变量对多样性指数的影响。GLM 模型利用最小赤池系数(Akaike information criterion,AICc)选择最佳模型,利用最大的修正后解释量确定解释量最高的环境变量组合,使用高斯分布拟合多样性指数[21]。以上分析均在R 3.6.1完成.
2 结果与分析
2.1 西洞庭湖生态环境特征的空间差异
共有10个理化变量在各个栖息地类型存在显著差异(P<0.05,表2),改造洲滩与阻隔湖泊的电导率、总氮、总磷的含量显著其他区域,但沅水,澧水,连通湖泊的流速、挺水植物盖度、淹水频率、连通度显著高于阻隔湖泊与改造洲滩。
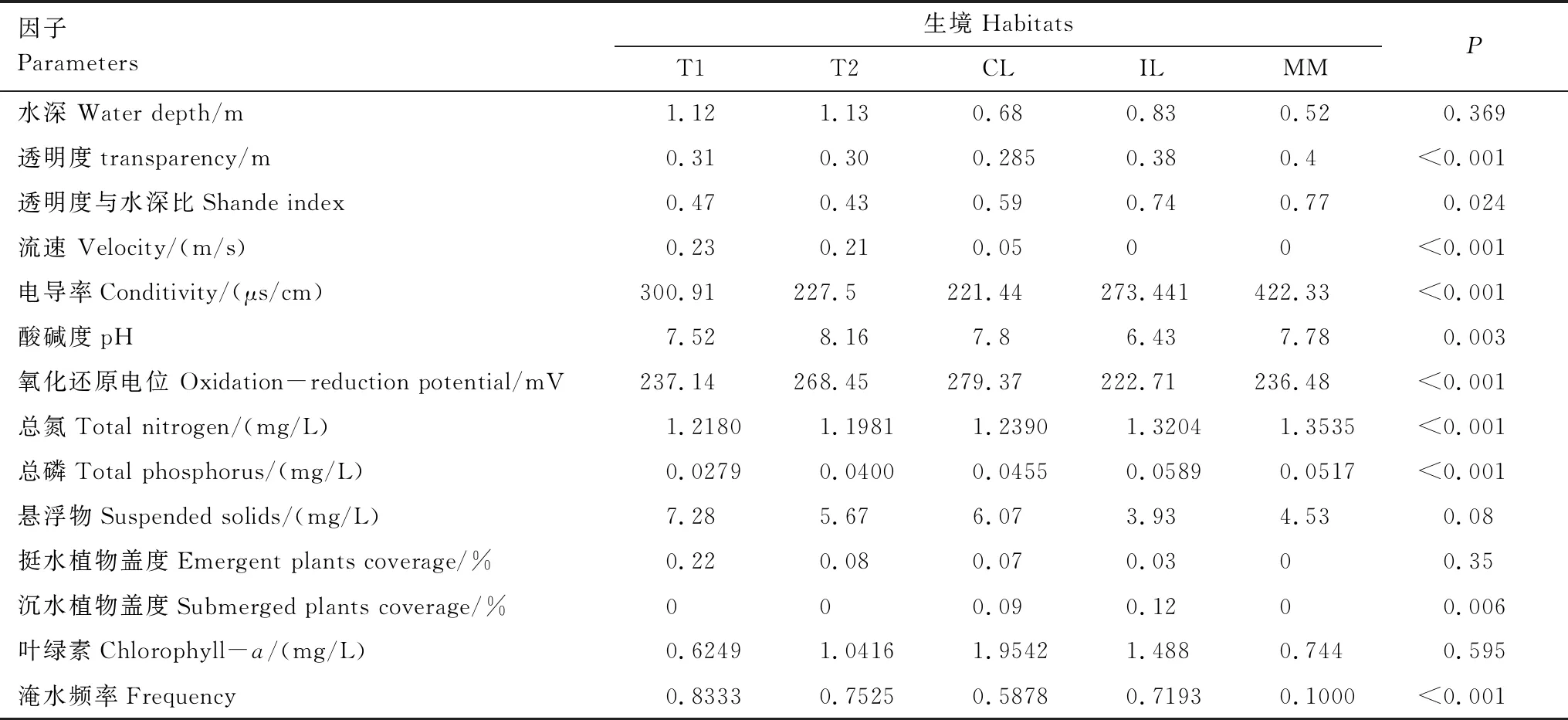
表2 西洞庭湖环境理化参数
2.2 西洞庭湖大型底栖动物群落组成及优势种
共鉴定出底栖动物 49个分类单位,隶属于6纲14目26科,以软体动物和水生昆虫为主。其中水生昆虫22种,占43.6 %;软体动物18种,占36.4%;环节动物7种,占14.5%,其他动物3种,占5.4 %。水丝蚓属在各个生境都为优势种,沅水优势类群为摇蚊类,合流与阻隔湖泊为摇蚊类与腹足纲,连通湖泊主要为腹足纲,改造洲滩为鞘翅目与腹足纲。(表3)。各生境类型的物种丰富度:连通湖泊>阻隔湖泊>澧水>改造洲滩>沅水(图2)。

表3 西洞庭湖各生境大型底栖动物种类组成与各生境优势种

图2 西洞庭湖大型底栖动物物种丰富度Fig.2 Species richness of macrozoobenthic in West Dongting Lake (different letters indicate significant difference)
2.3 西洞庭湖大型底栖动物密度与生物量
调查发现西洞庭湖大型无脊椎动物的平均密度和生物量(湿重)分别为136.20个/m2和167.13 g/m2。腹足纲的平均密度最高,双壳纲平均密度最小。寡毛纲密度在阻隔湖泊处最高,腹足纲在连通湖泊和阻隔湖泊处密度较高,双壳纲在改造洲滩处未发现,昆虫纲密度在阻隔湖泊处最高。非参数 Kruskal-Wallis检验结果表明,腹足纲与昆虫纲的密度在不同栖息地具有极显著差异(P<0.001)(表4)。腹足纲,昆虫纲及其他类群的湿重在不同栖息地具有显著差异(P<0.05)(表5)。
2.4 西洞庭湖大型底栖动物群落的β多样性及相似性
NMDS 排序分析图显示连通湖泊与阻隔湖泊有重叠现象,其他分组基本无重叠现象。其中,改造洲滩的样点空间分布最为集中(图3)。这表明连通湖泊与阻隔湖泊底栖动物群落相似性较高,其他栖息地群落相似性不明显,改造洲滩的大型底栖动物群落结构单一,与其他栖息地类型相差较大。Anosim检验结果表明,西洞庭湖5个区域之间的群落相似性具有显著差异(P<0.01)。改造洲滩的β多样性为0.48,物种周转分别占总空间转换的50%。沅水,澧水,连通湖泊,阻隔湖泊的β多样性分别为0.79,0.77,0.75,0.74。物种周转分别占总空间转换的86%,94%,89%和95%(表6)。
2.5 西洞庭湖大型底栖动物群落的群落多样性及其与环境因子的相关性分析
如图4所示,大型底栖动物群落的Shannon-wiener指数,Margalef指数在不同栖息地类型之间具有显著差异。通过LSD比较,澧水,连通湖泊与沅水,改造洲滩的Shannon-wiener指数具有显著差异(P<0.01),连通湖泊与沅水,阻隔湖泊,改造洲滩的Margalef指数具有显著的差异(P<0.01)。改造洲滩shannon-wiener指数与Margalef指数均最低,而连通湖泊的均最高。澧水的shannon-wiener指数与margalef指数均比沅水高。

表4 各分组大型无脊椎动物的密度及非参数检验结果(个/m2,平均值±标准误差)
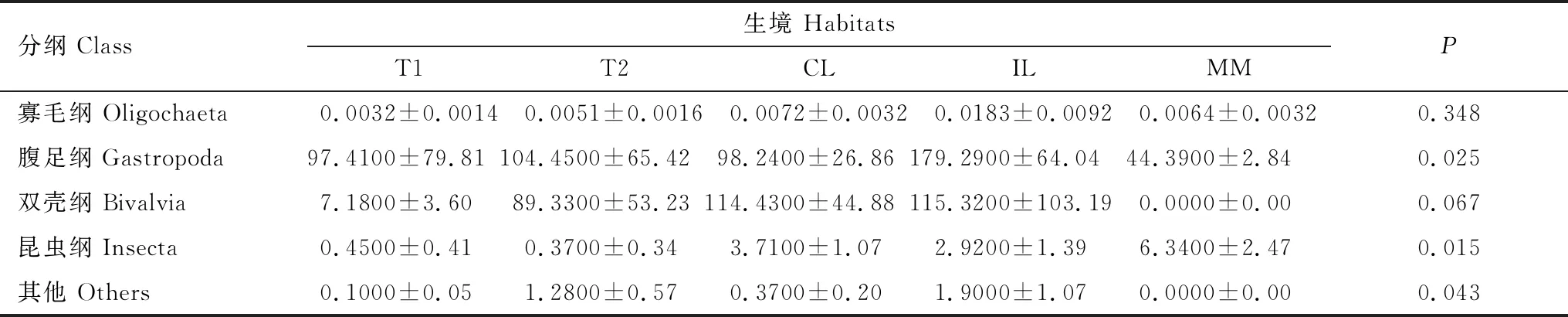
表5 各分组大型无脊椎动物的湿重及非参数检验结果(g/m2,平均值±标准误差)

表6 西洞庭湖大型底栖动物群落β多样性
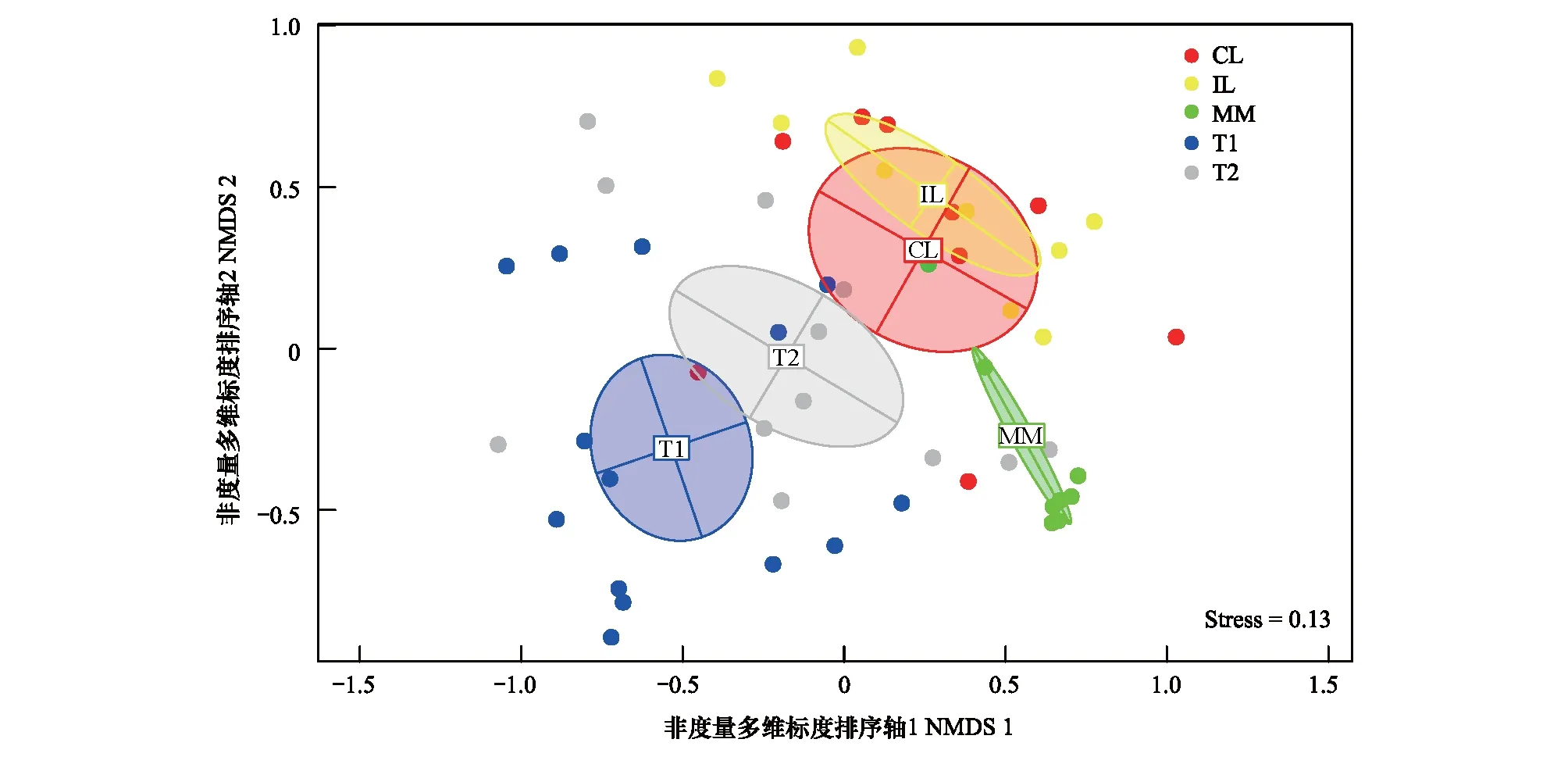
图3 基于大型底栖动物密度的Bray-Curtis 相似性系数的非度量多维标度排序图Fig.3 Ordination plot of macrozoobenthic communities based on Bray-Curtis similarity coefficients NMDS: Non-metric multidimensional scaling analysis
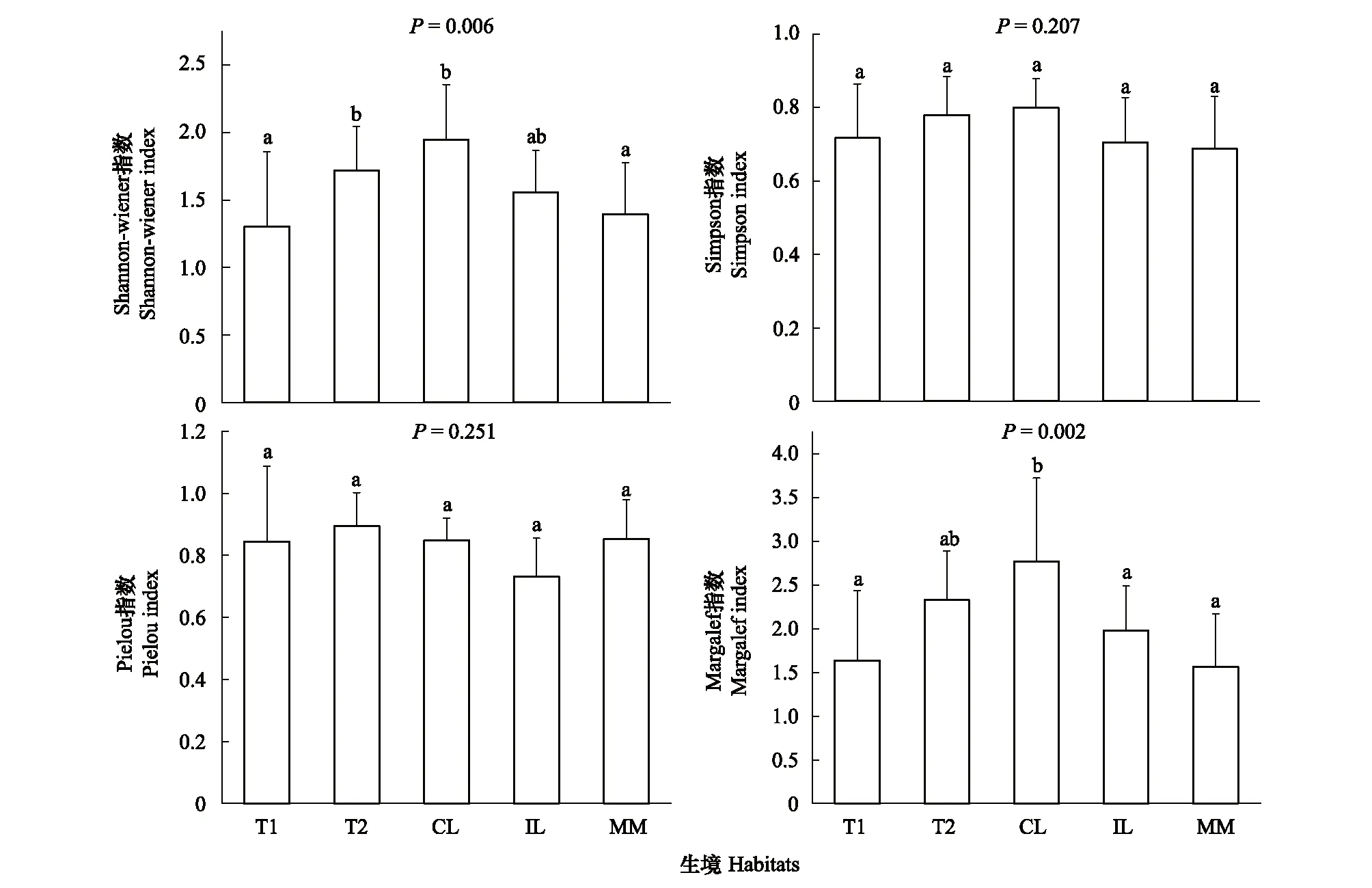
图4 大型底栖动物多样性指数图Fig.4 α diversity indices of macrozoobenthic communities (different letters indicate significant difference)
如表7所示,Shannon-wiener 指数最优模型均选择连通度、底质类型与透明度与水深比、电导率与叶绿素a作为最佳解释变量组合,解释变量分别为为31%。其中连通度,底质类型与透明度与水深比为最重要的环境变量。Simpson指数模型选择连通度、流速与水深,解释变量为22%。Pielou指数模型选择挺水植物盖度、连通度与底质类型,解释变量为7%。Margalef指数模型选择连通度、总磷、氧化还原电位与水深,解释变量为27%。在所有的模型中,HC均被选择。
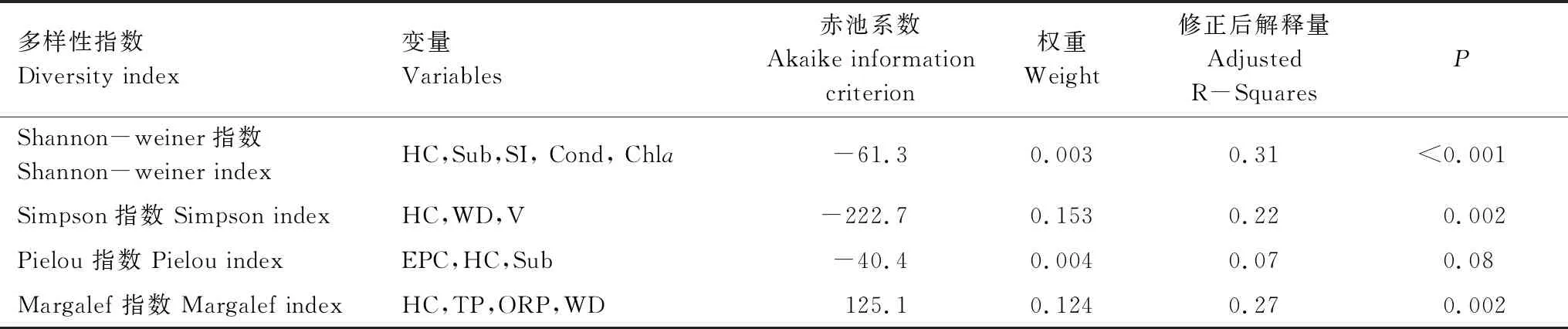
表7 西洞庭湖大型底栖动物多样性的最优广义线性模型
3 讨论
3.1 水文连通性对环境特征、群落组成及α多样性的影响
阻隔生境所处环境梯度的特点是高营养水平,高电导率与高透明度。连通生境所处的环境梯度是高淹水频率,高连通度,高悬浮物固体浓度等,河流底质类型丰富,这与Krystian Obolewski(2011)的研究结果一致:高有机质泥是停滞、孤立水体的典型特征,而激流水体的底质则为表面粗糙,渗透性高的矿物基质[22]。河流物种丰富度与密度较小,湖泊的物种丰富度与密度较大,改造洲滩物种丰富度与密度也较小,显然支持了中度干扰假说[23]。连通湖泊与阻隔湖泊腹足纲密度较多,与沉水植物为其提供食物与生活环境密切相关[24]。与其他生境相比,改造洲滩优势种较为独特,为水丝蚓属,环棱螺属与尖口圆扁螺、耳萝卜螺、泉膀胱螺和小划蝽。水丝蚓属与环棱螺属属于广布种,但扁卷螺科, 椎实螺科, 膀胱螺科是临时池塘的的优势类群[25]。鞘翅目,蜻蜓目与异翅目的物种丰富度通常在低连通度和高有机质含量的环境最高[7]。
5个区域的Shannon-wiener指数与Margalef指数均具有显著差异,且这两个指数的GLM最优模型均选择了连通度作为最佳解释变量组合成员。横向连通性是洪泛区水体中生物群结构和功能的主要驱动力[26]。洪泛区与河流脱离连接,将会导致生物多样性丧失。连通度最低的人工改造洲滩的生物多样性指数在洪泛区最低[27]。洪水之后,与河流脱离连接的水体开始富营养化,然后逐渐陆地化[28]。由于对环境质量变化耐受的物种逐渐占主导地位,生物多样性减少[29]。阻隔湖泊与有更高连通度的连通湖泊相比,多样性也降低。
本研究中,影响Shannon-wiener多样性的最重要环境因子还包括底质类型,透明度与水深比。底质类型对大型底栖动物的生物量和多样性影响很大,泥沙底质是滤食者和食底泥者的适宜栖息地。沙质基质多由于流速较高,冲刷而成,不适宜大多数物种生存,多样性与生物量最低[5]。透明度与水深比沿着连通梯度降低,在流水环境中,水深较大,由于水体扰动,透明度较低。较深的水和低的透明度是限制水生高等植物生存的主要环境因子[30]。沉水植物提供了多样化的栖息、繁殖以及避难的场所,从而扩大了底栖动物的生存空间,提高了多样性[24]。
3.2 水文连通性对大型底栖动物群落β多样性的影响
空间尺度上物种生态位分化和扩散过程,即生态位过程和中性过程在群落构建中具有重要的作用[31]。在一定程度内,区域面积越大,相应的环境异质性可能增加,导致β多样性增大。河流与湖泊的群落组成转换(β多样性)通常高,这是因为其水域的环境变异性较高[32]。河流与连通湖泊、阻隔湖泊、改造洲滩的群落不相似,主要由于水动力条件不同。水文因子(流速)是决定大型底栖动物定性和定量结构的重要因素[33],湖泊区水动力条件稳定,连通湖泊流速较低,阻隔湖泊无流速,底质均为泥,河道水体扰动较大,底质多为泥沙。而连通湖泊与阻隔湖泊的物种组成相似,但低水文连通度降低改造洲滩群落与其他生境的相似性。
丰富度差异和物种替代的相对重要性不是随机的,而是与各种物种性状相关的(例如,扩散能力或调节体温的能力)[10]。扩散能力高的物种可以分布在所有合适的栖息地,其β多样性可能会通过丰富度差异和物种替代而产生。相比之下,扩散能力差的物种定居受限,通常会由于一些物种离开避难所导致物种损失而导致嵌套模式[34]。
Sarremejane 等人(2017)对低地河流的研究结果表明,群落结构的模式可能源于栖息地连通性和扩散潜力之间的相互作用[35]。栖息地隔离和扩散限制特别影响扩散能力较弱的物种[36], 而具有较强扩散能力的物种通常与环境变异性弱相关。改造洲滩与其他生境相比,β多样性最小,未发现双壳纲与其他类群(栉水虱目,钩虾属等)的存在(表2)。其群落的组成差异50%由于物种替换所导致(物种周转),50%是物种丰富度差异(嵌套组分),其他区域的的群落组成差异主要由于物种替换所致。千岛湖中小岛繁殖鸟类和蜥蜴β多样性研究结果表明,扩散能力弱的蜥蜴因局部灭绝使得嵌套导致的β多样性值更高[37]。和腹足纲相比,双壳纲分布范围更窄。另外,双壳纲一般营半底埋生活,运动扩散能力比腹足纲弱。改造洲滩的群落均质化很可能是由于扩散限制和选择性灭绝共同导致的,低水文连通性限制了一些扩散能力弱的物种迁入,并且改造洲滩一年中大多数时间的水分来自于降水与地下水补给,干旱事件时有发生,部分耐受性强的螺类可以钻入土内寻求水分。这导致耐受性弱的物种消失,间接影响β多样性。
4 结论
研究表明,连通生境与阻隔生境在环境因子上有显著差异。大型底栖动物的物种丰富度、密度、湿重、α和β多样性都受到低连通度的负面影响:物种丰富度下降,密度减少,湿重降低,生物多样性降低,均质性增加,连通性降低改变了湖泊中物种周转的程度,除了改造洲滩以外,其他区域的空间周转都决定了生境水平的总β多样性。这表明在扩散限制下的中性动态可能是塑造这些生境中底栖动物群落的主要过程。在改造洲滩中,由于生态位分选而导致的物种流失的非随机过程很重要。建议维持洪泛区与河流的一定程度的连接,从而恢复洪泛区的生态完整性。
