滇中亚高山地带性植被凋落物分解对模拟氮沉降的响应
2020-12-14张雨鉴王克勤宋娅丽郑兴蕊苏孟白李晓龙
张雨鉴,王克勤,宋娅丽,郑兴蕊,潘 禹,苏孟白,李晓龙
西南林业大学生态与环境学院, 昆明 650224
凋落物作为连接森林植被和土壤的重要组成部分,其分解过程是森林生态系统物质循环和能量流动的重要途径[1- 2],同时作为碳周转和养分循环的重要载体,该过程对于生态系统中碳和氮的有效性具有重要意义[2]。森林凋落物的分解包括凋落物的破碎、水溶性化合物的淋溶及有机物和矿质化合物的转化等过程[3],其中纤维素和木质素作为凋落物中较难分解的组分,对凋落物分解过程中的动态特征具有重要作用[1,4]。
氮(N)沉降的持续增加作为全球气候变化的一部分,已对陆地生态系统结构的平衡稳定和生物地球化学循环等造成重大影响[5- 6],同时引发森林多样性降低、森林土壤酸化、土壤养分失衡等一系列生态问题,最终致使森林衰退[7- 8]。因此,国内外学者开始重视并相继开展了一系列模拟N沉降对森林凋落物分解特征影响的研究[3,9],但由于研究地点、研究物种及实验周期等不同,导致N沉降对凋落物分解的研究出现了促进、抑制或无影响3种结果[10- 12]。凋落物的分解是一个较为复杂的生态过程,生物因素和环境因素共同决定了其分解的快慢,而N沉降对其影响的内在机理还有待进一步揭示[13]。目前,国外有关N沉降在凋落物方面的研究多倾向于外源N与外源CO2[14]、硫(S)[15]及降水[3]等对凋落物分解的交互作用及以植被细根分解为研究对象[16- 18]方面,此外探究N沉降下影响凋落物分解的主要因素也是目前一个重要关注点,如Cornwell等[19]采用元分析对全球范围的凋落物分解研究数据整合分析表明凋落物自身特性是凋落物分解的决定性因素;Chen等[20]对亚热带两种森林凋落物研究也表明虽然外源N的添加可以影响凋落物的分解特征,但最终取决于凋落物的基质质量;而Zhu等[21]研究两种热带植被凋落物分解特征则发现N沉降主要通过增加凋落物中难分解成分(木质素等)的比例抑制凋落物的分解,进一步说明凋落物基质质量在其分解过程中的重要性。但多数研究均以探讨凋落叶分解的影响因素作为重点,而对凋落物中其他组分(如凋落枝)分解的影响及其与凋落叶间是否存在差异则关注较少,此外,有关N沉降的研究区域多集中于欧洲和北美等温带区域[22],研究对象又多以单一林分为主[15],而国内相关研究则多集中于低中海拔区域[3,6,23],针对亚热带滇中高海拔区域不同森林生态系统及不同器官凋落物分解特征对N沉降响应的研究则鲜有报道。
滇中亚高山区域位于我国云贵高原、青藏高原和横断山地三大自然地理区域相结合的部位,植被以半湿性常绿阔叶林为主[24]。本文以该区域常绿阔叶林(Evergreen broad-leaf forest)和高山栎林(Quercussemecarpifoliaforest)两种森林类型为研究对象,采用凋落物分解袋法,通过模拟N沉降和原位分解试验,研究N沉降如何对两种森林类型凋落物分解过程及纤维素和木质素降解特征产生影响,旨在为研究该区森林生态系统在N沉降持续增加和全球变化的背景下养分循环提供理论依据。
1 研究材料与方法
1.1 研究区概况
研究区位于云南省玉溪市新平县磨盘山森林生态系统国家定位观测研究站(23°46′18″—23°54′34″N,101°16′06″—101°16′12″E),海拔1260.0—2614.4 m。该区位于云南亚热带北部气候与亚热带南部气候的过渡地区,具有典型山地气候特征。该区年均气温15℃,极端最高温为33.0℃,极端最低温为-2.2℃,年均降水量为1050 mm,降水主要集中在5—10月。土壤以第三纪古红土发育的山地红壤和玄武岩红壤为主,高海拔地区有黄棕壤。该区以中山半湿性常绿阔叶林为主,森林覆盖率达86%,分布有高等植物梭罗树(Reevesiapubescens)、楠木(Phoebechinensis)、普洱茶(Camelliaassamica)、树蕨(Arthropterispalisotii)等98科137属324种。植被类型随海拔的升高呈明显的垂直分布特征,主要分布的森林类型为亚热带常绿阔叶林、亚热带中山针阔混交林、针叶林和高山矮林等,其中常绿阔叶林树种组成主要为米槠(Castanopsiscarlesii)、光叶柯(Lithocarpusmairei)、糙皮桦(Betulautilis)、马缨杜鹃(Rhododendrondelavayi)、牛筋条(Dichotomanthestristaniicarpa)等,其中约60%为米槠。

图1 酸性洗涤法流程Fig.1 The process of acid detergent fiber method
1.2 研究方法
1.2.1试验设计
2017年11月分别收获常绿阔叶林和高山栎林林下新鲜凋落叶、凋落枝(根据自然条件下的凋落物枝的情况,收集样品包括不同大小和不同径级,但其中3—5 mm的枝占较大比例),同一林分的凋落物充分混匀,风干,分别准确称重叶和枝10 g后装入大小为20 cm×20 cm的分解袋(分解袋上下表面网孔孔径为1 mm×1 mm)。
2018年1月在磨盘山森林生态系统国家定位观测研究站区域内分别选取具有代表性的常绿阔叶林和高山栎林林分,各设置3个20 m×20 m的样地,样地间设距离大于3 m的缓冲带。在每个样地中随机设置4个3 m×3 m的小样方(即每种森林类型分别设置12个小样方,用于4种N沉降水平处理,各处理共3个重复样方),样方之间距离大于10 m。将前期准备好的凋落物袋均匀的摆放在各样方中,各样方凋落叶36袋,凋落枝36袋(各林分共计凋落叶432袋,凋落枝432袋),并对各样方中的凋落物喷施NH4NO3溶液(模拟N沉降)。参照氮饱和项目、北美哈佛林和我国华西雨屏区等对模拟N沉降处理的试验设置[25-28],结合我国西南地区,如四川盆地西缘[29]、昆明东郊[30]及西双版纳[31]等地的年N沉降量水平及该地区未来可能的N沉降趋势,本试验设定N沉降处理分4个水平:对照CK(Control check, 0 g N m-2a-1)、低氮LN(Low nitrogen, 5 g N m-2a-1)、中氮MN(Medium nitrogen, 15 g N m-2a-1)和高氮HN(High nitrogen, 30 g N m-2a-1),每个水平3个重复,对应3个重复样方。将1年的施用量均分成12份,从2018年1月至2018年12月,每月初按照上述4个水平对各样方进行定量模拟N沉降处理,对照组施相同量的水。除施氮水平不同外,其他措施保持一致。
1.2.2样品的采集与测定
自2018年2月至2019年1月,于每月中旬对各林分4种处理样方中的凋落叶和凋落枝进行取样,每月各样方取凋落叶3袋、凋落枝3袋,每种N处理3次重复取样(对应3个重复样方),取样周期为1个月1次,试验共计12次取样。取回分解袋后,清除侵入的根系、泥沙,烘干至恒重称量,用于计算质量残留率。
将风干的凋落物样品经65℃烘干至恒重、粉碎并过100目筛后供元素测定。凋落物中的碳含量采用重铬酸钾-外加热硫酸氧化法(LY/T 1237—1999)测定;氮含量采用半微量凯氏定氮法(LY/T 1269—1999)测定;木质素、纤维素采用酸性洗涤纤维法测定[32]:植物样品经过酸性洗涤剂消解后,剩余的酸性洗涤纤维包括纤维素、木质素和硅酸盐;再经过72%硫酸水解后纤维素被分解(得到纤维素含量),剩下木质素和硅酸盐;最后经过灰化分解木质素,剩下硅酸盐(得到木质素含量)。实验步骤如图1。
1.2.3数据处理
凋落物质量残留率测定计算公式采用[33]:
式中,R为凋落物质量残留率(%);K为M0转化为干重的转换系数;Mt为凋落物t时间烘干样品重量;M0为凋落物起始风干样品重量。
对凋落物的质量损失进行Olson负指数衰减模型拟合[34]:
y=ae-kt
式中,y为质量残留率(%);a为拟合参数;k为年分解系数(kg kg-1a-1);t为时间。
凋落物分解50%(T50%)和95%(T95%)所需时间的计算方法为[34]:
T50%=-ln(1-0.50)/k
T95%=-ln(1-0.95)/k
凋落物中的纤维素、木质素用酸性洗涤纤维法测定。各阶段凋落物纤维素残留率(lignin remain, LR)计算方法为[33]:
%LR=(Ct×Mt)/(C0×M0)×K×100
式中,Ct为t时间纤维素含量(mg/g);Mt为t时间烘干样品重量;C0为初始纤维素含量(mg/g);M0为凋落物起始风干样品重量。木质素计算方法同纤维素。
利用Excel 2010和SPSS 22.0对数据进行整理和统计分析。采用单因素方差分析法(One-way ANOVA)和最小显著差异法(LSD)进行方差分析和多重比较(α=0.05),采用典型相关分析法进行相关性分析。利用Excel 2010绘图,图中数据为平均值±标准误差。本研究中两种林型凋落叶和凋落枝初始化学性质如表1。
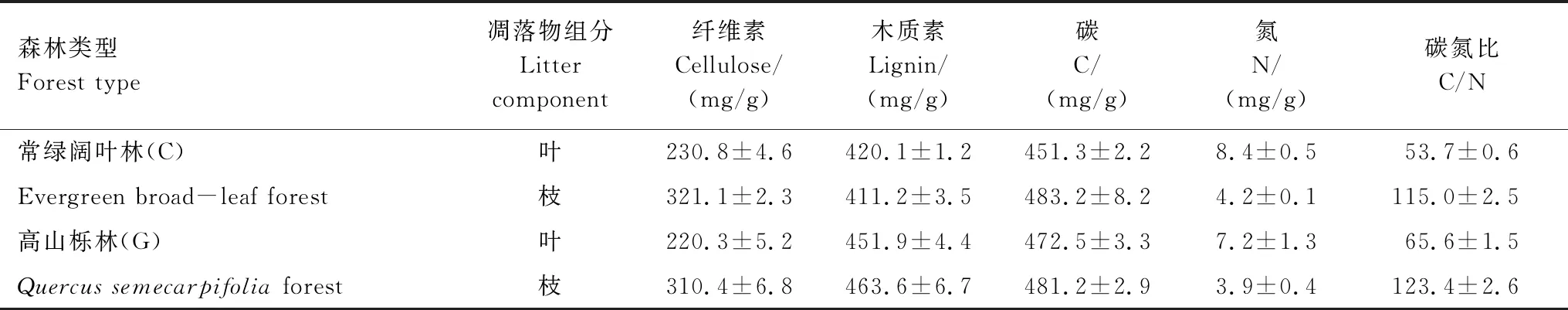
表1 两种林型凋落叶、枝初始化学性质(平均值±标准误差, n=3)
2 结果与分析
2.1 N沉降下两种林型凋落叶质量损失特征
常绿阔叶林和高山栎林凋落叶质量均随分解时间的增加呈减小趋势(图2)。分解1年后质量残留率分别为(55.16±0.77)%和(64.03±1.72)%。通过Olson指数衰减模型模拟结果可知,常绿阔叶林凋落叶分解50%和95%所需时间分别为1.291、5.579年,高山栎林分别为1.733、7.489年(表2)。
图2显示,常绿阔叶林凋落叶在分解4—12月时,多个N沉降处理下的质量残留率显著高于对照(CK)(P<0.05)。在分解1年后LN、MN和HN各处理凋落叶质量残留率相对于CK分别提高了0.75%、3.15%和6.03%。高山栎林凋落叶质量残留率在各分解阶段均表现为LN、MN和HN各处理高于CK,其中多以HN显著较高(图2)(P<0.05)。在分解1年后,高山栎林凋落叶质量残留率在LN、MN和HN各处理下较CK分别提高了3.58%、1.57%和6.34%。
各N沉降处理及对照凋落叶质量残留率均与分解时间呈极显著负指数关系(表2)(P<0.01)。根据Olson指数模型计算结果得常绿阔叶林凋落叶分解95%所需时间在5.579年(CK)的基础上增加了0.754年(LN)—0.933年(HN);而高山栎林凋落叶分解95%所需时间则在7.489年(CK)的基础上增加了0.353年(MN)—0.997年(HN)。
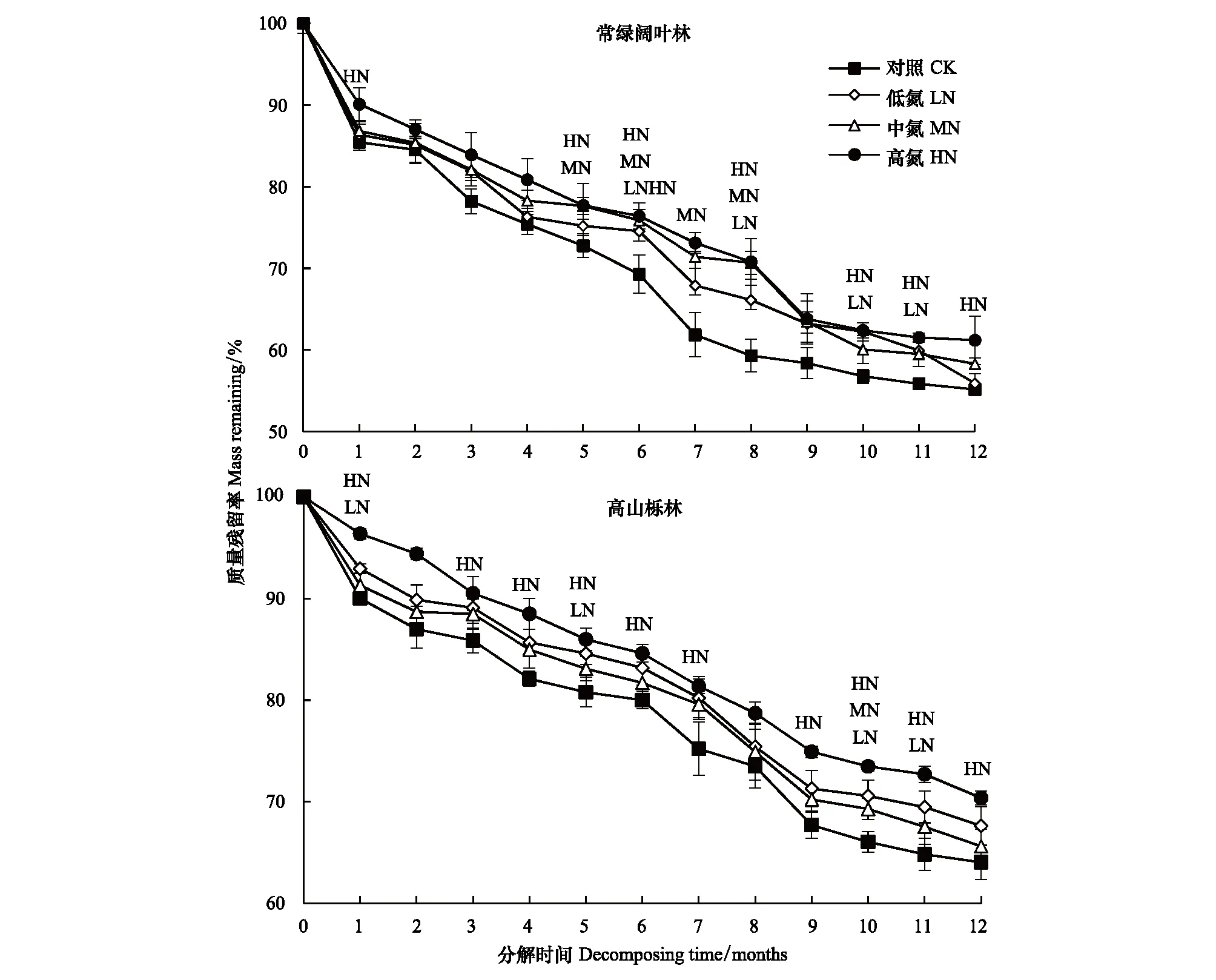
图2 凋落叶分解过程中质量残留率变化(平均值±标准误差, n=9)Fig.2 Variation of mass remaining during decomposition of leaf litter (mean±SE, n=9) C:常绿阔叶林Evergreen broad-leaf forest;G:高山栎林Quercus semecarpifolia forest. CK:对照Control check;LN:低氮Low nitrogen;MN:中氮Medium nitrogen;HN:高氮High nitrogen. 各取样时间点上的LN、MN和HN表示该处理与对照(CK)差异显著(P<0.05)
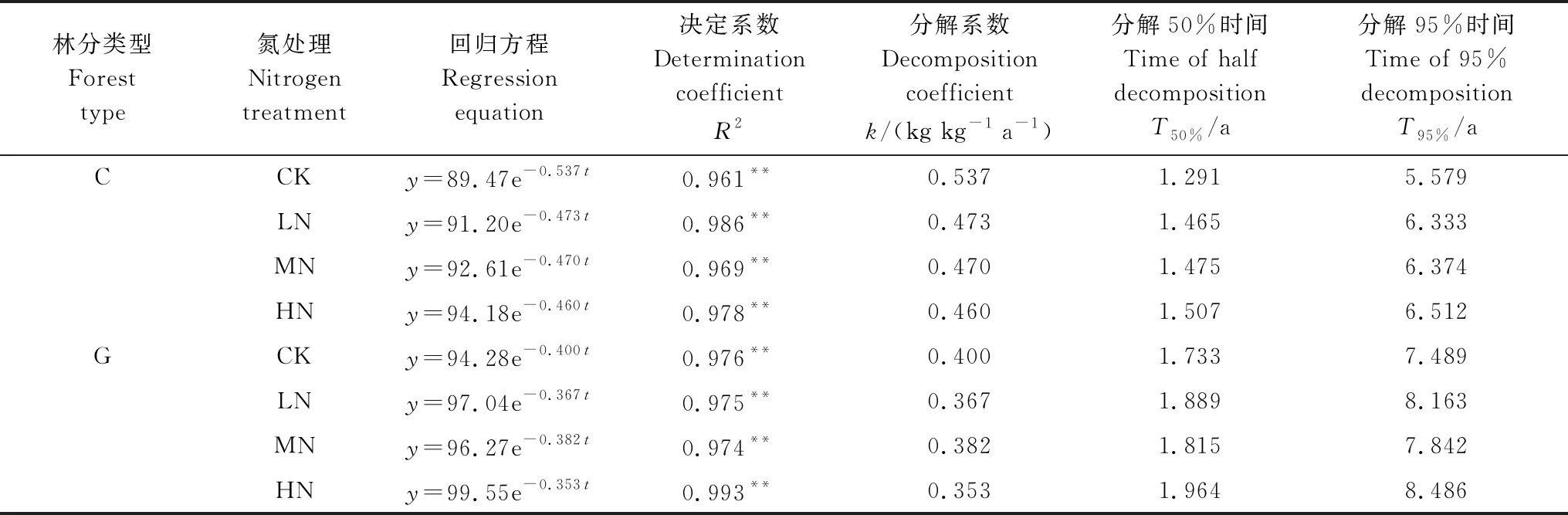
表2 凋落叶分解质量残留率随时间的指数回归方程
2.2 N沉降下两种林型凋落枝质量损失特征
常绿阔叶林和高山栎林凋落枝质量同样随分解时间的增加逐渐减小(图3),但与凋落叶相比,分解速率较缓慢(图2)。分解1年后常绿阔叶林凋落枝残留率为(78.06±1.36)%,高山栎林为(82.49±0.66)%。Olson指数衰减模型模拟结果显示常绿阔叶林凋落枝分解50%和95%所需时间分别约为3.851和16.643年,高山栎林分别约为5.134、22.191年(表3)。
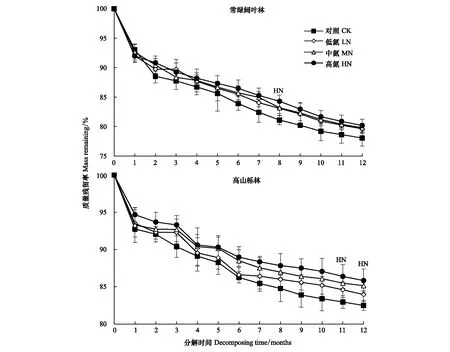
图3 凋落枝分解过程中质量残留率变化(平均值±标准误差,n=9)Fig.3 Variation of mass remaining during decomposition of twig litter (mean±SE, n=9) 各取样时间点上的LN、MN和HN表示该处理与对照(CK)差异显著(P<0.05)
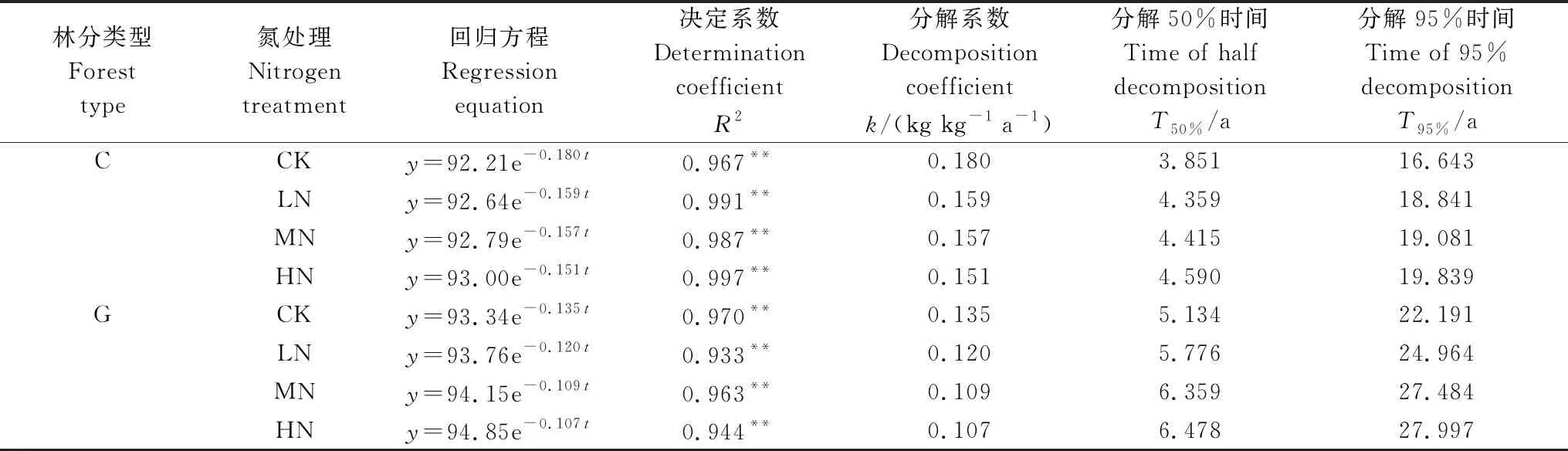
表3 凋落枝分解质量残留率随时间的指数回归方程
图3显示,常绿阔叶林和高山栎林凋落枝在各分解阶段均表现为各N沉降处理下的质量残留率高于对照(CK)。分解1年后,常绿阔叶林中LN、MN和HN各处理凋落枝质量残留率相对于CK分别提高了1.57%(LN)—2.13%(HN);高山栎则分别提高了1.47%(LN)—3.36%(HN)。
各N沉降处理及对照凋落枝质量残留率与分解时间均呈极显著负指数关系(表3)(P<0.01)。Olson指数模型计算结果表明模拟N沉降使常绿阔叶林凋落枝分解95%所需时间在CK(16.643年)的基础上增加了2.198(LN)、2.438(MN)、3.196(HN)年;高山栎林则在CK(22.191年)的基础上增加了2.773(LN)、5.293(MN)、5.806(HN)年。
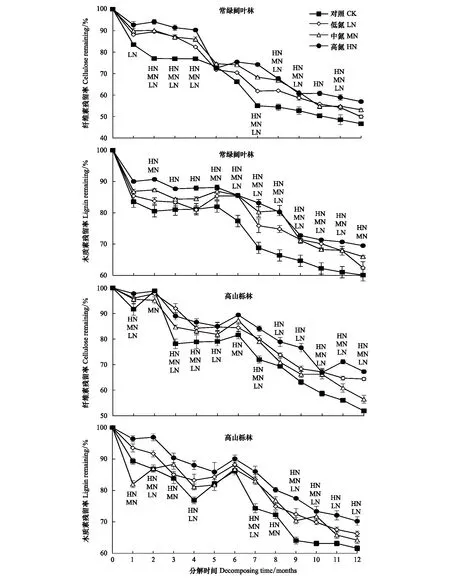
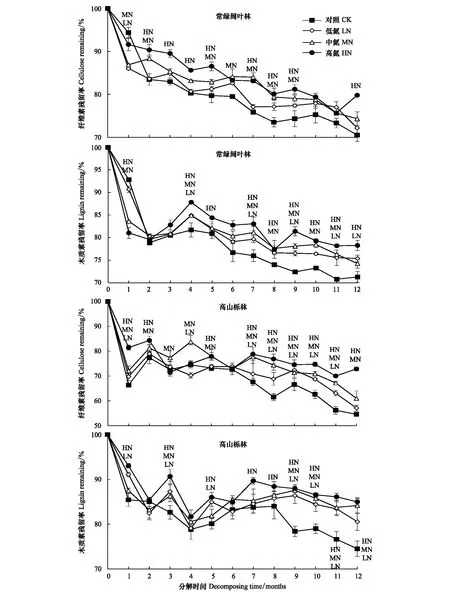
2.3 N沉降下两种林型凋落叶、枝纤维素和木质素分解特征
常绿阔叶林和高山栎林凋落叶在分解过程中,其纤维素和木质素残留率总体趋势均表现为随分解时间增加而减少(图4)。其中常绿阔叶林在分解6—12月中,凋落叶纤维素和木质素残留率在多个N沉降处理下显著高于对照(CK)(P<0.05)。分解1年后,常绿阔叶林凋落叶在CK、LN、MN和HN处理下纤维素和木质素残留率均表现为CK 常绿阔叶林凋落枝在分解过程中,其纤维素和木质素残留率总体趋势表现为随分解时间的增加而减少(图5)。其纤维素和木质素分别在5—12月和4—12月中,残留率在多个N沉降处理下显著高于对照(CK)(P<0.05)。在分解1年后常绿阔叶林凋落枝在CK、LN、MN和HN处理下纤维素残留率分别为CK 通过对凋落叶(枝)质量残留率与纤维素和木质素残留率进行典型相关分析,结果显示(表4),在常绿阔叶林中,凋落叶质量残留率与纤维素和木质素残留率、凋落枝质量残留率与纤维素残留率间呈极显著正相关关系(P<0.01);除凋落叶木质素残留率与凋落枝纤维素残留率无明显相关关系外(P>0.05),其余各部分间均存在显著正相关关系(P<0.05)。 表5显示,在高山栎林中,凋落叶质量残留率、纤维素残留率和木质素残留率三者间及凋落叶质量残留率与凋落枝质量残留率间均呈极显著正相关关系(P<0.01);凋落枝质量残留率与凋落叶纤维素和木质素残留率呈显著正相关关系(P<0.05);凋落叶和凋落枝纤维素残留率间呈显著正相关关系(P<0.05);凋落枝质量残留率、纤维素和木质素残留率三者间呈显著正相关关系(P<0.05)。 表4 常绿阔叶林凋落叶(枝)质量残留率与纤维素和木质素残留率的关系 图4 凋落叶分解过程中纤维素和木质素残留率变化(平均值±标准误差,n=3)Fig.4 Variations of mass remaining of cellulose and lignin of leaf litter during decomposition (mean±SE, n=3) 各取样时间点上的LN、MN和HN表示该处理与对照(CK)差异显著(P<0.05) 图5 凋落枝分解过程中纤维素和木质素残留率变化(平均值±标准误差,n=3)Fig.5 Variations of mass remaining of cellulose and lignin of twig litter during decomposition (mean±SE, n=3) 各取样时间点上的LN、MN和HN表示该处理与对照(CK)差异显著(P<0.05) 表5 高山栎林凋落叶(枝)质量残留率与纤维素和木质素残留率的关系 凋落物分解速率受凋落物基质质量、分解阶段、气候条件、养分循环和分解者群落结构和组成的影响[35],其中凋落物基质质量起主导作用[19]。在全球和区域尺度上,气候条件对生态系统分布格局及凋落物的产量和质量有显著影响,并对凋落物的分解动态有间接调控的作用[36]。本研究中,处于亚热带的常绿阔叶林和高山栎林凋落叶年分解率分别为44.84%和35.97%,高于温带森林的20%—30%[37],低于热带的47%—94%[37],而与亚热带常绿阔叶林的33.6%—45.3%[23,33]相近,基本呈现出分解速率与气候因素相关的规律。在特定气候区域内,凋落物基质质量是影响凋落物分解的主导因素[38],其中,凋落物C/N和木质素尤为重要[39]。本研究中,高山栎林凋落叶、枝分解率均小于常绿阔叶林,其中以凋落叶较为显著,这可能是因为本研究中常绿阔叶林凋落叶的初始C/N(53.7)明显低于高山栎凋落叶的C/N(65.6)。相关研究表明,凋落物N含量越高,C/N则越低,耐分解化合物(木质素等)则越少,从而凋落物分解则越快[36,40]。本研究两种林型凋落物在分解1年后凋落叶质量残留率(55.16%—64.03%)均明显低于凋落枝(78.04%—82.49%)。向元彬等先后对华西雨屏区巨桉(Eucalyptusgrandis)人工林[41]和常绿阔叶林[3]的研究均得出类似结果;李雪峰等[42]通过对长白山次生针阔混交林研究发现,凋落物分解速率与凋落物初始N含量和C/N呈显著相关关系。本研究中,常绿阔叶林和高山栎林凋落叶初始N含量分别是凋落枝的2.0倍和1.8倍,C/N则表现为凋落叶明显低于凋落枝,高N、低C/N可能是该区域两种林型凋落叶分解速率较快的原因[8],此外,本研究中两种林型凋落枝纤维素和木质素较凋落叶高也可能是导致分解率差异较大的重要原因[43]。 大气N沉降使土壤N含量增加,促进植物吸收,进而引起凋落物N含量及其他元素含量的变化,最终影响凋落物分解[23]。本研究中常绿阔叶林和高山栎林凋落叶、枝在经过1年分解后,对照(CK)分解率均呈现出高于其余三种N沉降处理(LN、MN和HN),其中尤以HN显著较低,表明N沉降抑制了凋落物的分解。这与莫江明等[44]研究鼎湖山主要森林植被(季风常绿阔叶林)凋落物分解和韩雪等[45]模拟N沉降对温带森林(辽东栎林)凋落物分解影响所得结果一致。本研究中,N沉降处理使得常绿阔叶林和高山栎林凋落叶和凋落枝质量损失50%和95%的时间均在对照(CK)的基础上有不同程度的增加。N沉降抑制凋落物分解可能与凋落物纤维素和木质素降解受抑制有关。N沉降的增加可能改变土壤环境,使得微生物群落结构由真菌为主体逐渐转变为细菌为主体[46],而真菌(菌根真菌为主)被认为在凋落物分解过程中与产生木质素降解酶有关[47],从而使得降解木质素的微生物数量减少,进而抑制木质素降解,王万才等[48]研究也得出N沉降可能通过影响生态系统的营养平衡,阻碍调控凋落物分解的胞外酶活性及增加纤维素和木质素含量来抑制凋落物分解;另一方面,外源N的增加会使得N素与凋落物中木质素及其在降解过程中产生的中间产物相结合,从而使得N素富集并积累,导致木质素降解受阻,从而降低了凋落物的分解率[49-50]。Knorr等[51]整合研究了全球尺度下模拟N沉降对凋落叶分解影响,结果表明N沉降整体上会促进N含量高、木质素/N低的凋落物分解,而抑制N含量低或木质素含量高的凋落物分解。本研究中两种林型凋落叶、枝木质素和纤维素含量较高,二者占凋落物质量的50%以上,因此,上述研究所得出的规律与本研究中两种森林凋落物分解对N沉降的响应规律一致。 凋落物中的纤维素结构简单,降解较快,而木质素作为凋落物中最难分解的复合物,结构复杂且稳定,降解相对较慢[52]。本研究显示,常绿阔叶林和高山栎林凋落叶、枝在分解后期,N沉降处理的纤维素和木质素质量残留率大多显著高于对照(CK),表明该区域凋落物纤维素和木质素的降解受到N沉降的抑制作用。以往的许多研究结果也表明,N沉降处理在凋落物分解后期常会抑制木质素的降解[23,44,51]。目前,一般认为造成该结果的原因分为以下几方面:一是外源N以铵盐、硝酸盐的形式与木质素及酚类等降解中间产物相结合形成高度聚合的芳香族化合物质,使得N素富集并积累,从而抑制木质素降解[48];二是外源N通过减少氧化酶的基因表达量进而抑制木质素降解酶的活性,抑制木质素降解[33,53];三是N沉降可能改变土壤环境,使得微生物群落结构发生改变,从而使得降解木质素的微生物数量减少,进而抑制木质素降解,而与生物群落则无明显关系[54]。此外,凋落物中由于木质素聚合体对纤维素的保护作用,导致木质素降解在受到抑制的同时,纤维素的降解也受到了阻碍,从而在对N沉降的响应时表现出与木质素大体一致的变化规律[23]。本研究针对纤维素和木质素残留率所做的典型相关性分析结果也表明二者间存在极为密切的联系。 凋落物分解对N沉降的响应除了本研究所得结果外,也有相关研究表明N沉降中外源N的增加解除了微生物受N的限制作用,增加了微生物对C的需求,促进了木质素和纤维素的降解,从而使得凋落物分解加快[55]。李仁洪等[8]模拟N沉降对华西雨屏区慈竹(Bambusaemeiensis)凋落物分解的影响研究发现,总体上N沉降对慈竹叶、箨和枝的分解均具有促进作用。但也有相关研究表明,N沉降只对凋落物分解前期起促进作用,而在分解后期依然受到抑制,如Sarah等[56]对北美针栎(Quercusellipsoidalis)和北美乔松(Pinusstrobus)的研究发现在凋落物分解前期,外源有机N和无机N均加速了凋落物分解,而在分解后期则减缓了分解速率。此外,N沉降对凋落物分解也存在无影响的情况,Hobbie[57]认为外源N在对凋落物易分解部分的加速作用被其对木质素降解的抑制作用所抵消时,N沉降对凋落物分解无明显影响。目前,由于大气N沉降的持续性和不可控性,其对森林生态系统结构和功能的影响必然长期且复杂。因此,在全球气候变化的背景下,N沉降持续增加对凋落分解及其纤维素和木质素的影响趋势和作用机理仍待进一步研究。 (1)N沉降的持续增加显著影响了常绿阔叶林和高山栎林凋落叶的分解过程,在1年的分解实验中,模拟N沉降对两种林型的凋落叶和凋落枝的分解均为抑制作用; (2)N沉降处理使得常绿阔叶林凋落物(叶和枝)质量损失95%的时间在对照(5.58、16.64年)的基础上分别增加了0.75(LN)、0.80(MN)、0.93(HN)和2.20(LN)、2.44(MN)、3.20(HN)年;高山栎林凋落物(叶和枝)质量损失95%的时间在对照(7.49、22.19年)的基础上分别增加了0.67(LN)、0.35(MN)、1.00(HN)和2.77(LN)、5.29(MN)、5.81(HN)年; (3)N沉降的持续增加抑制两种林型凋落物分解的原因在于外源N增加抑制了凋落物中纤维素和木质素的降解。

3 讨论
3.1 两种林型凋落叶、枝分解特征对模拟N沉降的响应
3.2 两种林型凋落叶、枝纤维素和木质素降解对模拟N沉降的响应
4 结论
