葛花总黄酮对2型糖尿病大鼠认知功能障碍及海马中脑源性神经营养因子表达的影响Δ
2020-12-14李建霞赵维娟许雪廷洪福娣
徐 琳,李建霞,赵维娟,许雪廷,李 娜,周 燕,洪福娣
(1.北京朝阳急诊抢救中心药剂科,北京100000; 2.中国人民解放军总医院第七医学中心药理科,北京 100700)
2型糖尿病(type 2 diabetes,T2DM)老年患者数迅速增加,已成为一个重大的公共卫生问题[1]。衰老和糖尿病与认知功能障碍风险增加有关[2]。目前可获得的研究数据表明,伴随动脉粥样硬化疾病,脑血管或其他疾病可能是T2DM患者认知减退的重要决定因素[3]。最近,一些放射学研究结果表明,糖尿病患者的认知障碍伴有脑萎缩和缺血性白质病变。由脑源性神经营养因子(BDNF)基因编码的BDNF是生长因子的神经营养蛋白家族成员,并且存在于脑和外周。BDNF在大脑中的主要作用是支持有丝分裂后神经元的存活以及新神经元、突触的生长和分化[4]。BDNF在对学习、记忆和执行功能至关重要的区域中表达,即海马、皮质和基底前脑。BDNF可激活细胞内丝裂原活化蛋白激酶/细胞外信号调节激酶级联信号通路,影响突触可塑性和缓解抑郁症状[5]。葛花总黄酮可有效清除自由基,抑制神经细胞凋亡[6]。本研究拟探讨葛花总黄酮对T2DM大鼠认知功能障碍及海马中BDNF表达的影响,为T2DM认知功能障碍的治疗提供理论依据。
1 材料与方法
1.1 动物及分组
清洁级Wistar大鼠,6~8周龄,170~220 g,雌雄各半,购自北京维通利华公司,实验动物生产许可证号:SCXK(京)2018-0013,实验动物使用许可证号:SYXK(京)2018-0061,动物质量合格证号:2019031309。大鼠喂养在单独的笼子里(湿度:60±5%,12 h黑暗/光照循环),自由饮水、进食。随机分为5组:对照组、模型组、吡拉西坦组[10 mg/kg,预实验求出吡拉西坦对2型糖尿病大鼠的半数有效量(ED50)为20 mg/kg,以1/2 ED50为作用剂量]、葛花总黄酮低剂量组(20 mg/kg,预实验求出葛花总黄酮对2型糖尿病大鼠的ED50为80 mg/kg,以1/4 ED50为作用剂量)、葛花总黄酮高剂量组(40 mg/kg,预实验求出葛花总黄酮对2型糖尿病大鼠的ED50为80 mg/kg,以1/2 ED50为作用剂量),每组20只。本实验经过中国人民解放军总医院动物伦理委员会的批准。
1.2 药品、试剂及仪器
葛花总黄酮、吡拉西坦(纯度均为99.99%,美国Sigma公司,批号为SR0607、SJ5037);链脲佐菌素(STZ,宝生物工程大连有限公司,批号为040M1357);DAB显色试剂盒(武汉博士德生物工程有限公司,批号为190107);EXPRESS一步法SYBR®GreenERTMSuperMix试剂盒(美国赛默飞世尔科技公司,批号为SC0132-6);聚乙二醇辛基苯基醚(Triton X-100)、磷酸缓冲盐溶液(PBS)、Trizol试剂(碧云天生物技术研究所,批号为C5514、C0722及ST-1337);BDNF兔抗体、山羊抗兔二抗(上海斯信生物科技有限公司,批号为M9 012 K、M7205S);抗生物素蛋白-生物素-过氧化物酶复合物试剂盒(美国Vector Laboratories公司,批号为SC8023);3,3-二氨基联苯胺四盐酸试剂、甲酚紫乙酸酯溶液(上海北诺生物科技有限公司,批号为190314、190208);白细胞介素4(IL-4)、白细胞介素8(IL-8)及肿瘤坏死因子α(TNF-α)酶联免疫吸附测定试剂盒(上海邦奕生物科技有限公司,批号为SV916、SV009及SV753)。MK3型酶标仪(美国热电公司);OlympusCX43型显微镜(日本奥林巴斯公司);NanoDrop 2000 UV-vis型分光光度计(美国Thermo Scientific公司);AS-98 StepOneTM型实时PCR系统(美国ABI公司)。
1.3 各实验组的制备
对照组大鼠喂食标准饲料。模型组、吡拉西坦组及葛花总黄酮组(低及高剂量组)大鼠喂食高脂高糖饲料,持续4周;于大鼠腹腔一次性注射STZ,剂量为50 mg/kg,72 h后检测血糖,1周内血糖保持>16.7 mmol/L被认为是T2DM模型建立成功[7]。从建模成功后第1日开始,吡拉西坦组、葛花总黄酮组大鼠分别给予吡拉西坦(10 mg/kg)、葛花总黄酮(低及高剂量组:20、40 mg/kg)灌胃,对照组和模型组大鼠灌胃0.9%氯化钠溶液,1日1次,持续给予140 d,各组给药体积均为10 ml/kg。
1.4 Morris水迷宫试验
参考相关文献,记录大鼠从入水点找到平台所需的时间(即逃避潜伏期时间)、经过原平台位置的次数及原平台象限停留时间等指标[8]。
1.5 大鼠海马神经元病理学观察
大鼠海马神经元组织常规脱水、脱蜡、包埋,苏木精-伊红(HE)染色,观察病理学结构变化。
1.6 大鼠海马组织BDNF mRNA表达水平测定
使用Trizol试剂从大鼠海马中提取总RNA,使用NanoDrop 2000 UV-vis型分光光度计评估分离的RNA的数量和质量。在AS-98 StepOneTM型实时PCR系统上使用EXPRESS一步法SYBR®GreenERTMSuperMix试剂盒进行QRT-PCR以分析BDNF的转录水平,并使用2-ΔΔCt方法分析数据,相对表达水平计算为2-[(CtBDNF)-(β-肌动蛋白的Ct)]。β-肌动蛋白用作内源对照基因。引物由宝生物工程(大连)有限公司合成。引物序列为:BDNF正向引物,5′-GGAGACCCTCC GCAACTGT-3′;反向引物,5′-GAGCTATGATGTATCTTAGTG GGTATGAG-3′;β-肌动蛋白正向引物,5′-TGGCGAGACAT TCCAAGTTTG-3′;反向引物,5′-AGAGTCATCGTCGTTGC TGATG-3′。PCR方案为:逆转录酶活化和cDNA合成(5 min、50 ℃),PCR活化(2 min、95 ℃),40个循环变性(15 s、95 ℃)和退火/延伸(在60 ℃下1 min)。
1.7 大鼠海马组织BDNF蛋白表达水平测定
将大鼠海马组织切片,用含0.01%Triton X-100、10%正常山羊血清的PBS在室温(25 ℃)下处理1 h,然后与BDNF兔抗体在4 ℃下孵育48 h。然后将切片用二抗(7.5 mg/ml生物素化的山羊抗兔)在室温下处理3 h,并用抗生物素蛋白-生物素-过氧化物酶复合物(1∶100稀释)在室温下孵育1 h,用3,3-二氨基联苯胺四盐酸试剂在室温下显色20 min,然后在0.25%甲酚紫乙酸酯溶液中温育。在400倍镜下观察500个细胞,评价标准:+3分为>50%阳性染色细胞(强表达),+2分为>20%~50%阳性染色细胞(中度表达),+1分为5%~20%阳性染色细胞(弱表达),0分为<5%阳性染色细胞(阴性表达)。
1.8 酶联免疫吸附法测定大鼠海马组织中IL-4、IL-8及TNF-α蛋白水平
制作海马组织匀浆后,采用酶联免疫吸附法检测海马组织中IL-4、IL-8及TNF-α蛋白水平,具体操作方法按照试剂盒说明书进行。
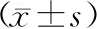
1.9 统计学方法
2 结果
2.1 五组大鼠认知功能指标水平比较
模型组大鼠逃避潜伏期时间明显长于对照组,经过原平台位置的次数明显少于对照组,原平台象限停留时间明显短于对照组,差异均有统计学意义(P<0.05)。吡拉西坦组、葛花总黄酮组大鼠逃避潜伏期时间明显短于模型组,经过原平台位置的次数明显多于模型组,原平台象限停留时间明显长于模型组;且葛花总黄酮高剂量组大鼠逃避潜伏期时间明显短于葛花总黄酮低剂量组,经过原平台位置的次数明显多于葛花总黄酮低剂量组,原平台象限停留时间明显长于葛花总黄酮低剂量组,差异均有统计学意义(P<0.05)。葛花总黄酮低剂量组大鼠逃避潜伏期时间明显长于吡拉西坦组,经过原平台位置的次数明显少于吡拉西坦组,原平台象限停留时间明显短于吡拉西坦组,差异均有统计学意义(P<0.05);葛花总黄酮高剂量组与吡拉西坦组大鼠的避潜伏期时间、经过原平台位置的次数及原平台象限停留时间的差异均无统计学意义(P>0.05),见表1。
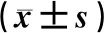
表1 五组大鼠认知功能指标水平比较Tab 1 Comparison of cognitive function indicators of rats among five groups
2.2 五组大鼠海马神经元结构比较
对照组大鼠海马区神经元细胞结构正常;模型组大鼠海马区神经元大量坏死,有明显炎症细胞浸润;吡拉西坦组、葛花总黄酮组大鼠海马神经元细胞坏死减少,且神经元细胞结构较为完整,见图1。
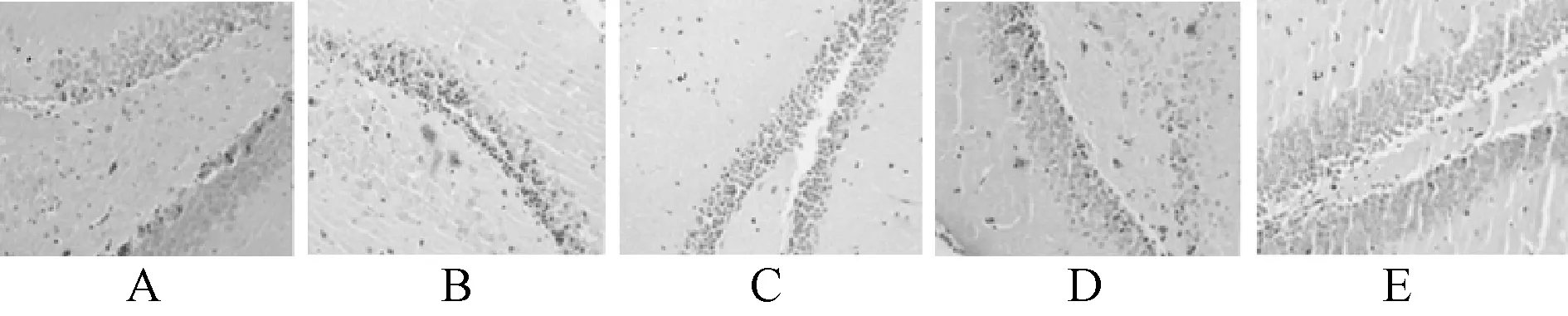
A.对照组;B.模型组;C.吡拉西坦组;D.葛花总黄酮组 低剂量组;E.葛花总黄酮组高剂量组A. control group; B. model group; C. piracetam group; D. pueraria lobata total flavonoids low dose group; E. pueraria lobata total flavonoids high dose group图1 五组大鼠海马神经元结构图(HE染色,×400)Fig 1 Hippocampal neuron structure of rats among five groups (HE staining, ×400)
2.3 五组大鼠海马组织BDNF mRNA表达水平比较
模型组大鼠BDNF mRNA表达水平明显低于对照组;吡拉西坦组、葛花总黄酮组大鼠BDNF mRNA表达水平明显高于模型组;且葛花总黄酮高剂量组大鼠BDNF mRNA表达水平明显高于葛花总黄酮低剂量组,上述差异均有统计学意义(P<0.05)。葛花总黄酮低剂量组大鼠BDNF mRNA表达水平明显低于与吡拉西坦组,差异有统计学意义(P<0.05);葛花总黄酮高剂量组大鼠BDNF mRNA表达水平与吡拉西坦组相比,差异无统计学意义(P>0.05),见表2。
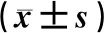
表2 五组大鼠海马组织 BDNF mRNA表达水平比较Tab 2 Comparison of BDNF mRNA expression levels in hippocampus of rats among five groups
2.4 五组大鼠海马组织 BDNF 蛋白表达水平比较
模型组大鼠BDNF蛋白表达水平明显低于对照组;吡拉西坦组、葛花总黄酮组大鼠BDNF蛋白表达水平明显高于模型组;且葛花总黄酮高剂量组大鼠BDNF蛋白表达水平明显高于葛花总黄酮低剂量组,上述差异均有统计学意义(P<0.05)。葛花总黄酮低剂量组大鼠BDNF蛋白表达水平明显低于吡拉西坦组,差异有统计学意义(P<0.05);葛花总黄酮高剂量组大鼠BDNF蛋白表达水平与吡拉西坦组相比,差异无统计学意义(P>0.05),见表3。
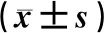
表3 五组大鼠海马组织BDNF蛋白表达水平比较Tab 3 Comparison of BDNF protein expression levels in hippocampus of rats among five groups
2.5 五组大鼠海马组织IL-4、IL-8及TNF-α蛋白表达水平比较
模型组大鼠IL-4、IL-8及TNF-α蛋白表达水平明显高于对照组;吡拉西坦组、葛花总黄酮组大鼠IL-4、IL-8及TNF-α蛋白表达水平明显低于模型组;且葛花总黄酮高剂量组大鼠IL-4、IL-8及TNF-α蛋白表达水平明显低于葛花总黄酮低剂量组,差异均有统计学意义(P<0.05)。葛花总黄酮低剂量组大鼠IL-4、IL-8及TNF-α蛋白表达水平高于吡拉西坦组,差异有统计学意义(P<0.05);葛花总黄酮高剂量组大鼠IL-4、IL-8及TNF-α蛋白表达水平与吡拉西坦组相比,差异无统计学意义(P>0.05),见表4。
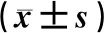
表4 五组大鼠海马组织IL-4、IL-8及TNF-α蛋白 表达水平比较Tab 4 Comparison of IL-4, IL-8 and TNF-α protein expression levels in hippocampus of rats among five groups
3 讨论
葛花总黄酮可显著改善胰岛素抵抗引起的低血糖症状,其机制与葛花总黄酮降低炎症因子水平、激活核因子κB途径以及改变胰岛素信号通路有关[9]。在神经系统中,葛花总黄酮可减轻大鼠脑缺血再灌注引起的神经细胞凋亡。最近的研究结果表明,葛花总黄酮对氧化损伤导致的脑损伤具有保护作用[10]。
认知功能研究结果显示,吡拉西坦组、葛花总黄酮组大鼠逃避潜伏期时间短于模型组,经过原平台位置的次数多于模型组,原平台象限停留时间长于模型组;提示葛花总黄酮对T2DM大鼠认知功能障碍具有明显治疗作用。结合病理分析,对照组大鼠海马区神经元细胞结构正常;模型组大鼠海马区神经元大量坏死,有明显炎症细胞浸润;吡拉西坦组、葛花总黄酮低、高剂量组大鼠海马神经元细胞坏死减少,且神经元细胞结构较为完整;说明葛花总黄酮对局灶性脑缺血大鼠海马神经元损伤具有保护作用。
BDNF是在发育中的大脑里高度表达的关键神经营养因子,在神经元的存活和维持中起着重要作用。有证据表明,BDNF在心理障碍如抑郁症和精神分裂症的发病机制和药物治疗中发挥重要作用[7,11-13]。近期的研究结果表明,神经细胞中的胰岛素受体后信号传导障碍是导致T2DM认知功能障碍的主要机制[14]。大量研究结果表明,T2DM认知功能障碍是慢性非特异性炎症,涉及炎症细胞因子、免疫系统。炎症可干扰胰岛素受体通路,导致BDNF调控表达失衡[15-16]。具体而言,炎症可以诱导BDNF的丝氨酸/苏氨酸磷酸化,影响BDNF和胰岛素受体之间的相互作用,抑制BDNF的正常酪氨酸磷酸化,降低BDNF活性,从而降低神经细胞中葡萄糖转运蛋白4(GLUT4)的表达。因此,胰岛素的生物活性降低可导致T2DM认知功能障碍的发生[17]。本研究结果发现,与对照组比较,模型组大鼠BDNF mRNA和蛋白表达水平降低;与模型组比较,吡拉西坦组、葛花总黄酮组大鼠BDNF mRNA和蛋白表达水平明显升高。这与上述结论符合,同时也提示葛花总黄酮通过促进BDNF mRNA和蛋白表达,降低胰岛素抵抗,减轻认知障碍。
动物研究结果一致表明,神经炎症在T2DM认知功能障碍的发病机制中起重要作用,神经炎症主要由神经和体液信号传导途径介导[18]。T2DM认知功能障碍的潜在机制之一可能是干扰BDNF基因的表达和功能。在T2DM炎症反应期间,促炎细胞因子(如白细胞介素1β)的释放损害了海马中的BDNF诱导。动物实验结果表明,小鼠脂多糖暴露后发生的BDNF水平降低与TNF-α有关[19-20]。本研究结果同时发现,模型组大鼠IL-4、IL-8及TNF-α蛋白表达水平高于对照组;吡拉西坦组、葛花总黄酮组大鼠IL-4、IL-8及TNF-α蛋白表达水平低于模型组;且葛花总黄酮高剂量组大鼠IL-4、IL-8及TNF-α蛋白表达水平低于葛花总黄酮低剂量组。说明炎症因子IL-4、IL-8及TNF-α水平的降低与葛花总黄酮能改善T2DM大鼠认知功能障碍有关。
综上所述,葛花总黄酮对T2DM大鼠认知功能障碍的疗效显著,其机制与葛花总黄酮通过促进BDNF mRNA和蛋白表达,降低IL-4、IL-8及TNF-α表达水平,减轻胰岛素抵抗以及炎症反应有关。
