当归芍药散含药血清对Aβ1-42 诱导的SH-SY5Y细胞周期和凋亡的影响
2020-12-13贺春香余婧萍李富周成绍武宋祯彦
贺春香,余婧萍,李富周,贺 旭,李 平,成绍武,宋祯彦
(湖南中医药大学,中西医结合心脑疾病防治湖南省重点实验室,湖南长沙 410208)
阿尔兹海默病(Alzheimer’s disease,AD)是一种与衰老相关的进行性发展的神经系统退行性疾病,临床上以认知功能障碍,特别是记忆障碍和视空间技能损害为主要特点。随着人口老龄化日趋明显,AD在老年人群的患病率逐年上升,我国65岁老人中患病率高达6.6%[1]。细胞外神经纤维斑块和细胞内神经原纤维缠结是AD的主要病理特征,诱导这些致病转化的分子机制尚不清楚[2]。脑内沉积的β-淀粉样蛋白(amyloid-beta,Aβ)被认为是AD的关键病理过程[3]。Aβ 是由淀粉样前体蛋白(Amyloid precursor protein,APP)经β-和γ-分泌酶的蛋白水解作用而产生的含有39~43个氨基酸的多肽,其在脑内的沉积形成不溶性斑块引发神经毒性作用是神经元凋亡的重要原因[4]。Aβ1-42处理的原代神经元在细胞周期标记物、DNA复制和有丝分裂突变方面存在异常表达[5]。研究表明,Aβ 刺激可以促进神经元的分化抑制蛋白1(inhibitor of differentiation-1,Id1)、音猬因子(sonic hedgehog,SHH)和Cyclin D1等细胞周期进程相关因子的异常表达,参与诱导终末分化的神经元细胞周期异常激活导致神经元脆裂、变性和死亡[6]。Aβ 也可引起神经元活性氧产生增多、DNA损伤[7],使得防止神经元细胞周期再入的周期蛋白依赖性激酶5 (Cyclin Dependent Kinase 5,Cdk5)表达下降,在与Aβ 的共同刺激下,促使神经元细胞周期再入,一方面,作为细胞周期启动蛋白Cyclin D1过表达激活成视网膜细胞瘤蛋白(Retinoblastoma protein,Rb)使其磷酸化,并向S期过渡;另一方面,过度损伤的DNA导致PARP(poly ADP-ribose polymerase)和p38 (Thr 180/Tyr 182)的激活,使得casepse3激活增多,Bax表达量升高以及Bcl-2/Bax比率的下降,从而导致神经元凋亡[8]。这种在进入细胞周期的合成阶段之前,在G1至S点出现神经元细胞死亡,被经典地称为“abortive cell cycle reentry”,其特征是细胞周期和凋亡蛋白的上调[9-10]。因此,研究干扰Aβ 依赖信号途径的药物对于预防AD脑内神经元细胞周期失调和凋亡引起的神经退行性病变具有一定的临床意义。当归芍药散出自东汉张仲景的《金匮要略》,临床观察证明当归芍药散是治疗AD的有效方剂[11-12],实验研究发现当归芍药散改善AD的认知功能主要与抗炎、抗氧化损伤、增强脑组织的能量代谢、促进突触形成等相关[13-15]。本研究利用Aβ1-42诱导人神经母细胞瘤细胞(SH-SY5Y)构建AD细胞模型来研究当归芍药散对Aβ1-42诱导的SH-SY5Y细胞周期和凋亡的影响。
1 材料
1.1 细胞 SH-SY5Y细胞株购自武汉普诺赛生物有限公司(货号CL-0208),用含10% 胎牛血清,100 U/mL青霉素和100 U/mL链霉素(美国Gibco公司,货号分别为 10270-106,15070063)的DMEM/F12培养基 (美国Hyclone公司,货号SH30023.01)在37 ℃、5% CO2的条件下培养。
1.2 动物 SD大鼠,10只,SPF级,雄性,体质量250~300 g,购自湖南斯莱克景达实验动物有限公司,实验动物生产许可证号SCXK (湘)2013-0004,饲养于湖南中医药大学第一附属医院实验动物中心。动物实验方案通过湖南中医药大学第一附属医院伦理委员会的批准(ZYFY20190905)。
1.3 药物与试剂 当归芍药散由当归7 g、白芍37.2 g、茯苓9.3 g、白术9.3 g、泽泻18.6 g、川芎18.6 g组成,所有药材均购自湖南中医药大学第一附属医院药剂科,由药剂科主任戴冰教授鉴定为正品。Aβ1-42(美国Thermo Fisher Scientific公司,货号03112);噻唑蓝(MTT)和乳酸脱氢酶(LDH)活性检测试剂盒(北京索莱宝科技有限公司,货号M8180、BC0685);一步法TUNEL细胞凋亡检测试剂盒(绿色荧光)(上海碧云天生物技术有限公司,货号C1086);细胞周期染色试剂盒(杭州联科生物技术股份有限公司,货号CCS012);Bax、Bcl-2、Cyclin D1、β-actin (北京博奥森公司,货号分别为bs-0127M、bs-0032R、bs-0623R、bs-0061R);山羊抗兔二抗、山羊抗小鼠二抗 (美国Sigma-Aldrich公司,货号分别为AP132P、AP124)。
1.4 仪器 Z36HK超速冷冻离心机(德国Hermle公司);Series 8000 WJ CO2培养箱(美国Thermo Fisher公司);Axio Vert.A1倒置显微镜 (德国ZEISS公司);Cytation3多功能酶标仪 (美国BioTek公司);Gel Doc XR+凝胶成像系统(美国Bio-Rad公司);A1+共聚焦激光显微镜 (日本Nikon公司);MoFlo XDP超速流式分选系统(美国贝克曼库尔特有限公司)。
2 方法
2.1 当归芍药散冻干粉制备 当归芍药散采用水提法制备冻干粉[13]。按处方比例称取药材100 g(当归7 g、白芍37.2 g、茯苓9.3 g、白术9.3 g、泽泻18.6 g、川芎18.6 g),用5倍体积蒸馏水浸泡药物2 h,100 ℃煮沸0.5 h,小火煨1 h,收集滤液。使用3倍体积蒸馏水按照上述步骤再次提取。2次提取物混合后,用旋转蒸发器浓缩成浸膏。最后,将浸膏装入冻干机真空冷冻干燥得到当归芍药散冻干粉。
2.2 含药血清制备 取雄性SD大鼠10只随机分为2组,给药组大鼠灌胃给予当归芍药散浓缩液(生药24 g/kg),正常对照组给予同体积蒸馏水。灌胃7 d后,于末次灌胃后2 h后以3%水合氯醛(10 mL/kg)麻醉大鼠,暴露腹主动脉,用负压采血管采集全血5 mL至无抗凝剂的普通采血管中,静置过夜,3 000 r/min离心10 min,收集上清,经0.22 μm滤膜过滤,-80 ℃冻存备用。
2.3 Aβ1-42处理构建AD细胞模型 SH-SY5Y细胞生长处于对数期时,接种到培养板中培养24 h贴壁,根据课题组前期研究[16],给予10 μmol/L Aβ1-42处理24 h构建AD细胞模型。。
2.4 分组及当归芍药散含药血清干预 细胞分组为空白对照组(空白血清),模型组(10 μmol/L Aβ1-42+空白血清),当归芍药散含药血清低、中、高干预组(10 μmol/L Aβ1-42造模后分别给予25、50、100 mL/L含药血清干预24 h,即每升完全培养基中分别含有25、50、100 mL当归芍药散含药血清,体积分数分别为2.5%、5%、10%),采用“体积分数+受试药物含药血清” 的方式表达[13]。
2.5 细胞活率和LDH活性检测 96孔板中按8×103/孔密度接种细胞培养贴壁,按方法10 μmol/L Aβ1-42处理24 h后,根据MTT试剂盒和LDH活性检测试剂盒说明书方法检测每个孔的细胞存活情况和LDH活性。
2.6 TUNEL染色检测细胞凋亡 6孔板中放入盖玻片接种4×105/孔细胞使细胞爬片,经试验处理24 h后,用4%多聚甲醛室温固定10 min,PBS清洗细胞,0.3% Triton-X透膜5 min,将TUNEL反应混合物加入细胞,37 ℃孵育1 h,DAPI染核5 min,PBS清洗后使用尼康A1+共聚焦显微镜10倍物镜下扫描成像。随机选取5个视野,采用Image J分析每组平均荧光强度,统计细胞凋亡率。
2.7 流式细胞术检测细胞周期 6孔板接种4×105/孔细胞培养至贴壁,经试验处理24 h后,按照细胞周期染色试剂盒所述方法操作。收集细胞离心弃上清,轻弹管壁,使沉淀重悬在残余的液体中,加入1 mL室温下的PBS。将细胞缓慢加入至3 mL无水乙醇(-20 ℃预冷)中,边加边高速搅拌。-20 ℃固定过夜。检测当天,将固定细胞离心,弃去乙醇,轻弹管壁使沉淀松散,加入5 mL室温下的PBS,放置15 min使细胞再次水化。离心,弃上清。加入1 mL PI染色液,室温避光孵育30 min。选择最低上样速度,在贝克曼MoFlo XDP流式细胞仪上进行检测,488 nm激发光源,使用FL2-RPE (578 nm)通道检测。流式结果使用Modfit软件进行分析。
2.8 Western blot检测细胞周期和凋亡相关蛋白表达 细胞经实验处理后使用RIPA法裂解细胞,30 Hz超声10 s断裂DNA,12 000 r/min离心15 min,取上清,BCA法检测定量蛋白浓度,每孔上样30 μg/孔,100 V电泳100 min,0.45 μm PVDF膜200 A湿转90 min,5%脱脂牛奶室温封闭1 h,封闭后一抗用TBST 1 ∶1000稀释,β-actin为内参,4 ℃孵育过夜,二抗(1 ∶10 000)37 ℃避光孵育1 h,ECL化学发光法显影,Gel Doc XR+凝胶成像系统成像计算灰度值统计分析。
2.9 统计学分析 采用SPSS 21.0进行数据的统计与分析,计量资料以()表示,多组间比较采用单因素方差分析,先进行正态性分析和方差齐性检验,两两比较方差齐者用LSD检验,方差不齐者用Tamhane’s T2法检验,以P≤0.05为差异有统计学意义。
3 结果
3.1 当归芍药散含药血清对Aβ1-42处理的SHSY5Y细胞形态的影响 明场下观察SH-SY5Y细胞生长情况(图1),空白对照组细胞生长良好,细胞细长呈梭形或者椭圆形,有树枝状轴突,细胞饱满透亮。Aβ1-42处理24 h后SH-SY5Y细胞出现损伤,细胞密度有所下降,树枝状轴突消失,细胞部分皱缩,部分包膜出现破裂,细胞光泽变暗,细胞间隙增大。当归芍药散含药血清干预后,细胞形态有所恢复,部分细胞恢复呈梭形或者椭圆形,细胞间隙变小。

图1 不同浓度当归芍药散含药血清干预Aβ1-42处理后SH-SY5Y细胞的形态学变化Fig.1 Morphological changes of Aβ1-42-induced SH-SY5Y cells due to Danggui Shaoyao Powder medicated serum treatment at different concentrations
3.2 当归芍药散含药血清对Aβ1-42处理的SHSY5Y细胞存活率和LDH活性的影响 MTT检测结果(图2)显示,与空白对照组比较,模型组的SH-SY5Y细胞存活率下降(P<0.01)。与模型组比较,给予当归芍药散含药血清干预24 h后,5%、10%当归芍药散含药血清组的SH-SY5Y细胞的细胞存活率均提高(P<0.01)。LDH漏出率检测结果(图3)显示,与空白对照组比较,模型组的SH-SY5Y细胞LDH漏出率升高(P<0.01);与模型组比较,当归芍药散含药血清能一定程度降低模型组细胞LDH漏出率,5%、10%当归芍药散含药血清组均具有统计学意义(P<0.01)。
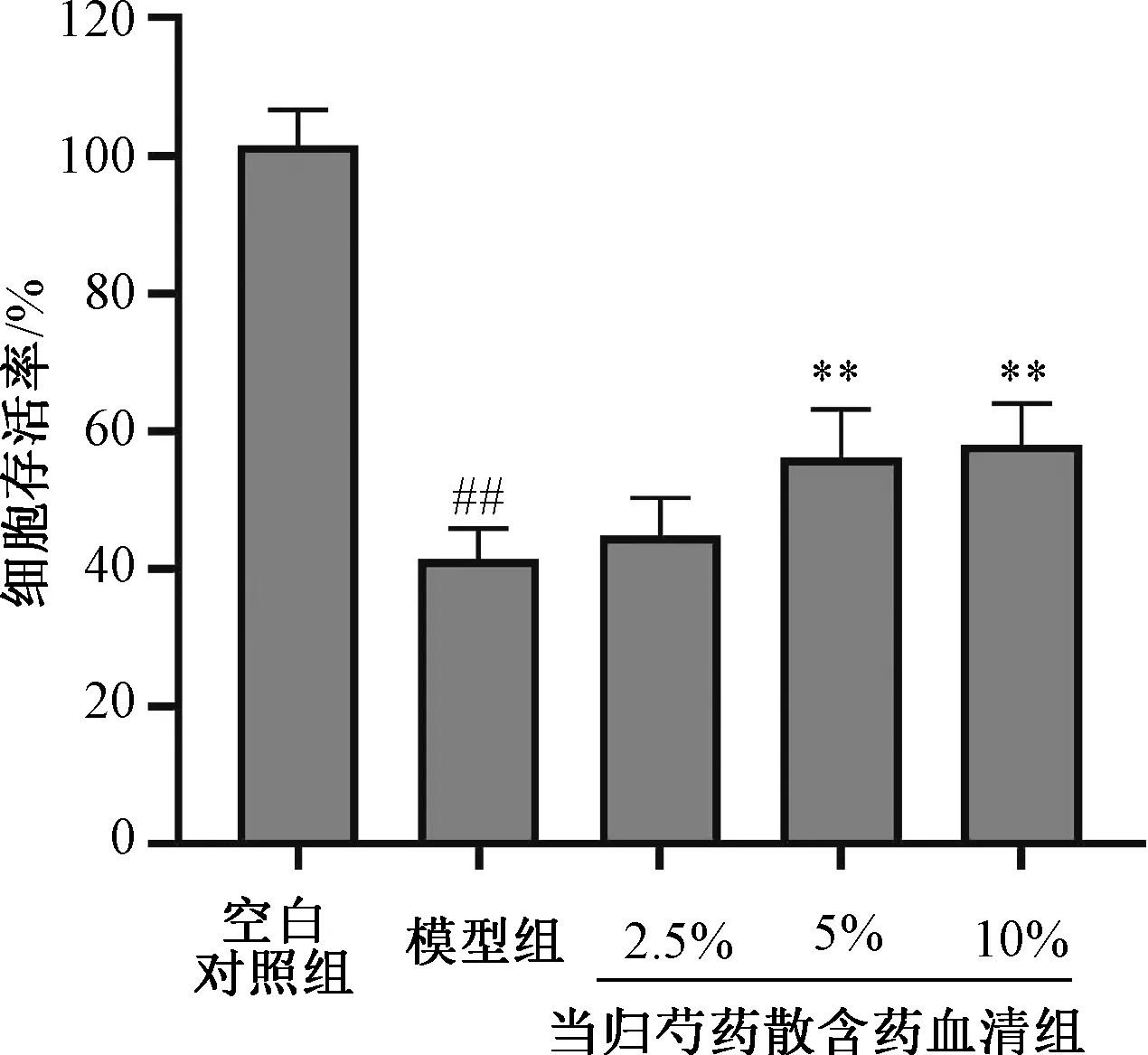
图2 不同浓度当归芍药散含药血清对Aβ1-42处理后SHSY5Y细胞存活率的影响(n=6)Fig.2 Effects of Danggui Shaoyao Powder medicated serum at different concentrations on the cell viability of Aβ1-42-induced SH-SY5Y cells (n=6)
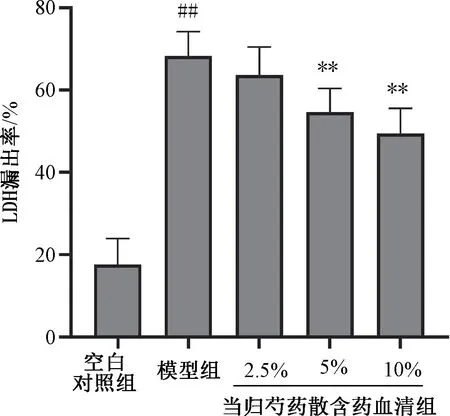
图3 不同浓度当归芍药散含药血清对Aβ1-42处理后SHSY5Y细胞LDH活性的影响(n=6)Fig.3 Effects of Danggui Shaoyao Powder medicated serum at different concentrations on the LDH activity of Aβ1-42-induced SH-SY5Y cells (n=6)
3.3 当归芍药散含药血清对Aβ1-42处理的SHSY5Y细胞凋亡的影响 细胞凋亡结果显示(图4)当归芍药散含药血清呈浓度依赖性抑制Aβ1-42介导的SH-SY5Y细胞凋亡。荧光强度统计分析结果显示(表1),与空白对照比较,10 μmol/L Aβ1-42处理SH-SY5Y细胞24 h后,细胞凋亡率增高(P<0.05),细胞凋亡率为(48.12±5.28)%。与模型组比较,5%、10%当归芍药散含药血清干预24 h后细胞凋亡率为 (17.69 ± 4.26)%、(15.64 ±4.15)%,P<0.01表示差异有统计学意义。
表1 不同浓度当归芍药散含药血清对Aβ1-42 处理后SHSY5Y细胞凋亡的影响(, n=3)Tab.1 Effects of Danggui Shaoyao Powder medicated serum at different concentrations on the apoptosis rate of Aβ1-42-induced SH-SY5Y cells(, n=3)

表1 不同浓度当归芍药散含药血清对Aβ1-42 处理后SHSY5Y细胞凋亡的影响(, n=3)Tab.1 Effects of Danggui Shaoyao Powder medicated serum at different concentrations on the apoptosis rate of Aβ1-42-induced SH-SY5Y cells(, n=3)
注:与空白对照组比较,##P<0.01;与模型组比较,**P<0.01。
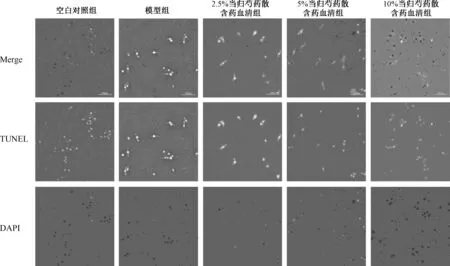
图4 TUNEL染色检测不同浓度当归芍药散含药血清对Aβ1-42处理后SH-SY5Y细胞凋亡的影响Fig.4 Effect of Danggui Shaoyao Powder medicated serum at different concentrations on the apoptosis of Aβ1-42-induced SH-SY5Y cells using TUNEL
3.4 当归芍药散含药血清对Aβ1-42处理的SHSY5Y细胞周期的影响 流式细胞术检测细胞周期结果显示(表2、图5),与空白对照组比较,模型组SH-SY5Y细胞在10 μmol/L Aβ1-42处理24 h后,G0/G1期细胞数量无变化,S期细胞数量增加(P<0.05),G2/M期细胞数量下降(P<0.05)。与模型组比较,2.5%当归芍药散含药血清组细胞周期G0/G1、S、G2/M期均差异无统计学意义;5%、10% 当归芍药散含药血清干预后G0/G1期细胞数量无变化,S期细胞数量减少(P<0.05),G2/M期细胞数增加(P<0.05)。提示Aβ1-42处理后SHSY5Y细胞大量进入细胞周期,停滞于S期,细胞周期阻滞;5%、10% 当归芍药散含药血清干预后能改善Aβ1-42对SH-SY5Y细胞周期的影响。
3.5 当归芍药散含药血清干预后周期蛋白Cyclin D1和凋亡相关蛋白的表达 Western blot结果显示(图6、表3),与空白对照组比较,Aβ1-42处理后周期相关蛋白Cyclin D1表达上调(P<0.01),抑制凋亡蛋白Bcl-2表达下降,促凋亡蛋白Bax表达升高(P<0.01);与模型组比较,5%、10% 当归芍药散含药血清干预后Cyclin D1蛋白表达降低(P<0.05),Bcl-2蛋白表达升高(P<0.01),Bax蛋白表达下降(P<0.01)。
表2 不同浓度当归芍药散含药血清对Aβ1-42处理后SH-SY5Y细胞周期的影响(, n=5)Tab.2 Effects of Danggui Shaoyao Powder medicated serum at different concentrations on the cell cycle of Aβ1-42-induced SH-SY5Y cells (, n=5)
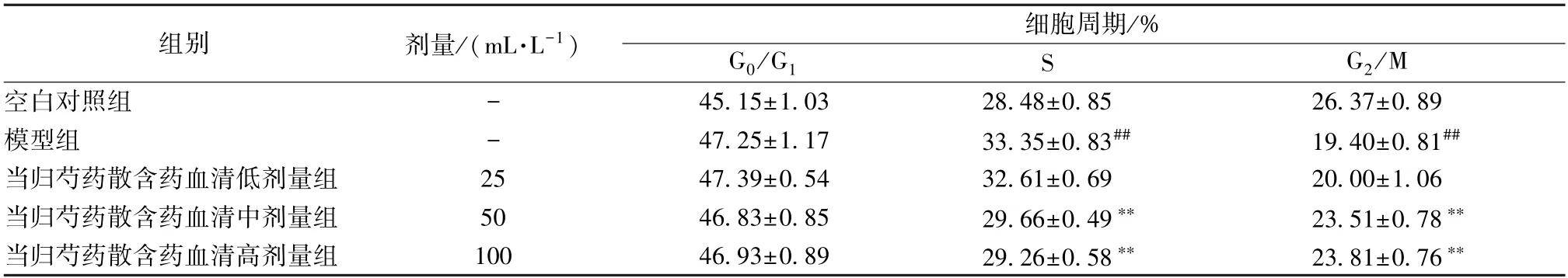
表2 不同浓度当归芍药散含药血清对Aβ1-42处理后SH-SY5Y细胞周期的影响(, n=5)Tab.2 Effects of Danggui Shaoyao Powder medicated serum at different concentrations on the cell cycle of Aβ1-42-induced SH-SY5Y cells (, n=5)
注:与空白对照组比较,##P<0.01;与模型组比较,**P<0.01。

图5 不同浓度当归芍药散含药血清对Aβ1-42处理后SH-SY5Y细胞周期的影响Fig.5 Effect of Danggui Shaoyao Powder medicated serum at different concentrations on the cell cycle of Aβ1-42-induced SH-SY5Y cells
4 讨论

图6 Western blot检测各组蛋白表达Fig.6 Detection of the protein expression of each group by Western blot
表3 当归芍药散含药血清对Aβ1-42处理后SH-SY5Y细胞Cyclin D1和凋亡相关蛋白的影响(, n=3)Tab.3 Effects of Danggui Shaoyao Powder medicated serum on the apoptosis related proteins and Cyclin D1 of Aβ1-42-induced SH-SY5Y cells (, n=3)

表3 当归芍药散含药血清对Aβ1-42处理后SH-SY5Y细胞Cyclin D1和凋亡相关蛋白的影响(, n=3)Tab.3 Effects of Danggui Shaoyao Powder medicated serum on the apoptosis related proteins and Cyclin D1 of Aβ1-42-induced SH-SY5Y cells (, n=3)
注:与空白对照组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01。
中医学认为痴呆病位在脑,与肝、肾、脾三脏密切相关,肝失疏泄,脾失健运,肾乏气化,分清泌浊失司,酿生痰浊血瘀,痰瘀互结,蒙蔽神明[17]。中医认为治疗老年痴呆当以养肝补肾为主,当归芍药散方中重用白芍养血调肝,当归充补肝血以补肾精;川芎活血通络,引血上行;白术、茯苓、泽泻健脾利湿,有化痰排浊功效,利于肾浊排出,诸药合用具有滋补肝肾,活血化瘀,化痰通络。上世纪80年代,日本学者首先发现当归芍药散能改善AD患者的运动障碍和认知功能下降[18],随后国内外许多当归芍药散抗衰老的临床报道和实验室研究资料表明[19-20],当归芍药散具有抗衰老作用,主要表现为提高学习记忆能力,清除自由基、抗氧化,增强海马神经突触可塑性等[15],本研究结果表明,当归芍药散能抑制Aβ 引起细胞周期失调和细胞凋亡,具有神经保护作用。
本研究重点考察当归芍药散通过对Aβ 所导致的神经元细胞周期再入和细胞凋亡的调控作用,探索中药复方当归芍药散防治神经退行性疾病的作用机制,故采用Aβ1-42处理SH-SY5Y细胞构建AD细胞模型。G1/S-特异性周期蛋白-D1 (Cyclin D1),与细胞周期激活和G1/S期进展相关。当细胞进入S期后,可CyclinD1过表达可使细胞缩小,缩短G1期,加速进入S期。Aβ 使CyclinD1水平的增加并使细胞脱离有丝分裂后期,重新进入细胞周期[21]。而正常的成年神经元细胞不再进入细胞周期(而是停留在G0期),属于永久性的有丝分裂后细胞,神经元细胞周期的异常激活会导致细胞的死亡[22]。在AD患者大脑中,CyclinD1的积累与细胞周期激活相关,并最终导致细胞的死亡[23]。同样有研究发现用Aβ 作用于SH-SY5Y后,细胞周期进展不会超过S期,并伴随着细胞的凋亡[24]。此外,CyclinD1的核定位功能使神经元能保持为终末分化状态,同时它的核入口调节功能在神经元细胞周期退出中起到重要作用[25]。通过流式细胞术检测细胞周期结果显示,Aβ1-42处理后,SH-SY5Y细胞S期细胞数量显著增加,G2/M期显著减少,表明Aβ 能促进SH-SY5Y细胞进入细胞周期,但大量停留在S期而没有进入G2/M期,表现为细胞周期阻滞,并可能进一步诱发细胞凋亡[26]。当归芍药散含药血清干预后与模型组比较,S期细胞数量显著减少,G2/M期细胞数量显著增加,提示当归芍药散含药血清干预后能改善Aβ1-42诱导的SHSY5Y细胞周期再进入。课题组推测,可能的机制是由神经元中Aβ 的刺激,迫使神经元进入细胞周期,然而,细胞周期功能失调阻碍了神经元的成功分裂,或者使它们变得脆弱,导致神经元变性,最终死亡,而当归芍药散能有效的减轻Aβ 引起的SH-SY5Y细胞周期再进入和神经元凋亡。
抗凋亡蛋白Bcl-2是线粒体凋亡的中心调控因子并阻止Bax和Bak的同质寡聚化,在AD患者大脑中会出现下调[27]。Bax是Bcl-2家族的促凋亡蛋白,Bax的过度表达可拮抗Bcl-2的保护效应而使细胞趋于死亡。研究表明Bax易位 (激活)参与Aβ 诱导的细胞凋亡过程[28-29]。Bax/Bcl-2 2种蛋白之间的比率是决定对细胞凋亡抑制作用强弱的关键因素。研究发现,Aβ 会通过改变线粒体核裂变和核聚变蛋白质促进氧化应激介导的线粒体动力学损伤最终导致SH-SY5Y细胞凋亡,并伴随着Bax/Bcl-2比率的升高[30]。同时体内实验发现Aβ 诱导的神经毒性的大鼠海马区的BaxmRNA水平出现上升[31]。通过Western blot对蛋白Bax和Bcl-2进行检测,结果显示Aβ1-42处理后促凋亡蛋白Bax表达显著升高,Bax激活增多,抑制抗凋亡蛋白Bcl-2表达,使其表达显著下降,与模型组比较,当归芍药散含药血清干预后Bax蛋白表达出现不同程度下降,对Bcl-2蛋白的抑制作用降低,Bcl-2蛋白的表达出现不同程度升高。说明Aβ 通过对Bax/Bcl-2的调节诱导SH-SY5Y细胞凋亡的发生,当归芍药散对Aβ 诱导的细胞凋亡具有保护作用。
本研究采用Aβ1-42处理SH-SY5Y细胞构建AD细胞模型,给予不同浓度当归芍药散含药血清干预。结果提示当归芍药散能明显减轻Aβ1-42引起的SH-SY5Y细胞损伤,抑制细胞周期再进入和细胞凋亡,发挥神经保护作用。
