PAQR9 对棕色脂肪产热及UCP1 表达的影响
2020-12-13刘思佳汤其群
刘 玲 刘思佳 刘 洋 汤其群
(复旦大学基础医学院生物化学与分子生物学系 上海 200032)
脂肪组织是一种重要的能量代谢器官,当机体摄入能量大于消耗能量,多余的能量会以甘油三酯的形式储存在脂肪组织中[1]。脂肪组织过多会引发肥胖、2 型糖尿病、非酒精性脂肪肝等疾病,对公众健康造成了巨大威胁。人体有3 种脂肪组织,分别是白色脂肪组织(white adipose tissue,WAT),棕色脂肪组织(brown adipose tissue,BAT)和米色脂肪组织(beige adipose tissue)[2]。WAT 可以将多余的能量以甘油三酯的形式储存,而BAT 中含有较多线粒体,通过解偶联蛋白1(uncoupling protein 1,UCP1)将跨线粒体内膜的质子势能与ATP 解偶联,将能量转化为热能,从而起到产热和消耗能量的作用[3]。近年来研究发现,在低温环境诱导下小鼠腹股沟皮下白色脂肪会产生功能、形态类似于棕色脂肪的细胞,内含许多线粒体和小脂滴,能够高表达UCP1,和棕色脂肪细胞一样能够促进脂肪组织代谢产热。但其与传统棕色脂肪细胞的前体起源不同,因此被命名为米色脂肪细胞[4]。二者被统称为产热性脂肪组织。自此,研究者对于米色脂肪细胞的诱导激活产生了极大的兴趣,其可作为对抗肥胖的新型靶细胞。
UCP1 特异性表达于BAT 的线粒体中[5],是成熟棕色脂肪特异性的产热基因[6]。白色脂肪细胞被诱导为米色脂肪细胞后高表达UCP1。实验中往往将UCP1 作为重要的标志物来研究脂肪组织的产热功能。棕色、米色脂肪细胞的线粒体内膜上有UCP1 质子通道,通过线粒体内膜来消散质子梯度,使质子回流,破坏电子传递中的跨膜电化学梯度,物质氧化和ATP 生成解偶联,ATP 合成受到抑制,能量会以热量的形式散发出去。UCP1 在体温维持过程中发挥重要作用。有研究发现,当机体的交感神经系统发生兴奋,如受到冷刺激的诱导时[7],棕色和米色脂肪组织的产热功能被激活,可以被用于治疗肥胖、糖尿病等代谢性疾病[8]。冷刺激诱导下,腹股沟皮下WAT 中UCP1 表达明显上调[9],使其出现BAT 的典型特点,增加产热和能量消耗[10]。
由于传统的减肥药具有不良反应,未达到理想的临床效果。因此,筛选出新型基因来诱导激活棕色脂肪产热有助于改善机体代谢和减轻肥胖程度,具有良好的研究前景。本课题组致力于研究脂肪细胞发育分化及代谢调控机制,筛选在脂肪组织产热过程发挥重要作用的蛋白。此前,课题组通过转录组测序技术在冷刺激诱导后的腹股沟皮下WAT中筛选,发现PAQR9 的表达水平显著升高,推测其可能在激活脂肪组织产热过程中发挥重要作用。近年来对PAQR9 的研究非常少见,对其在该过程中的功能进行初步探索,可以为肥胖等疾病治疗提供新的理论依据。
本研究中,我们首先检测了PAQR9 在小鼠脂肪组织中的表达情况及冷暴露刺激条件下脂肪组织和腹股沟皮下WAT 成熟脂肪细胞中PAQR9 的表达情况,对转录组测序结果进行验证。再利用前棕色脂肪细胞系DE2-3 和间充质干细胞C3H10T1/2 为模型开展研究,通过在细胞中过表达和敲低PAQR9 基因,探讨该基因对棕色脂肪产热及UCP1表达的影响。
材料和方法
仪器设备二氧化碳培养箱购于美国Thermo Fisher 公司;PCR 仪购于德国Eppendorf 公司;蛋白质印迹电泳槽等购于美国Bio-Rad 公司;化学发光仪购于美国GE 公司;冷冻离心机购于德国Eppendorf AG 公司;Milli-q 超纯水系统购于德国Millipore 公司。
主要试剂DMEM 培养基,胎牛血清购于美国Gibco 公司;UCP1 抗体购于美国Abcam 公司;HSP90 抗体购于美国Santa Cruz Biotechnology 公司;SYBR Green reagent 购于美国ABI 公司;逆转录试剂盒购于日本TaKaRa 公司;ECL 发光液购于上海圣尔生物有限公司;三氯甲烷、异丙醇、75%乙醇、无水乙醇均购于国药集团化学试剂上海有限公司;BCA 定量试剂盒、opti-MEM 培养基、蛋白Marker 购于美国Thermo Fisher 公司;Trizol 和lipofectamine RNAiMAX 试剂购于美国Invitrogen公司;PBS 试剂购于以色列BI 公司;3-异丁基-1-甲基黄嘌呤(IBMX)、地塞米松、三碘甲状腺氨酸(T3)、吲哚美辛、罗格列酮、油红O 购于美国Sigma-Alderich 公司;胰岛素、蛋白酶抑制剂购于瑞士Roche 公司。
实验动物雄性C57BL/6J 小鼠购于南京大学模式动物中心,小鼠置于SPF 级动物房,在(22±2)℃,相对湿度55%±5%的环境中饲养。维持12/12 h 光/暗循环。动物实验均遵循复旦大学实验动物伦理委员会相关规定。
处死取材将动物适应性饲养1 周后处死,取5只雄性C57BL/6J 小鼠BAT、附睾内脏WAT 及腹股沟皮下WAT,速冻于液氮中。
前棕色脂肪细胞系DE2-3 培养及诱导分化实验室前期获得了永生化的前棕色脂肪细胞系[11](美国麻省大学医学院王永旭博士及复旦大学基础医学院潘东宁教授惠赠),按照下述标准法可诱导其分化为成熟棕色脂肪细胞。细胞培养箱恒温37 ℃,含有5%CO2。在含有10%胎牛血清、1%青霉素和链霉素双抗的DMEM 培养基中培养细胞,每2 天给细胞换1 次液,传代后接种于3.5 cm 培养皿。镜下观察贴壁细胞密度占视野70%时记为第2 天(day-2),培养基中加入三碘甲状腺氨酸和胰岛素,混匀后给细胞换液;2 天后细胞密度达到100%,记为第0 天(day 0),在DMEM 中加入0.5 mmol/L 3-异丁基-1-甲基黄嘌呤,0.5 μmol/L 地塞米松,0.125 mmol/L吲哚及1 μg/mL 胰岛素,摇匀后换液;在第2 天(day 2)和第4 天(day 4),操作同第-2 天(day -2),补加三碘甲状腺氨酸和胰岛素,混匀后给细胞换液,镜下观察到细胞的脂滴逐渐增多;第6 天(day 6),可以观察到镜下布满脂滴,诱导分化结束,收取细胞样本进行后续实验。
C3H10T1/2 细胞系培养及诱导分化间充质干细胞C3H10T1/2 购于美国ATCC 细胞库。该细胞系是科学家于1973 年由14~17 日龄C3H 小鼠胚胎中分离出来[12],细胞呈现成纤维细胞形态。Tang等[13]研究发现该细胞模型可以定向诱导分化为成熟脂肪细胞。细胞培养箱恒温37 ℃,含有5%CO2。在含有10%胎牛血清、1%青霉素和链霉素双抗的DMEM 培养基中培养细胞,每2 天换1 次液,传代后接种于3.5 cm 培养皿。细胞接触抑制2 天后开始诱导分化,记为第0 天(day 0),在DMEM 培养基中加入1 μg/mL 胰岛素、1 μmol/L 地塞米松、0.5 mmol/L 3-异丁基-1-甲基黄嘌呤和1 μmol/L 罗格列酮诱导48 h。第2 天(day 2)时更换培养基,补加1 μmol/L罗格列酮和1 μg/mL 胰岛素继续诱导细胞48 h。在第4 天(day 4)给细胞更换含有10% 胎牛血清的DMEM 培养液,不补加药物。直至第6 天(day 6)脂肪细胞分化成熟。
构建过表达腺病毒设计带有酶切位点的引物,PCR 得到两端带有酶切位点的基因。酶切回收得到目的片段和载体,将回收的产物相连接;扩增连接产物,测序以验证序列;LR 重组及PacⅠ酶切;将酶切产物转染至HEK 293A 工具细胞中包装病毒。向培养皿中加入LacZ 病毒(对照组)和PAQR9病毒各(实验组)60 μL 感染DE2-3 细胞,24 h 后更换为含有10%胎牛血清的DMEM 培养液,继续培养至脂肪细胞分化成熟。
小干扰RNA 100 μL opti-MEM 中加入6 μL 3.5 cm 细胞培养皿用量的小干扰RNA(small interfering RNA,siRNA),根据所需用量配齐总管,轻轻吹打混匀,记为管1。再取另一EP 管加入100 μL opti-MEM 及6 μL转染试剂lipofectamine RNAiMAX(3.5 cm 细胞培养皿用量),根据所需用量配齐总管,轻轻吹打混匀,记为管2,管1、管2 静置3 min,将管2溶液缓缓滴加到管1 中,反复吹打5 次,混匀后静置20 min。将细胞上清培养基倾倒,换为2 mL opti-MEM。将静置的siRNA 缓缓加到细胞,每个3.5 cm培养皿加入200 μL siRNA。24 h 后倾倒转染培养液,换成含有10%胎牛血清的DMEM 培养液,在转染48 h 后进行后续实验操作。siNC 为对照组,siPAQR9 1-3 为实验组。siRNA 序列如下:NC 上游引物序列5’-UUCUCCGAACGUGUCACG-UTT-3’,NC 下游引物序列ACGUGACACGUUCGGAGAATT-3’;siPAQR9-1 上游引物序列5’-GCUGCCGCUGUGGUGCUAUTT-3’,siPAQR9-1 下游引物序列5’-AUAGCACCACAGCGGCAGCTT-3’;siPAQR9-2 上游引物序列5’-GCCUUCUUCUACCUGGACUTT-3’,siPAQR9-2下游引物序列5’-AGUCCAGGUAGAAGAAGGCTT-3’;siPAQR9-3 上游引物序列5’-GCACCUUCGUCUUCGUCAUTT-3’,siPAQR9-3 下游引物序列5’-AUGACGAAGACGAAGGUGCTT-3’。
液态氧电极检测细胞氧气消耗按照说明书安装氧电极(YSI model 5300A),KCl 溶液作为电解液,连接线路接通电源。在电脑软件中校正,清洗反应室,将细胞用700 μL 胰酶消化,再加入700 μL缓冲液终止消化。500×g离心2 min,弃上清,用700 μL 缓冲液重悬细胞。加入机器中,观察耗氧曲线,记录数值。缓冲液配置方法:PBS 溶液中加入25 mmol/L 葡萄糖,1 mmol/L 丙酮酸钠和2% BSA。每个3.5 cm 细胞培养皿中加入700 μL 缓冲液。
RNA 制备和实时荧光定量PCR 检测利用Trizol 法提取细胞及组织中的RNA,测定RNA 浓度后,根据逆转录试剂盒说明书将其逆转录为cDNA。引物序列如下:18SrRNA 上游引物序列5’-CGCCGCTAGAGGTGAAATTCT-3’,18SrRNA下游引物序列5’-CATTCTTGGCAAATGCTTTCG-3’;PAQR9 上游引物序列5’-GGACTACGCTTCCATCAGCTA-3’,PAQR9 下游引物序列5’-CAGTCGGTGCGGCTCTTAC-3’;UCP1 上游引物序列5’-AGGCTTCCAGTACCATTAGGT-3’,UCP1 下游引物序列5’-CTGAGTGAGGCAAAGCTGATTT-3’;Adipoq 上游引物序列5’-TGTTCCTCTTAATCCTGCCCA-3’,Adipoq 下游引物序列5’-CCAACCTGCACAAGTTCCCTT-3’;Fabp4 上游引物序列:5’-CCTTTGTGGGAACCTGGAA-3’,Fabp4 下游引物序列5’-CTGTCGTCTGCGGTGATT-3’;PPARγ 上游引物序列5’-GTGCCAGTTTCGATCCGTAGA-3’,PPARγ 下游引物序列5’-GGCCAGCATCGTGTAG-TGA-3’。
蛋白免疫印迹法检测用细胞裂解液裂解细胞和组织蛋白,BCA 法测定蛋白质浓度。将蛋白样品加入上样孔,进行聚丙烯酰胺凝胶电泳,再经过PVDF 膜湿转法转膜、5%脱脂牛奶封闭,在4 ℃冰箱中摇床上用特异性的一抗孵育,过夜。孵育与之对应的二抗,持续1 h。洗膜5 次后,用ECL 发光液发光显影。
油红O 染色称量0.5 g 油红O 粉末,溶于100 mL 异丙醇,摇床过夜摇匀后制备为贮存液。油红O贮存液与蒸馏水比例为3∶2混合摇匀,转速1 000×g,离心5 min,弃去管底沉淀,滤纸过滤3 次,制备成油红O 工作液。脂肪细胞诱导分化成熟后,将细胞弃去DMEM 培养液,用PBS 清洗2~3 次,3.7%甲醛固定细胞20 min 后用水清洗,每个3.5 cm 培养皿加入2 mL 油红O 工作液,染色2 h 以上。染色结束后用水清洗油红,每个培养皿中加入少量蒸馏水,镜下观察及拍照。
统计学处理所有数据使用GraphPad Prism 7.0 分析处理,数据分析均为两组结果之间相比较,采用非配对t检验。数据结果用表示。P<0.05 为差异有统计学意义。
结果
小鼠BAT 和WAT 及冷刺激后PAQR9 的mRNA水平变化取C57BL/6 雄性小鼠肩胛间区BAT、腹股沟皮下白色脂肪组织(inguinal WAT,iWAT)和附睾内脏白色脂肪组织(epididymal WAT,eWAT)用于实验研究(图1A)。检测以上不同位置脂肪组织中PAQR9 的mRNA 水平,发现BAT 中PAQR9 的mRNA 水平显著高于WAT(P<0.001,图1B),这提示PAQR9 可能在BAT 中发挥重要功能。同时,实验设计了3 种温度条件,分别是在4 ℃冷暴露(cold)、室温(RT)和30 ℃热中性(warm)环境下,检测发现,与室温条件相比,BAT 和iWAT 在冷刺激诱导下PAQR9 的mRNA 水平显著上调(BAT:P<0.001,iWAT:P<0.01,图 1C),而eWAT 在冷刺激诱导下PAQR9 的mRNA 水平变化不明显(图1C)。相较于室温条件,在冷刺激诱导下的iWAT 中提取出的成熟脂肪细胞中PAQR9 的mRNA 水平显著上调(P<0.001,图1D)。以上结果提示,PAQR9 在冷刺激诱导脂肪组织产热的过程中可能扮演重要角色。
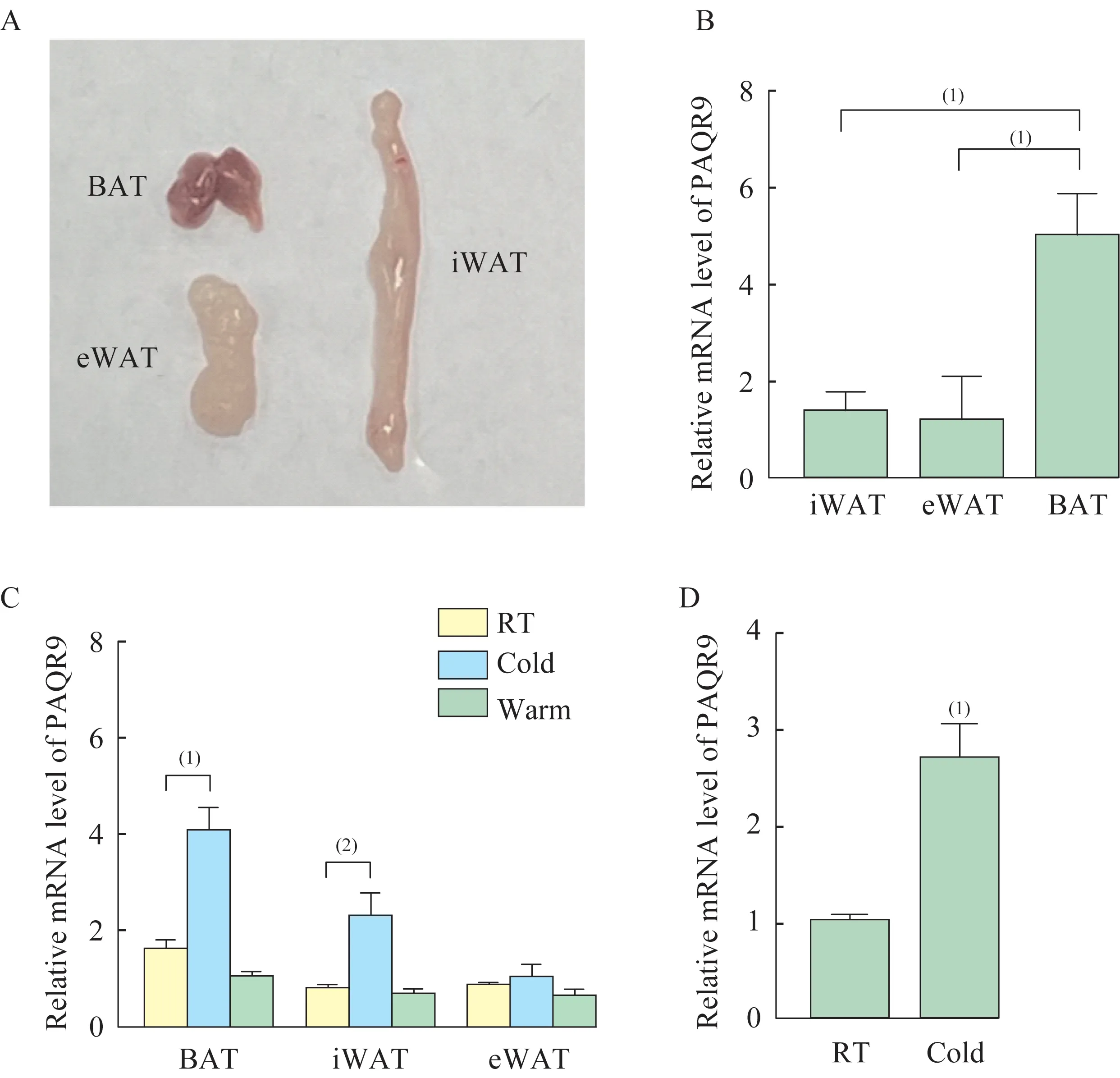
图1 小鼠BAT 和WAT 及冷刺激后PAQR9 的mRNA 水平变化Fig 1 The mRNA level of PAQR9 from BAT and iWAT from C57BL/6 mice after cold stimulation
DE2-3 细胞中过表达PAQR9 对成脂分化及产热基因UCP1 的影响将前棕色脂肪细胞系DE2-3通过标准法诱导分化为成熟棕色脂肪细胞。分别取第-2、0、2、4、6 天的细胞,检测PAQR9 的mRNA水平,发现第6 天时PAQR9 的mRNA 水平显著上调(P<0.001,图2A),推测PAQR9 在棕色脂肪细胞成脂分化过程中可能发挥功能。构建过表达PAQR9 的腺病毒感染DE2-3 细胞,成功过表达PAQR9(P<0.001,图2B)。过表达PAQR9 后,DE2-3 细胞中产热基因UCP1 的mRNA 水平显著上调(P<0.01,图2C)。通过液态氧电极测量氧气消耗量,发现过表达PAQR9 后耗氧量增加(P<0.01,图2D),说明过表达PAQR9 可以增加氧气的消耗,促进细胞代谢功能。同时,探究PAQR9 是否对细胞的成脂分化能力有影响。在成脂诱导分化后第7 天收取细胞样品,过表达PAQR9 病毒的实验组与过表达LacZ 病毒的对照组相比,成脂分化相关转录因子过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ,PPARγ)、脂联素(adiponectin/Adipoq)和脂肪酸结合蛋白4(fatty acid binding protein,FABP4)的mRNA 水平没有显著性差异(图2E)。对细胞进行油红O 染色,肉眼观察和镜下观察(比例尺50 μm)并拍照,发现两组细胞的油红染色率相当(图2F、2G)。说明过表达PAQR9 不影响DE2-3 细胞的成脂分化功能,可以促进细胞氧气消耗,使产热基因UCP1 的mRNA 水平升高。
DE2-3 细胞中敲低PAQR9 抑制产热基因UCP1的mRNA 水平将前棕色脂肪细胞系DE2-3 通过标准法诱导分化为成熟棕色脂肪细胞。设计了3 条siRNA 进行实验,成功将PAQR9 在DE2-3 细胞中敲低(P<0.001,图3A)。检测发现DE2-3 细胞在敲低PAQR9 之后UCP1 mRNA 水平显著下调(P<0.001,图3B)。
C3H10T1/2 细胞中敲低PAQR9 对成脂分化及产热基因UCP1 的影响间充质干细胞C3H10T1/2能够在诱导剂作用下分化为成熟脂肪细胞[14]。在C3H10T1/2 细胞培养过程中,取第0、2、4、6 天的细胞,检测发现在第4~6 天脂肪细胞分化成熟时PAQR9 的mRNA 水平显著上调(P<0.001,图4A)。设计了2 条siRNA,检测发现siPAQR9-2 将基因敲低,差异有统计学意义(P<0.05,图4B)。检测发现C3H10T1/2 细胞在敲低PAQR9 之后UCP1的蛋白质水平明显下调(图4C)。以上结果表明,敲低PAQR9 会抑制脂肪细胞产热基因UCP1 的mRNA 和蛋白质水平。对细胞进行油红O 染色,肉眼观察并拍照,发现两组细胞的油红染色率相当(图4D),说明敲低PAQR9 不影响C3H10T1/2 细胞的成脂分化功能。
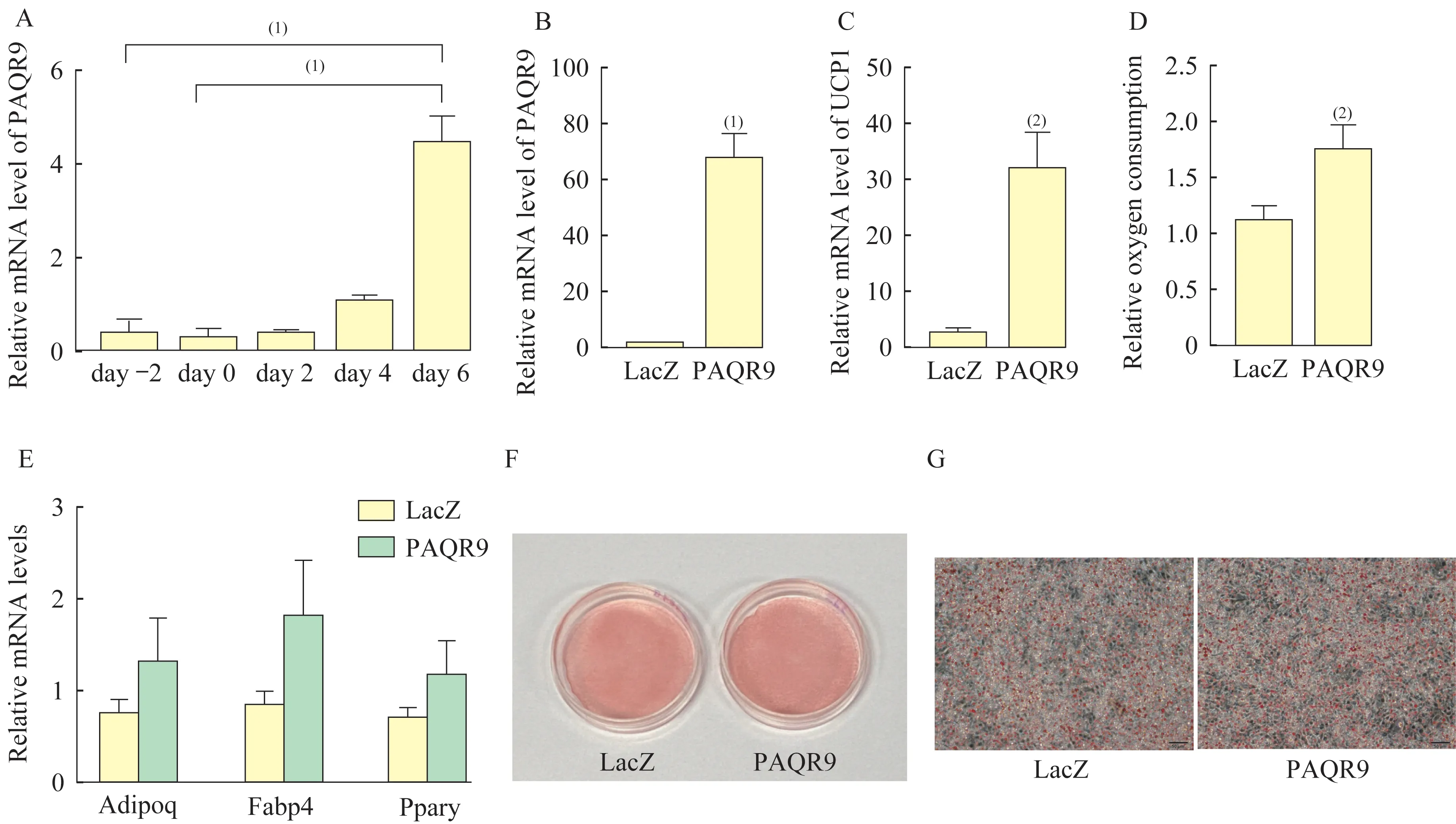
图2 DE2-3 细胞中过表达PAQR9 对成脂分化及产热基因UCP1 的影响Fig 2 The effect on adipogenesis and thermogenesis gene UCP1 after the overexpression of PAQR9 in DE2-3 cells

图3 DE2-3 细胞中敲低PAQR9 抑制产热基因UCP1 的mRNA 水平Fig 3 The mRNA level of thermogenesis gene UCP1 after knocking down PAQR9 in DE2-3 cells
讨论
随着生活水平提高、社会环境改变及遗传等多方面因素的影响,人们摄入体内的能量远远高于其消耗量,导致了能量不平衡[15],进一步诱发肥胖等疾病,给患者及其家庭和社会带来痛苦和沉重负担,已然成为科学界密切关注的问题。遗憾的是,传统的治疗方法效果不能令人满意[16]。

图4 C3H10T1/2 细胞中敲低PAQR9 对成脂分化及产热基因UCP1 的影响Fig 4 The effect on adipogenesis and thermogenesis gene UCP1 after knocking down PAQR9 in C3H10T1/2 cells
棕色脂肪细胞内存在多个小脂滴,含有大量线粒体,便于其吸收、利用葡萄糖和脂肪酸等能量供应物质[17]。通过细胞内线粒体中UCP1 将能量转化为热能,使机体内环境趋于稳态。正因为棕色脂肪具有产热功能,已然成为了当下治疗代谢性疾病的潜在靶点之一。米色脂肪则与传统的棕色脂肪来源不同,但它们都是产热性脂肪,能够在寒冷刺激等因素诱导下激活产热功能,具有消耗多余能量的潜力。产热性脂肪的功能调节成为了代谢领域的研究热点,科研人员试图以此为突破口筛选出能够促进产热功能的基因,开发出健康有效的新一代肥胖治疗方法[18]。
UCP1 是成熟棕色脂肪细胞的特异性标志物,同时也是白色脂肪棕色化激活的表现。在低温环境下,哺乳动物会发生颤栗,通过产热来维持体温恒定,而后会转变成利用棕色脂肪组织进行非颤栗性产热,线粒体内膜的UCP1 则是决定BAT 产热功能的关键因素。而在热中性条件下,无需额外消耗能量即可维持生理活动。冷暴露是一种非颤抖性产热的强刺激因子,实验经常在冷暴露诱导的条件下开展,探究激活产热脂肪发挥作用的机制[19]。
既往研究发现,6 周龄大小的C57BL/6 小鼠BAT 中Zfp516 的mRNA 水平显著高于WAT。相比于室温条件,在4 ℃冷暴露刺激下BAT 中的Zfp516 和UCP1 蛋白质水平显著上调,从而促进棕色脂肪产热[20]。还有文献报道,在4℃条件下BAT中JAK2 基因蛋白质水平上调,而在WAT 中变化不明显,且UCP1 的mRNA 水平和蛋白质水平都显著上调[21]。筛选出调控棕色脂肪产热功能的新型基因对于治疗肥胖等代谢性疾病具有深远意义。本课题组在前期实验中发现,在冷暴露诱导下腹股沟皮下WAT 中PAQR9 表达上调,结合前人的研究经验,我们推测PAQR9 可能在棕色脂肪产热过程中发挥着重要功能。PAQRs 共有11 个家族成员,具有7 次跨膜结构,特有1 个PFAM-UPF0073 结构域。该家族成员分为3 个亚群:PAQR1-PAQR4 属于脂联素受体,能够在葡萄糖摄取及脂肪酸代谢方面发挥调节作用;孕激素膜蛋白受体为PAQR5-PAQR9;此外,还有溶血素受体即PAQR10 和PAQR11[22]。PAQR 蛋白家族发挥着广泛的生物学功能,在细胞凋亡、脂肪酸氧化、性激素调控等方面发挥作用[23]。然而近年来对PAQR9 的研究非常少,仅有报道其在蛋白质质量控制方面的作用[24],其功能尚未被完全阐明,且在脂肪代谢领域未见报道。根据前期实验结果,我们推测PAQR9 可能在脂肪代谢产热过程中扮演一定角色,进一步探索将为治疗相关代谢性疾病提供新型靶标。
为了进一步探究PAQR9 基因在脂肪代谢产热过程中的作用,我们首先检测了肩胛间区BAT、iWAT 和eWAT 中PAQR9 的表达情况,发现其在BAT 中特异性高表达。与室温条件相比较,4 ℃冷暴露刺激后,BAT 和iWAT 中PAQR9 表达显著上调,在iWAT 中提取的成熟脂肪细胞中的结果与上述一致。由于冷刺激能够促进BAT 产热,以上结果提示脂肪产热过程中PAQR9 扮演着重要角色。
后续实验采用两种不同的细胞模型进行研究,首先将DE2-3 前棕色脂肪细胞系诱导分化为成熟棕色脂肪细胞,发现在分化第6 天脂肪细胞中PAQR9 显著性高表达,提示PAQR9 在棕色脂肪细胞的成脂分化过程中可能发挥作用。PPARγ 被认为是脂肪早期形成的关键调节剂,而脂联素(adiponectin/Adipoq)和FABP4 则负责成熟脂肪细胞的形成[25]。于是通过实时荧光定量PCR 技术检测以上成脂相关转录因子的mRNA 水平,结合油红O 染色法检测发现过表达PAQR9 后DE2-3 细胞的成脂分化能力无明显变化。在DE2-3 细胞中成功过表达PAQR9,检测发现标志性产热基因UCP1 的mRNA 水平显著上调。细胞耗氧量的检测是研究细胞代谢及其功能的一项重要指标,液态氧电极法检测发现PAQR9 上调可以促进氧气消耗,促进细胞代谢。在DE2-3 细胞中敲低PAQR9 后,UCP1 的mRNA 水平显著下调。
以C3H10T1/2 细胞为研究模型,检测发现在第4~6 天脂肪细胞分化成熟时PAQR9 的mRNA 表达显著上调。敲低PAQR9 之后UCP1 蛋白质水平明显下调。敲低PAQR9 后脂肪细胞的成脂分化无明显变化。以上结果表明,在C3H10T1/2 细胞中敲低PAQR9 会抑制产热基因UCP1 的表达。
本研究发现,PAQR9 能够促进棕色脂肪细胞产热,调控产热基因UCP1 的表达,为PAQR9 在脂肪代谢领域的研究提供了思路,为治疗肥胖等疾病提供更多理论依据,为研发新型减肥药带来了重大突破。未来可以进一步开展动物实验研究,进一步研究和探讨PAQR9 的作用通路及机制等问题。
