Fenton氧化技术处理印染废水的研究
2020-12-11何忠坤陈韦达张雷雨
何忠坤 陈韦达 张雷雨
(广州机械设计研究所,广州 510600)
近年来,纺织染料工业快速发展,其产生的废水已成为重要的水体污染源。据统计,我国纺织印染废水每年排放量高达20~30亿吨,在工业废水中占据很高比例[1]。印染废水污染物浓度高,成分复杂,具有COD高,可生化性差,颜色深等特点[2]。另外随着印染行业工艺不断改进,添加的新型助剂进一步加大了废水处理难度[3]。目前针对印染废水的处理技术包括物理法、化学法、生物法三大类,物理法包括吸附法[4]、膜分离法[5]、磁分离法[6]等,化学法包括高级氧化法[7]、电化学法[8]、混凝沉淀法[9]等,生物法包括好氧生物处理技术[10]、厌氧生物处理技术[11]、厌氧-好氧生物处理技术[12]等。
Fenton氧化是指在强酸的体系中,加入一定量的过氧化氢(H2O2)和亚铁离子(Fe2+),Fe2+催化H2O2产生具有强氧化性的羟基自由基(氧化还原电位E0=2.73V),可以氧化废水中的有机物。其原理如下:
Fe2++H2O2+H+→Fe3++·OH+H2O
(1)
利用Fenton法降解印染废水的试验已被多名学者研究过[7,13-15],但较少关于该体系降解原理的介绍。本研究以实际印染废水为处理对象,COD为考察指标,探讨初始pH值、FeSO4投加量、H2O2投加量、反应时间等因素对印染废水氧化效果的影响,深入解释各单因素影响Fenton体系的原理和规律,为印染废水的工程处理提供科学依据。
1 材料与方法
1.1 实验材料
1.1.1 实验药品
硫酸亚铁(FeSO4·7H2O)、30%双氧水(H2O2)、氢氧化钠(NaOH)、硫酸(H2SO4)等,各物质均为分析纯,溶液均由超纯水配置。
1.1.2 仪器设备
超纯水系统(arium mini,德国赛多利斯)、数显六联磁力搅拌器(HJ-6数控,常州澳华仪器有限公司)、pH酸度计(PHS-3C,上海雷磁仪器厂)、数字式消解器(DRB200,美国哈希HACH)、可见光分光光度计(DR3900,美国哈希HACH)、电子天平(BAS224S,德国赛多利斯)。
1.1.3 实验废水
实验所用废水属于工业废水,取自于东莞市某环保基地,呈深黑色,中性,pH为7.34,COD质量浓度为1 465 mg/L。
1.2 实验方法
室温下,取印染废水100 mL于250 mL烧杯中,调节至所需pH值,投加一定量的FeSO4后快速搅拌,滴加一定量的H2O2,搅拌,反应一段时间后加入NaOH溶液至碱性,终止反应,测定上清液中COD浓度。
1.3 分析方法
COD采用重铬酸钾法,通过哈希DR3900光度计测定。
2 结果与分析
2.1 初始pH对COD去除率的影响
确定实验条件:30%H2O2为0.81 mL、FeSO4为1 mmol、反应时间120 min,调节初始pH为2、3、4、5、6、7,探讨反应体系中不同初始pH对COD去除率的影响,结果如图1所示。
从图1可知,COD去除率受pH变化影响显著,总体而言随pH的增大,COD去除率呈先增大后下降的趋势,在初始pH为3时去除效果最佳,COD去除率可达87.34%。这可能是由于当pH为3.0时,反应中产生更多的·OH,提高有机物的去除率。研究表明[16-17],Fenton反应的最佳pH为3左右,本实验与其研究结果一致。当pH较低时,Fe2+主要以[Fe(Ⅱ)(H2O)6]2+形式存在,其催化H2O2产生羟基自由基的能力较[Fe(Ⅱ)(OH)(H2O)5]+弱[18],因此·OH产生量少。而pH过高时,COD去除率下降明显。其原因主要为随着pH的增大,H+浓度下降会抑制H2O2分解产生·OH。与此同时,过高的初始pH值会促进H2O2自身分解成H2O和O2,减少·OH的生成量[19],另外溶液中的Fe2+容易以氢氧化物的形式发生沉淀而失去催化能力[20]。
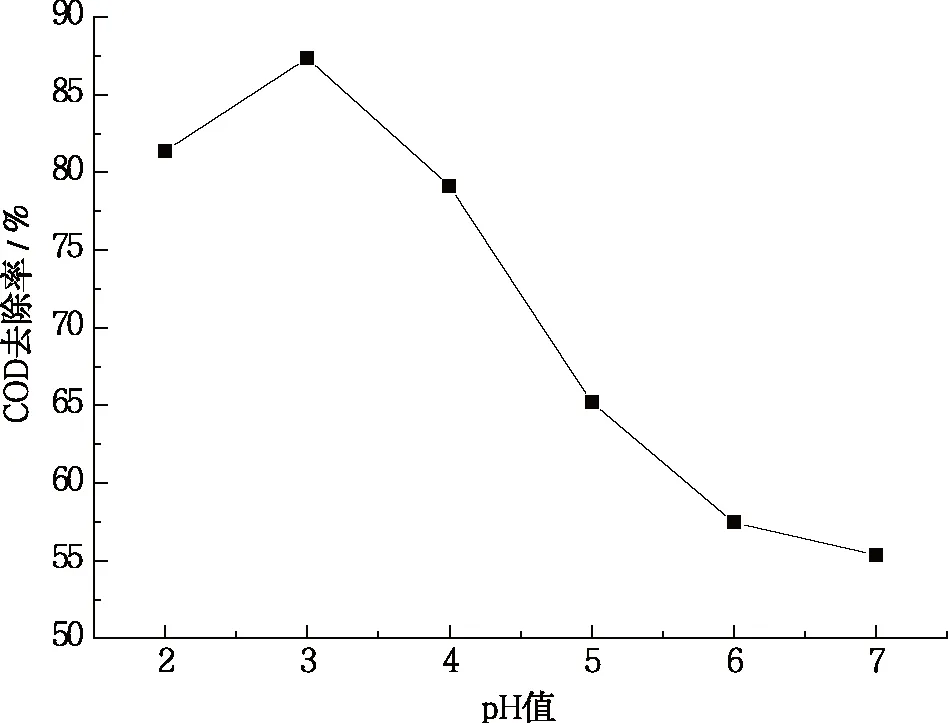
图1 初始pH对COD去除率的影响
2.2 H2O2投加量对COD去除率的影响
确定实验条件:pH为3、FeSO4为1 mmol、反应时间120 min,调节30%H2O2为0.09 mL、0.27 mL、0.45 mL、0.63 mL、0.81 mL、0.99 mL、1.17 mL,探讨反应体系中H2O2投加量对COD去除率的影响,结果如图2所示。
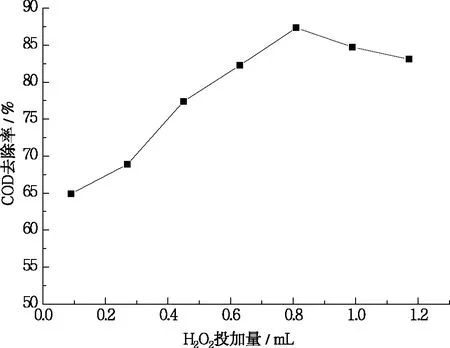
图2 H2O2投加量对COD去除率的影响
由图2可知,反应体系对COD的去除率随着H2O2投加量的增大先升高后缓慢下降,当H2O2投加量为0.81mL时,COD的去除率达到最佳,此时去除率为87.34%。当H2O2浓度较低时,随着H2O2投加量的增加,新生·OH浓度不断上升,Fenton体系中氧化能力显著增强,因此COD的去除率不断上升;而过高的H2O2投加量会导致·OH相互结合产生HO2·[21],见式(2),过剩的氧化剂充当了自由基的清扫剂,从而削弱了自由基与有机物的反应,同时体系中过量的H2O2迅速将Fe2+氧化成Fe3+,既消耗H2O2也抑制·OH的生成,进而降低反应效率。
H2O2+·OH→H2O+HO2·
(2)
2.3 FeSO4投加量对COD去除率的影响
确定实验条件:pH为3、H2O2为0.81 mL、反应时间120 min,调节FeSO4为0.4 mmol、0.6 mmol、0.8 mmol、1.0 mmol、1.2 mmol、1.4 mmol,探讨反应体系中FeSO4投加量对COD去除率的影响,结果如图3所示。
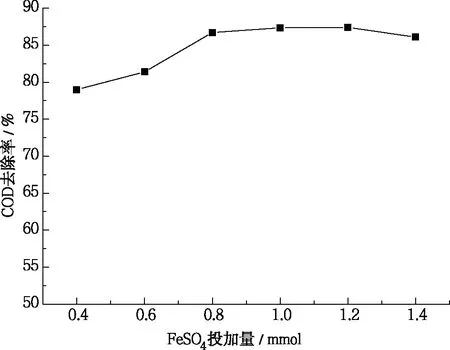
图3 FeSO4投加量对COD去除率的影响
从图3可知,随着FeSO4投加量的增加,COD的去除率也随之增大,当FeSO4为1 mmol时,COD去除率达到最大值,继续增加FeSO4投加量,去除率反而略有下降。其主要原因是, FeSO4一方面作为Fenton反应的催化剂,其加入量的多少直接影响着·OH的产生量和产生速率,另一方面,在水解过程中形成的Fe2+、Fe3+络合物能与废水中的胶体颗粒絮凝沉淀,可有效去除废水中的有机物。当Fe2+浓度过低时,·OH 的产生量和产生速率都很小,有机物降解过程受到抑制;随着 Fe2+浓度的增大, Fe2+与 H2O2充分反应产生大量的·OH,将水中有机物氧化降解,同时铁盐的增加也强化了混凝沉淀作用。继续加大FeSO4加入量,COD去除率升高缓慢甚至下降,这是因为多余的Fe2+和 H2O2反应产生的Fe3+较 Fe2+催化效果减弱[22],同时过多的Fe2+还会和·OH 反应消耗·OH 的量[23],从而对自由基产生猝灭作用(见公式3-5)。
Fe2++H2O2→Fe3++·OH+OH-
(3)
Fe3++H2O2→HO2·+Fe2++H+
(4)
Fe2++·OH→Fe3++OH-
(5)
2.4 反应时间对COD去除率的影响
确定实验条件:pH为3、H2O2为0.81 mL、FeSO4为1 mmol,调节反应时间为30 min、60 min、90 min、120 min、150 min、180 min ,探讨反应体系中时间对COD去除率的影响,结果如图4所示。
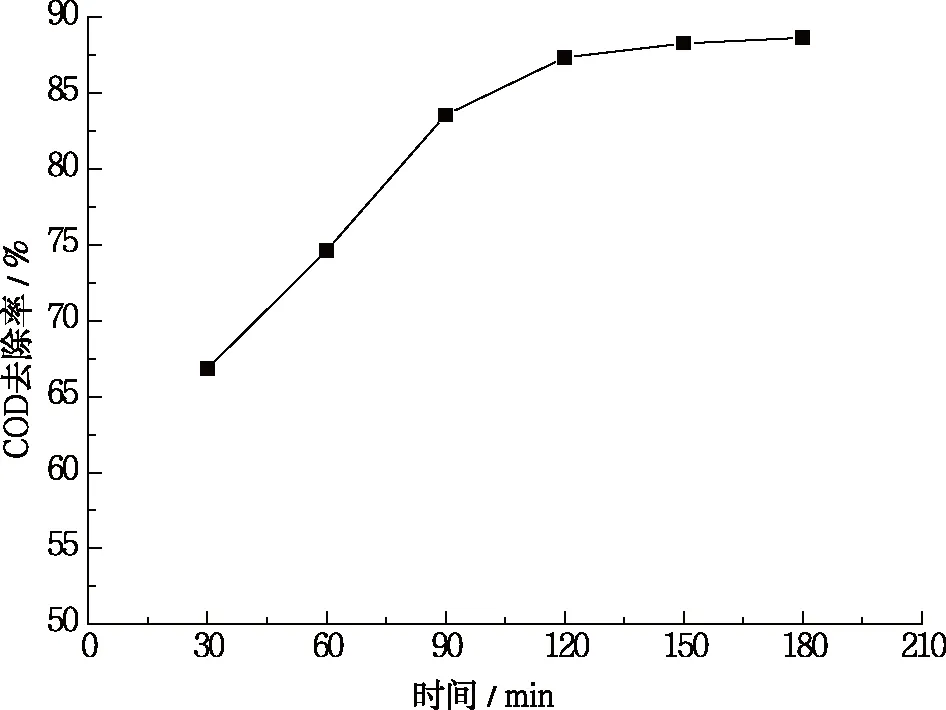
图4 反应时间对COD去除率的影响
从图4可知,随着反应时间的增加,COD去除率呈现先快速增加到最大值后基本保持稳定的趋势。在反应初始阶段,Fenton反应的速度非常快,COD去除率在前120 min 内随反应时间的增加而快速提高,这是由于在适宜的实验条件下,系统中产生足够多的·OH,氧化能力因而也较强;当反应时间为 120 min 时,COD去除率基本达到最大值,去除率为87.34%,继续延长反应时间,COD 去除率基本保持稳定,这说明 Fenton 反应在前 120 min 反应已完成,系统中产生的·OH逐渐减少,反应速率变慢,过多的延长反应时间已没有意义。综合考虑处理效果和能耗,选择 120 min 为 Fenton试剂的最佳反应时间。
2.5 处理前后印染废水表观形态
从图5中可看出,印染废水原水呈深黑色,较为浑浊,具有大量的微小颗粒;Fenton反应后废水出现了明显的分层现象,上清液清澈透明,下层絮体颗粒较大。

图5 印染废水处理前后对比照片
3 结论
(1)利用Fenton高级氧化法降解印染废水效果明显,COD去除率受Fenton试剂H2O2和FeSO4浓度、初始pH、反应时间影响显著,高于或低于最佳反应条件,均会造成去除率的降低。
(2)确定Fenton氧化处理本实验废水的最佳反应条件为:初始pH为3、H2O2为0.81 mL、FeSO4为1 mmol、反应时间120 min,此时COD去除率为87.34%。
