分析化学实验室常见重金属废液处理
2020-12-10杨繁山东省冶金科学研究院有限公司山东济南250014
杨繁(山东省冶金科学研究院有限公司,山东 济南 250014)
1 分析化学实验室对常见重金属废液的处理现状
随着经济的发展,涉及到化学专业的实验室数量越来越多,并且伴随着高端化工科技的发展,参与到化学专业实验中的科研人员也是越来越多,随之而来的就是化学实验室使用频率以及规模的上升,化学实验室在使用过程中所产生的重金属废液的数量也在不断的增加。如果不对重金属废液进行处理就直接进行排放,那么会对附近的环境产生不可挽回的负面影响。笔者在本文的研究中将会以《水综合排放标准》作为研究的参照物。就相关的调查结果来看,化学实验室重金属废液处理的情况并不乐观,在参与到调查的40所化学实验室中,仅仅只有10所化学实验室重金属废液的处理达到了国家要求的标准,而剩下的30所化学实验室对于重金属废液的处理或多或少存在一些问题,甚至有的化学实验室根本没有对重金属废液进行处理而是选择直接排放,在笔者调研的过程中,有一部分化学实验室进行科研的过程中,并没有按照相关规定进行实验操作,操作方法也很不科学。从以上几点不难看出,在实际的化学实验进行试验过程中的步骤并不规范,并且也没有对重金属废液的处理提起足够的重视,如果对重金属废液的处理不够及时与彻底,那么会对排入水体周边的环境产生非常大的负面影响[1]。
2 废液处理方案
2.1 含锰废液的处理
在进行基础化学实验的过程中会进行大量的高锰酸钾作氧化剂的使用,这种大规模的试验最终会造成大量含锰废液地产生。如果此类重金属废液不经过处理酒精性排放的话,有可能会伴随着水体应用水的产生而进入到人体中来,对人们的神经系统产生危害。我国有关部门通过污水综合排放标准对锰废液的排放标准进行了规定,以此来保证含锰废液的排放不会对周围的生态环境产生较大的影响,规定中总锰的一级排放标准为2.0mg/L。为了能够保证此次试验的进行,本次含锰废液处理的原料来自于“硫酸亚铁铵制备与纯度测定”实验中,在该废液中Mn2+的浓度经过测量达到了0.05mol/L(2750mg/L)。
(1)含锰废液处理原理:本实验所使用的是碱化除锰法来对含锰废液进行处理,将准备好的碱投入到已经搅拌均匀的含锰废液中,并且将废液的pH稳定到碱性,在这个过程中含锰废液中的Mn2+就将转化成为Mn(OH)2,由此为基础在溶解氧的作用之下Mn(OH)2也会被迅速的氧化从而生产稳定的难溶物MnO2,通过此方法就可以实现将Mn2+去除的目标。
(2) 实验室含锰废液具体处理方法:根据上文的论述,我们需要准备好碱以及待处理的含锰废液。首先需要向含锰废液中进行碱的加入,通过此项操作能够将含锰废液的pH调整成为>11.0,并且使用材料将其搅拌均匀进行静置过夜处理,将容器中的沉淀物进行过滤将其进行保存,将所得到的滤液使用高碘酸钾分光光度法进行检查,达到国家要求的标准之后才可进行排放。详细情况如图1所示。
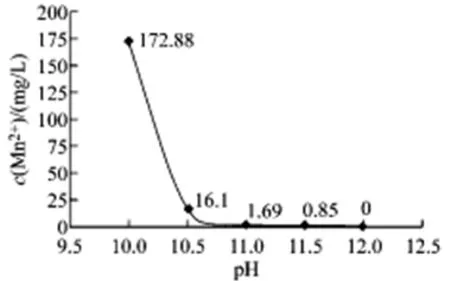
图1 pH对Mn2+去除的影响
从理论上来讲当所处理的含锰废液pH达到10.0数值左右的情况时,溶液中Mn2+就能够完全形成Mn(OH)2然后进行过夜沉淀。不过,当含锰废液中存在着NH4+浓度过高情况时,那么会产生一部分Mn(OH)2会溶解在铵盐溶液中。通过实验结果也显示,含锰废液当出现包含有铵盐的情况时,并且溶液的pH<11.0时,那么将会出现过夜静置沉淀不完全的情况,滤液中的锰含量超过了投放标准;但是当pH≥11.0的时候,能够使废液达到排放的标准。针对此种情况,建议化学实验室在进行对含锰废液碱处理的过程中应当适时记得进行pH值的调高,保证过夜沉淀能够完全将含锰废液过滤完全,进一步避免出现含锰废液处理不能够达到排放标准的情况[2]。
2.2 含铅、铋混合废液的处理
通过络合滴定法连的使用对混合液中的Pb2+以及Bi3+进行连续的测定是现阶段较为常见的化学实验,并且该试验广泛的应用于化学实验中,并且此项实验进行的规模以及次数非常多,必定会产生大量的铅铋混合废液。铅自身是属于剧毒的重金属之一,除此之外铋盐因为自身储量较小的原因,在采购的时候价格较贵。如果含铅、铋的重金属废液不经过处理就直接排放,仅仅有可能会对人体产生危害,还会浪费宝贵的铋金属资源。针对此种情况,在实验室进行实验之后有必要对含铅、铋的金属废液进行无害化处理以及资源回收处理。
首先,含铅、铋重金属废液处理原理。在处理的过程中向混合金属废液中进行过量的Na2S,由此可以获得黑色PbS以及Bi2S3的沉淀物。对所得到的沉淀物进行分离以及水洗的处理,利用硝酸对其进行价格使其消融,对于不溶物进行去除之后稀释到一定的体积,就可投入到循环使用中来。
其次,含铅、铋重金属废液处理具体方法。在化学实验完成之后提取3000mL铅铋混合废液对其进行加热处理,直至废液达到沸腾状态,对沸腾的金属废液进行搅拌处理然后加入2mol/LNa2S溶液将金属废液的pH值稳定在12.0~13.0的范围区间之内,为了能够进一步提升絮凝沉降的速度,可以向废液中进行微量的明矾水溶液加入,将金属废液搅拌均匀之后进行静置处理,经过12小时的静置处理基本上能够实现自身杂质的沉淀。因为上清液中有着二甲酚橙指示剂的存在,所以导致自身在pH值为碱性的环境中将会呈现出紫红色的状态。将上清液倾倒在新的容器中,使用氧化除硫进行处理之后可以排放。在此基础上每次都使用1000mL左右的自来水来进行清洗,自来水的清洗所使用的方法为倾泻法,清洗地次数为3次,根据清洗的实际情况可以进行次数的增加,直至沉淀物消失不见,以此为基础可以选择少量的去离子水进行清洗,清洗的次数为2次,这样就能够保证硫化物沉淀以及水的体积在300mL左右,然后对其进行30mL浓HNO3的加入,然后通过加入处理使得黑色硫化物产生溶解。保持加热煮沸的状态2min,以此可以达到去除氮氧化合物的目的。带溶液冷却之后对其进行过滤处理,去除溶液中的不溶物,然后将所得滤液稀释到1000mL,以上所有的操作都应当在通风柜中进行。
通过该种处理方法的应用可以保证Pb2+以及Bi3+的回收率稳定在90%以上。含铅、铋的混合溶液pH基本上可以稳定在1左右,该PH正好符合EDTA滴定Bi3+所需要的PH数值,该种情况就没有必要进行氢氧化钠的中和处理,可以在研究人员进行下一次实验的过程中直接投入使用,能够有效地进行资源循环使用,节省实验成本。值得一提的是如果在絮凝沉淀过程中加入了微量明矾溶液做絮凝剂,溶剂中就会有Al3+的产生,这种情况会在一定程度上影响含铅、铋废液的循环使用,主要的原因是Al3+能够与EDTA络合物的lgK(lgK=16.1)以及Pb2+和EDTA络合物的lgK(lgK=18.0)数值上相接近,会对试验最终的测试结果产生轻微的影响,虽然总体升数值偏差不明显,但是会与正确数值产生偏差,那么在进行实验之前,可以选择滴入一滴0.1mol/L的氟化铵溶液来消除铝离子对最终测定结果的干扰。
2.3 含银废液处理
实验室中所产生的大量含银废液的两个实验分别是:“佛尔哈德法测定银盐中银含量”以及“莫尔法测定氯化物中氯含量”,并且同样是属于基础化学部分,会在化学实验过程中大规模应用。如果不对含银废液进行处理就进行排放不仅仅会浪费大量的贵重金属,还会对水体附近的环境产生恶劣影响。针对此种情况,我们应当在试验的过程中对含银废液进行定期的集中处理,所回收的金属银可以进行循环配置液的使用。可以根据含银废液产生的途径来选择针对性处理方法,银含量测定实验产生的含银废液可采用沉淀灼烧法,氯含量测定实验产生的含银废液可采用抗坏血酸还原法[3]。
2.3.1 含银废液处理原理
沉淀灼烧法,使用硫化银沉淀的KSP非常小这一性质,可以将含银废液和AgSCN沉淀中Ag+整体转移到Ag2S的沉淀中来,然后使用高温灼烧的方法来对沉淀进行处理,就可以得到银单质。
抗坏血酸还原法,使用AgCl沉淀与浓氨水产生反应,然后生成银氨溶液,在此基础上再使用抗坏血酸使其发生氧化反应,可以得到银单质。
2.3.2 含银废液实验室处理方法
可以对含银废液中加入过量的硫化钠固体,搅拌均匀之后进行静置处理,对所得到的上清液进行硫化处理之后进行排放,对所得到的沉淀进行酸洗以及水洗的处理,对其进行抽滤处理然后保留沉淀,对沉淀需要进行烘干处理。可以将马弗炉温度设定在1050~1100℃范围区间内,进行一个小时的高温灼烧就可以获得银单质,使用浓硝酸溶解之后即可投入到循环使用中来,大幅度的避免实验室废液处理出现浪费的情况[4]。
3 结语
在化学实验室进行科研的过程中难免会有重金属废液的产生,并且因为重金属废液的特殊性不便于交付于特定部门进行集中处理,这样会无形中增加重金属废液的处理成本,传统的处理方法虽然能够使重金属废液达到国家排放的标准,但是在这个过程中所产生的固体废物仍会对周围环境产生影响。如果实验室在有条件的情况下,可以利用计算机技术进行仿真试验,因其自身具有独特的优势,能够更加形象、生动地展现试验效果,并且可以反复进行,非常有助于实验材料的节约,避免大量重金属废液的产生。
