橡胶树产胶生物学研究进展
2020-12-09唐朝荣
唐朝荣

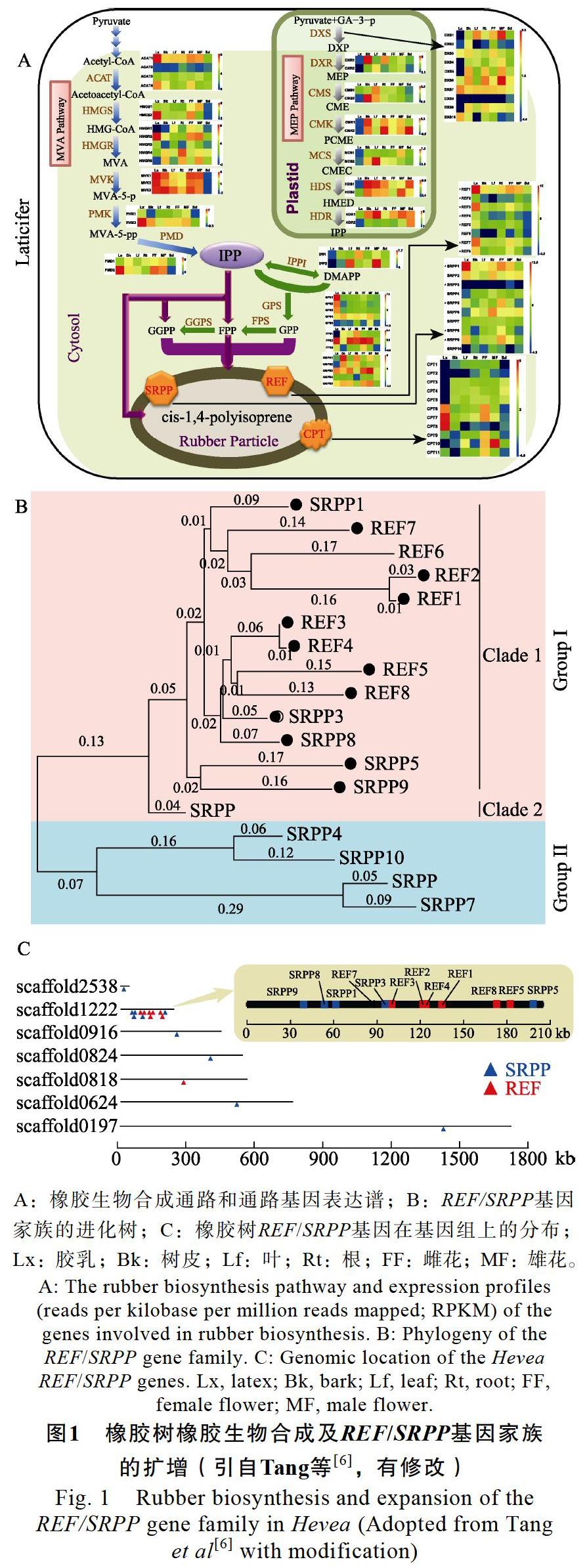
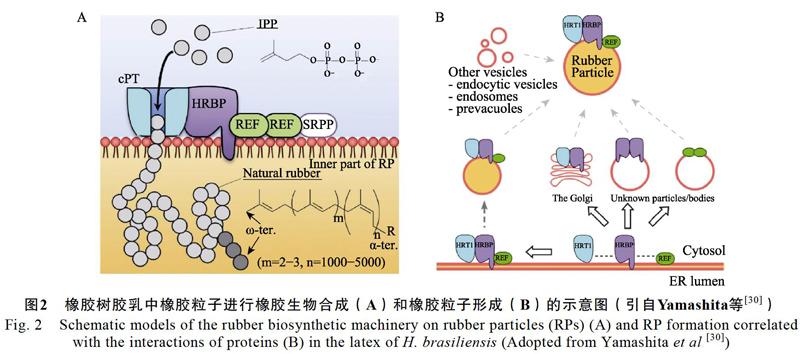
摘 要:天然橡胶(顺式-1,4-聚异戊二烯)是一种重要的工业原料,主要来自橡胶树。以天然橡胶的生物合成与产量形成为主要内容的产胶生物学研究为橡胶树高产遗传改良提供理论指导,近10年取得了重要進展。本文从橡胶树基因组测序、橡胶转移酶、转基因、以及转录组和蛋白质组等4个方面介绍产胶生物学研究主要进展,并讨论了相关领域研究存在的问题,对未来5~10年需重点关注的研究内容提出了建议。在介绍橡胶转移酶时,同时概述其他几种产胶植物的相关研究进展。
关键词:橡胶树;产胶生物学;基因组测序;橡胶转移酶
中图分类号:S794.1 文献标识码:A
Abstract: Natural rubber (cis-1, 4-polyisoprene) is an important industrial raw material, commercially harvested mainly from rubber tree (Hevea brasiliensis). Important progresses have been made in the past decade on Hevea biology of rubber production, focusing on rubber biosynthesis and latex production. The present review summarized the major progress in four research areas with relation to rubber production, i.e. Hevea genome sequencing, rubber transferase, transgenic research, and transcriptomics & proteomics. Moreover, the problems were discussed and a few of research emphasis in the next 5 to 10 years were proposed. When describing the studies of rubber transferase, the recent progress in several other rubber-producing plants were included.
Keywords: Hevea brasiliensis (para rubber tree); biology of rubber production; genome sequencing; rubber transferase
DOI: 10.3969/j.issn.1000-2561.2020.10.003
天然橡胶是一种重要的工业原料,在交通运输、医疗卫生、国防军工等领域应用广泛,其优异的综合性能迄今仍无法被人工合成橡胶完全替代[1]。我国是世界最大的天然橡胶消费国,年消费量(约550万t)约占世界天然橡胶总产量(约1400万t)的40%,但自给率仅约15%[2]。目前,天然橡胶的商业来源几乎全部来自巴西橡胶树这一个热带树种,无论是理论预测[3]或是生产上超高产橡胶树单株的发现[4]都显示橡胶树的产胶潜力巨大,可在现有最高产橡胶树品种单产水平(年产约2500 kg/hm2)的基础上提升3~5倍。产胶生物学基础研究,将为橡胶树高产分子育种提供理论依据与靶标基因。
近10年,随着高通量、低成本的二代和三代测序技术以及蛋白质组学技术的飞速发展,橡胶树产胶生物学研究取得了显著进展。本文从橡胶树基因组、橡胶转移酶、转基因以及转录组和蛋白质组学等4个方向介绍产胶生物研究领域的主要进展,并对该研究领域存在的问题和发展方向提出了思考,以期增进研究者对本领域发展现状和未来工作重点的了解。
1 橡胶树基因组测序研究
2013年,马来西亚研究者公布了第一个橡胶树基因组[5],此后包含笔者团队在内的不同研究者又陆续报道了4个版本[6-9](表1)。从拼接质量上看,笔者团队在2016年发表的版本[6]仅次于最近以三代测序为主完成的版本[9],但明显优于其他3个同样以二代测序技术为主的版本(表1)[10]。从对产胶生物学问题的阐述上看,笔者团队发现了橡胶树物种高产橡胶的遗传线索、提出乙烯刺激产胶新机制等重要产胶生物学问题[6],是迄今最受关注和认可的橡胶树基因组版本。
1.1 橡胶树基因组的大小
最早基于孚尔根染色微密度测定法(Feulgen microdensitometry)测定橡胶树基因组的大小为2.15 Gb[11],而笔者团队用二代测序k-mer分析法估算橡胶树‘热研7-33-97等6个品种的基因组大小在1.41~1.55 Gb之间[6],这与53份橡胶树栽培种质基因组大小的流式细胞分析结果(1.46~1.60 Gb, 平均1.53 Gb)[12]一致。结合几个较高质量橡胶树基因组的实际拼接大小[6-9](表1),我们认为橡胶树这个物种基因组的大小应为1.5 Gb左右。
1.2 橡胶生物合成单体IPP的来源
在橡胶树的产胶细胞乳管中存在2种异戊烯基焦磷酸(IPP)的合成途径,即细胞质胞浆的甲羟戊酸途径(MVA)和质体的2-C-甲基-D-赤藓糖醇-4-磷酸途径(MEP)。多数研究认为MVA途径可能是橡胶生物合成单体IPP的主要来源[13],但MEP途径是否参与橡胶生物合成长期存在争议[14-15]。
笔者团队在橡胶树基因组中鉴定到18个MVA和22个MEP途径家族基因(图1A)。组织表达分析发现,MVA途径的6个催化酶中都至少有1个在胶乳(乳管细胞的细胞质)中特异高表达的基因,而MEP途径中仅DXS有2个编码基因在胶乳中的表达量相对较高,其他6个酶的编码基因在胶乳中表达量很低或明显低于其他组织。这些结果表明,MVA途径是橡胶树中橡胶生物合成IPP的主要来源,MEP途径可能对橡胶生物合成的贡献很小。
1.3 橡胶树高产橡胶的遗传线索
在已知的2500余种产胶植物中,为何橡胶树具有优异的产胶能力,笔者团队从基因组研究上获得了科学线索。
通过与其他17种植物基因组比较,我们发现橡胶树中橡胶延伸因子/小橡胶粒子蛋白(REF/ SRPP)基因家族发生了显著扩增,共有18个基因,数目远高于其他植物[6],类似发现在另外2个关于橡胶树基因组的研究[7, 9]中也有报道。在橡胶树基因组上,有12个REF/SRPP基因形成一个跨度约160 kb的基因簇,并且在胶乳中特异高表达的4个基因(REF1、SRPP1、REF3和REF7)都在这个基因簇上;从进化关系上看,胶乳中表达量最高的REF1基因可能是由表达量较低的REF/SRPP基因逐步进化而来(图1)。从蛋白序
列比对结果来看,REF1类似于一个C-端被截断的SRPP1(胶乳表达量仅次于REF1基因)。有趣的是,仅在橡胶树中存在与REF1编码蛋白(138 aa)大小相当的REF/SRPP基因,而其他植物中只有编码大小与SRPP1(204 aa)相当或更大的REF/SRPP蛋白。
按粒径尺寸将橡胶粒子分为大(>400 nm)、小(<400 nm)两类,虽然大橡胶粒子的数目只占胶乳中橡胶粒子总数的6%,却贡献了93%的橡胶产量[16]。SRPP和REF在橡胶粒子上的分布模式存在明显差异,SRPP主要位于小橡胶粒子膜的表面,而REF主要镶嵌在大橡胶粒子的膜中[17]。综合上述结果,我们推测REF/SRPP基因家族的显著扩增和乳管特异性功能分化,特别是乳管中超高表达特异REF1的出现可能是橡胶树进化出优异高产橡胶性状的根本原因,这种性状有利于橡胶树在热带丛林中抵御蛀食性害虫的侵害[18]。
1.4 乙烯刺激橡胶树产胶的新机制
在橡胶树的树干上涂抹乙烯利(2-氯乙基磷酸,乙烯释放剂)或直接施用气体乙烯可刺激橡胶树排胶、显著提高胶乳产量,是橡胶树生产上的一项重要增产措施[18]。在过去40多年中,国内外发表了大量关于乙烯刺激橡胶树胶乳产生机制的论文,发现乙烯处理增强了乳管细胞中蔗糖的吸收和降解[19-22]、促进水分吸收[23]和能量代谢[24]、导致胞浆pH碱性化[24]、促进氮同化[25]和引起防御应答[26]等,这些过程与胶乳再生或胶乳排出直接或间接相关,但都未能从根本上回答乙烯处理能显著刺激橡胶树乳管产胶的原因。
利用RNAseq深度测序,笔者团队共鉴定出500多个受乙烯调控的胶乳差异表达基因。进一步分析发现,乙烯合成关键酶ACO家族基因在胶乳中不表达或表达量极低[6],结合胶乳中氧含量低[19]和ACO催化ACC氧化产生乙烯时需要氧气的事实,推测橡胶树乳管细胞中的乙烯合成能力很弱;同时,胶乳中乙烯信号传递和应答通路中的多个关键基因,包括4个ETR、2个EIN2和1个EIL1基因受乙烯刺激后显著上调表达[6],表明乳管细胞中存在活跃的乙烯信号传递与应答通路。这一发现,从源头上回答了在橡胶树上使用外源乙烯刺激可显著刺激胶乳增产的根本原因。
2 橡胶转移酶研究
1969年Archer等[27]将催化橡胶生物合成的酶称为橡胶转移酶(rubber transferase),其催化橡胶生物合成单体IPP逐个掺入到不断延伸的橡胶烃(顺式-1,4-聚异戊二烯)上,分布在胶乳的水相和橡胶粒子上。此后至今的50余年,人们对橡胶转移酶的生化、分子特性和调控机制的认识不断深入,特别是在2015—2016年出现了突破性进展。研究者分别以莴苣[28]、短角蒲公英[29]和橡胶树[30]这3种产胶植物为研究对象,发现橡胶转移酶不是一种单一蛋白,而是以顺式异戊烯基转移酶(cis-prenyl-transferase, CPT)为核心,并包含CPT结合蛋白(一种人NogoB受体类似蛋白,也称CPT类似蛋白、橡胶转移酶活化剂)、橡胶延伸因子(rubber elongation factor,REF)和小橡胶粒子蛋白(small rubber particle protein,SRPP)等多種蛋白组分,定位在橡胶粒子上催化橡胶烃大分子合成的一种复杂的蛋白复合体[31]。
2.1 顺式异戊烯基转移酶
1989年,Light等[32]报道从橡胶树胶乳中纯化了橡胶转移酶,在橡胶粒子存在时可催化橡胶烃的合成,在无橡胶粒子但有二甲基烯丙基焦磷酸(DMAPP)存在时可催化合成牻牛儿基焦磷酸(GPP)和法尼基焦磷酸(FPP)。但Cornish[33]随后的研究发现Light等纯化的不是橡胶转移酶,而是在胶乳中催化橡胶合成起始分子FPP的可溶性反式异戊烯基转移酶,真正的橡胶转移酶是与橡胶粒子密切结合的顺式异戊烯基转移酶(CPT)。Asawatreratanakul等[34]首先克隆了2个在橡胶树胶乳中特异表达的CPT基因(HRT1和HRT2),其中原核表达的HRT2重组蛋白在胶乳离心洗涤后的底层颗粒存在时可催化合成橡胶大分子。Takahashi等[35]在酵母和拟南芥细胞中表达HRT1和HRT2基因,但发现HRT重组蛋白并不能催化生成橡胶大分子,推测橡胶转移酶活性需要一些特定的胶乳成分。Post等[36]证明短角蒲公英中乳管特异表达的CPT是橡胶生物合成所必需的,相关基因经RNAi沉默后,胶乳中的橡胶含量减低90%以上。利用蛋白质组学分析,Dai等[37]从橡胶树胶乳的橡胶粒子上鉴定到6个CPT蛋白,证实了早期关于CPT与橡胶粒子紧密结合的报道[33]。Tang等[6]发现橡胶树基因组上共有11个CPT基因,其中3个在胶乳中高丰度表达,这与Uthup等[38]认为橡胶树中仅有3个与橡胶生物合成相关的CPT基因(RubCPT1、RubCPT2和RubCPT3)的结论一致。Uthup等[38]同时发现RubCPT1在不同橡胶品系中的单倍体类型与其基因表达水平和产胶性状密切相关。最近,Ding等[39]利用转录组学和基因组学整合分析研究手段发现1个CPT基因(CPT2)是所鉴定的3个橡胶生物合成枢纽基因之一。
2.2 橡胶延伸因子和小橡胶粒子蛋白
橡胶延伸因子(REF)和小橡胶粒子蛋白(SRPP)是橡胶树胶乳中丰度最高的蛋白,同属REF/SRPP蛋白家族。橡胶树基因组中有18个REF/SRPP基因,是已报道植物基因组中家族基因数量最多的物种[6],其中一些胶乳特异高表达的家族基因在多个蛋白质组研究中被鉴定到[37, 40-42]。关于橡胶树REF/SRPP蛋白参与橡胶生物合成的研究主要集中在2个胶乳特异高表达家族成员上,即REF1(138 aa, 14.6 kDa)和SRPP1(204 aa, 24 kDa)[6],它们具有较高的氨基酸序列同源性,都主要分布在胶乳中的橡胶粒子上,但与橡胶粒子的结合方式和生化特性存在明显差别[43-44]:SRPP1松散地结合在小橡胶粒子膜的表面,而REF1同时存在于大、小橡胶粒子上且与膜结合紧密;在溶液中,REF1聚合成富含β-折叠的淀粉样蛋白,并很快形成微米级别的大聚合体,SRPP1则形成稳定的纳米级别的近球形多聚体;SRPP1与REF1可发生相互作用,SRPP1会抑制REF1的聚集。
Dennis等[13]发现橡胶粒子上的REF蛋白与橡胶烃分子的比例约1∶1,胶乳中REF蛋白的含量与橡胶含量正相关,同时在体外橡胶生物合成体系中加入REF抗体或去除橡胶粒子上的REF蛋白均会显著抑制橡胶合成。Priya等[45]发现REF基因在橡胶树高产品系胶乳中的表达水平高于低产品系,割胶和乙烯利刺激均能诱导REF基因的表达,表明REF基因表达与胶乳产量正相关。Oh等[46]发现在体外橡胶生物合成体系中添加SRPP重组蛋白可显著促进橡胶合成,推测SRPP和REF可能都是橡胶生物合成系统的重要组成部分。
在2种产胶蒲公英——俄罗斯蒲公英和短角蒲公英中,SRPP/REF被RNA干扰下调表达后,根中的橡胶含量显著降低,幅度可高达50%以上[47-49]。不同的是,在俄罗斯蒲公英干扰植株中,橡胶粒子的稳定性和橡胶分子量都显著下降[47];而在短角蒲公英干扰植株中,橡胶粒子的稳定性、橡胶分子量和分子分散度则均不受影响[48-49]。Hillebrand等[48]推测,在短角蒲公英中SRPP是维持橡胶粒子稳定性的重要蛋白,RNA干扰植株中橡胶含量下降的主要原因是橡胶粒子的稳定性受到影响。奇怪的是,在另一种产胶植物莴苣中,RNA干扰胶乳中2个主要SRPP基因并不影响橡胶生物合成,干扰植株胶乳中的橡胶含量、橡胶分子量和分子分散度都不受影响[50]。
需要指出的是,系统进化分析结果显示橡胶树胶乳中特异高表达的REF/SRPP基因单独聚为一簇,其他产胶植物中一些REF/SRPP基因聚为另一簇,而橡胶树和其他产胶植物其余的REF/SRPP基因则分散开来与非产胶植物聚为不同的簇[6],这表明其他产胶植物胶乳中关于特异高表达REF/ SRPP基因的研究结果可能难以真实反映橡胶树中相应基因的功能。最近,Ding等[39]研究鉴定了3个参与橡胶生物合成的樞纽基因,其中包括胶乳中表达丰度最高的2个REF/SRPP基因(REF1和SRPP1)。
2.3 橡胶转移酶复合体
Qu等[28]从莴苣中鉴定到一个在胶乳中高表达的CPT-like 2(CPTL2)蛋白,该蛋白与人NogoB受体和典型的CPT都有一定的同源性,但缺乏CPT的保守motif。莴苣中CPTL2基因经RNA干扰后,胶乳中的橡胶含量降至野生植株的5%;CPT3和CPTL2可直接互作,在烟草和酵母细胞中共表达CPT3和CPTL2基因时,原本在细胞溶质中表达的CPT3定位到内质网上;在酵母微粒体中添加CPT3/CPTL2重组蛋白后低聚合度顺式-聚异戊二烯的合成能力增强,却不能合成橡胶大分子。根据以上结果,作者推测CPTL2可能作为一种脚手架蛋白将CPT3拉到内质网上,进而形成橡胶生
物合成的细胞器——橡胶粒子。在短角蒲公英中,Epping等[29]从胶乳蛋白质组上鉴定了一个与莴苣CPTL2功能近似的NogoB受体蛋白,该蛋白在橡胶粒子膜上与CPT互作,是橡胶转移酶复合物的必需组分;在该蛋白基因的RNA干扰的植株中,橡胶生物合成能力几乎完全丧失,胶乳中检测不到CPT蛋白,但多萜醇(dolichol)的含量和蛋白质的糖基化不受影响,因此将该蛋白命名为橡胶转移酶活化剂(rubber transferase activator, RTA)。
Yamashita等[30]在橡胶转移酶复合体研究中更进了一步,发现REF1也是橡胶转移酶复合体的一个关键组分。利用去污剂(8 mmol/L CHAPS)处理,获得了去除大部分膜蛋白的橡胶树橡胶粒子(WRP),结合无细胞蛋白翻译系统建立了橡胶体外合成反应的研究体系。在WRP悬浮液中同时表达橡胶树CPT(HRT1)、REF和HRT1-REF桥梁蛋白(HRBP,系莴苣CPTL2和短角蒲公英RTA的同源蛋白)这3种蛋白,发现橡胶转移酶的活性远高于单独表达HRT1或同时表达HRT1和HRBP的活性。橡胶粒子蛋白质组学和互作网络的研究表明,HRT1、REF和HRBP三者可能在橡胶粒子上形成复合体,其中HRBP同时与HRT1和REF互作,在复合体形成中发挥桥梁作用。基于相关结果,提出了在橡胶树胶乳中的橡胶粒子上进行橡胶合成以及橡胶粒子发生机制的模型图(图2)[30],指出在橡胶粒子上形成正确的HRT1蛋白复合体是进行橡胶大分子生物合成的关键。
3 橡胶树转基因研究
橡胶树遗传转化的效率低、周期长,转基因研究进展缓慢。1994年Arokiaraj等[51]将GUS报告基因导入橡胶树的基因组,但其后十几年仅有几篇进行橡胶树转基因体系优化研究的报道[52-56]。2012年发表了第一篇对转基因橡胶树植株表型和所转基因的功能进行系统研究的文章[57],研究者在橡胶树中过表达了其自身的细胞质胞浆CuZnSOD酶,转基因植株在干旱胁迫处理时气孔导度下降、脯氨酸含量增加,干旱耐受能力明显增强,并发现这种增强与转基因植株中活性氧清除能力的提高直接相关[57]。近几年,橡胶树转基因研究取得可喜进展,有望通过转基因手段明显改进橡胶树的抗逆和产量性状[58-60]。
Lestari等[59]在橡胶树中过表达1个拟南芥ERF1(ethylene response factor 1)的橡胶树同源基因HbERF-IXc5,发现转基因植株的根系发达,茎围和株高明显增加,植株干重显著增大,这与以往报道的ERF1过表达植株矮化严重的现象明显不同,表明HbERF-IXc5的功能可能有别于经典的植物ERF1;HbERF-IXc5转基因植株对干旱、冷、盐等非生物胁迫的耐受力有所增强,与相关植株生态生理指标的测定结果一致;转基因植株主叶脉和绿色嫩茎中的初生乳管数量明显增加,其中一个转基因株系老化茎中的次生乳管数量也明显增多,推测HbERF-IXc5基因可能通过参与乙烯和茉莉酸信号传导间的“窜扰”(crosstalk),从而控制一些直接参与乳管分化的基因。Jayashree等[60]在橡胶树中过表达IPP甲羟戊酸合成途径的关键酶HMGR基因(hmgr1),结果令人振奋,所有转基因植株的茎围和胶乳产量均高于对照植株,胶乳产量最高可达对照的5倍,显示通过转基因手段培养高产甚至超高产橡胶树的前景诱人。
最近,中国热带农业科学研究院橡胶研究所的科研人员[61]将体外组合的Cas9/sgRNA核蛋白导入橡胶树原生质体中,实现了对橡胶树靶标基因FT和TFL1的有效编辑,结合该团队前期建立的橡胶树原生质体植株再生体系[62],有望将无外源DNA导入的基因编辑技术应用到橡胶树遗传改良中。
4 橡胶树转录组与蛋白质组研究
橡胶树基因组测序推动了与产胶直接或间接相关的转录组和蛋白质组研究。研究内容涉及以下方面:胶乳蛋白质组[63]与转录组的研究方法[10, 64-65];不同橡胶树組织的转录组[66-69];胶乳[41, 70]及其不同亚细胞组分(橡胶粒子、c-乳清和黄色体)的蛋白组[37, 42, 63, 71-73];乙烯和茉莉酸刺激[68, 74],以及与死皮相关[75]的胶乳或树皮转录组;乙烯刺激的胶乳蛋白质组[41, 70];不同产胶水平单株或品系[4, 76]以及排胶相关的胶乳转录组[77];基于转录组的产胶相关基因家族发掘[78-79]、分子标记开发与遗传连锁图谱构建[61, 80];橡胶树基因组与转录组的整合数据库[81]等。这些研究产生了海量的以产胶组织胶乳为主的转录组和蛋白质组数据,加深了人们对橡胶树的橡胶生物合成、激素应答和割胶胁迫等生物学问题的认识。但从整体上看,多数研究只是对相关组学数据进行初步分析,未能对所发现的产胶相关候选基因或蛋白进行深入探究。
最近几年,在橡胶树组学研究上有了一些新变化,取得一些新进展,这里简要介绍几项代表性的研究。Wang等[70]鉴定到143个表达丰度显著受乙烯刺激调控的胶乳蛋白,进一步利用磷酸化蛋白质组学技术鉴定到59个应答乙烯处理的磷酸化蛋白,其中包括一些REF和SRPP的同源异构体(isoform),推测蛋白翻译后修饰和isoform特异性磷酸化修饰可能在乙烯刺激产胶中发挥重要作用。Makita等[65]建立了橡胶树不同组织的全长cDNA文库,利用Sanger和Illumina两种测序手段结合更新了5500个基因结构,新注释了9500个转录起始位点,结合橡胶树不同品种和组织的RNAseq数据,对橡胶生物合成、胶乳产量和抗病有了新认识。Chow等[10]利用PacBio三代测序技术对橡胶树全长cDNA文库进行转录组测序,共得到3.7万余个平均长度约2 kb的全长转录本,这些转录本对应约1.5万个基因座,与‘热研7-33-97基因组比对后发现,超过一半的转录本可能是新的基因isoform。Ding等[82]利用公共数据库中的129个RNAseq数据包进行基因共表达分析,共鉴定到25个基因共表达模块,其中1个模块基因注释富集为类异戊二烯代谢,在胶乳中高丰度表达并显著应答乙烯、茉莉酸处理和死皮发生,分析认为模块中的SRPP1、CPT2和REF1是橡胶生物合成的中心(hub)基因;基因组进化分析发现REF/SRPP基因家族在橡胶树物种中进化产生2个分别包含SRPP1和REF1基因的特异基因簇,推测与橡胶生物合成密切相关,这些结果与基因组研究[6]发现“REF1基因可能是橡胶树物种进化出高产橡胶性状的关键事件”一致。
5 问题与展望
过去10年,橡胶树产胶生物学研究取得了显著进展,加深了人们对橡胶树的产胶机制以及与产胶相关的抗逆与激素应答等重要生物学问题的认识,也为橡胶树高产分子改良提供了思路和技术储备。但与水稻等重要粮食作物相比,橡胶树橡胶产量性状形成的分子机制研究尚处于比较初级的水平,相关研究成果还无法对橡胶树高产遗传改良提供切实支持。根据橡胶树高产分子育种研究与实践发展的需要,笔者认为在未来5~10年,应对以下几个方面予以重点关注:
(1)构建橡胶树主要栽培品种和核心种质的泛基因组及胶乳等主要组织的泛转录组,揭示橡胶树基因组物种水平的基因结构、序列变异和可变剪辑模式;
(2)利用各组学相结合的整合生物学研究手段以及丰富的橡胶树栽培与种质材料,揭示橡胶产量形成的关键代谢途径与节点基因;
(3)利用橡胶树胶乳体外橡胶合成体系,以及酵母或植物悬浮细胞等表达体系,揭示橡胶转移酶复合体的精准结构与作用机制;
(4)利用橡胶树悬浮培养细胞以及产胶模式植物——橡胶草的转基因与基因编辑研究,揭示产胶细胞器(橡胶粒子)的发生与发育机制;
(5)探索橡胶树体胚发生与植株再生的分子调控机制,建立橡胶树高效遗传转化和基因编辑技术平台。
参考文献
Van Beilen J B, Poirier Y. Establishment of new crops for the production of natural rubber[J]. Trends in Biotechnology, 2007, 25(11): 522-529.
莫业勇. 天然橡胶供需形势和风险分析[J]. 中国热带农业, 2019(2): 4-6, 10.
Paardekooper E. Exploitation of the rubber tree[M]//Webster C, Baulkwill W. Rubber. New York: Longman Scientific and Technical, 1989.
Tang C, Xiao X, Li H, et al. Comparative analysis of latex transcriptome reveals putative molecular mechanisms underlying super productivity of Hevea brasiliensis[J]. PLoS One, 2013, 8(9): e75307.
Rahman A Y A, Usharraj A O, Misra B B, et al. Draft genome sequence of the rubber tree Hevea brasiliensis[J]. BMC Genomics, 2013, 14: 75.
Tang C, Yang M, Fang Y, et al. The rubber tree genome reveals new insights into rubber production and species adaptation[J]. Nature Plants, 2016, 2(6): 16073.
Lau N S, Makita Y, Kawashima M, et al. The rubber tree genome shows expansion of gene family associated with rubber biosynthesis[J]. Scientific Reports, 2016, 6(1): 28594.
Pootakham W, Sonthirod C, Naktang C, et al. De novo hybrid assembly of the rubber tree genome reveals evidence of paleotetraploidy in Hevea species[J]. Scientific Reports, 2017, 7: 41457.
Liu J, Shi C, Shi C C, et al. The Chromosome-based rubber tree genome provides new insights into spurge genome evolution and rubber biosynthesis[J]. Molecular Plant, 2020, 13(2): 336-350.
Chow K S, Khoo J S, Mohd-Zainuddin Z, et al. Utility of PacBio Iso-Seq for transcript and gene discovery in Hevea latex[J]. Journal of Rubber Research, 2019, 22(4): 169-186.
Bennett M D, Leitch I J. Nuclear DNA amounts in angiosperms-583 new estimates[J]. Annals of Botany, 1997, 80(2): 169-196.
柳 覲, 牛迎凤, 吴 裕, 等. 巴西橡胶树栽培种质基因组C值测定和变异分析[J]. 热带亚热带植物学报, 2018, 26 (5): 523-528.
Dennis M S, Light D R. Rubber elongation factor from Hevea brasiliensis. Identification, characterization, and role in rubber biosynthesis[J]. The Journal of Biological Chemistry, 1989, 264(31): 18608-18617.
Sando T, Takeno S, Watanabe N, et al. Cloning and characterization of the 2-C-methyl-D-erythritol 4-phosphate (MEP) pathway genes of a natural-rubber producing plant, Hevea brasiliensis[J]. Bioscience, Biotechnology and Biochemistry, 2008, 72(11): 2903-2917.
Chow K S, Matisa M N, Bahari A, et al. Metabolic routes affecting rubber biosynthesis in Hevea brasiliensis latex[J]. Journal of Experimental Botany, 2012, 63(5): 1863-1871.
Yeang H Y, Yip E, Hamzah S. Characterisation of Zone 1 and Zone 2 rubber particles in Hevea brasiliensis latex[J]. Journal of Natural Rubber Ressearch, 1995, 10: 108-123.
Berthelot K, Lecomte S, Estevez Y, et al. Rubber particle proteins, HbREF and HbSRPP, show different interactions with model membranes[J]. Biochimica et Biophysica Acta (BBA)-Biomembranes, 2014, 1838(1): 287-299.
dAuzac J, Jacob J L, Prév?t J C, et al. The regulation of cis-polyisoprene production (natural rubber) from Hevea brasiliensis[M]//Pandalai S G. Recent research developments in plant physiology. Trivandrum: Research Singpost, 1997.
Tupy J. Sucrose supply and utilization for latex production[M]//DAuzac J, Jacob J-L, Chrestin H. Physiology of rubber tree latex. Boca Raton: CRC Press, 1989.
Tang C, Huang D, Yang J, et al. The sucrose transporter HbSUT3 plays an active role in sucrose loading to laticifer and rubber productivity in exploited trees of Hevea brasiliensis (para rubber tree)[J]. Plant, Cell and Environment, 2010, 33(10): 1708-1720.
Dusotoit-Coucaud A, Kongsawadworakul P, Maurousset L, et al. Ethylene stimulation of latex yield depends on the expression of a sucrose transporter (HbSUT1B) in rubber tree (Hevea brasiliensis)[J]. Tree Physiology, 2010, 30(12): 1586-1598.
Liu S, Lan J, Zhou B, et al. HbNIN2, a cytosolic alkaline/neutral-invertase, is responsible for sucrose catabolism in rubber-producing laticifers of Hevea brasiliensis (para rubber tree)[J]. New Phytologist, 2015, 206(2): 709-725.
Tungngoen K, Kongsawadworakul P, Viboonjun U, et al. Involvement of HbPIP2; 1 and HbTIP1;1 aquaporins in ethylene stimulation of latex yield through regulation of water exchanges between inner liber and latex cells in Hevea brasiliensis[J]. Plant Physiology, 2009, 151: 843-856.
Amalou Z, Bangratz J, Chrestin H. Ethrel (ethylene releaser)-induced increases in the adenylate pool and transtonoplast delta pH within Hevea latex cells[J]. Plant Physiology, 1992, 98(4): 1270-1276.
Pujade-Renaud V, Clement A, Perrotrechenmann C, et al. Ethylene-Induced increase in glutamine synthetase activity and mRNA levels in Hevea brasiliensis latex cells[J]. Plant Physiology, 1994, 105(1): 127-132.
Putranto R A, Duan C, Kuswanhadi, et al. Ethylene response factors are controlled by multiple harvesting stresses in Hevea brasiliensis[J]. PLoS One, 2015, 10(4): e0123618.
Archer B L, Cockbain E G. Rubber transferase from Hevea brasiliensis latex[J]. Methods in Enzymology, 1969, 15: 476-480.
Qu Y, Chakrabarty R, Tran H T, et al. A lettuce (Lactuca sativa) homolog of human Nogo-B receptor interacts with cis-prenyltransferase and is necessary for natural rubber biosynthesis[J]. Journal of Biological Chemistry, 2015, 290(4): 1898-1914.
Epping J, Van Deenen N, Niephaus E, et al. A rubber transferase activator is necessary for natural rubber biosynthesis in dandelion[J]. Nature Plants, 2015, 1(5): 15048.
Yamashita S, Yamaguchi H, Waki T, et al. Identification and reconstitution of the rubber biosynthetic machinery on rubber particles from Hevea brasiliensis[J]. eLife, 2016, 5: e19022.
Cherian S, Ryu S B, Cornish K. Natural rubber biosynthesis in plants, the rubber transferase complex, and metabolic engineering progress and prospects[J]. Plant Biotechnology Journal, 2019, 17(11): 2041-2061.
Light D R, Dennis M S. Purification of a prenyltransferase that elongates cis-isoprene rubber from latex of Hevea brasiliensis[J]. Journal of Biological Chemistry, 1989, 264(31): 18589-18597.
Cornish K. The separate roles of plant cis and trans prenyl transferases in cis-1,4-polyisoprene biosynthesis[J]. European Journal of Biochemistry, 1993, 218(1): 267-271.
Asawatreratanakul K, Zhang Y W, Wititsuwannakul D, et al. Molecular cloning, expression and characterization of cDNA encoding cis-prenyltransferases from Hevea brasiliensis: a key factor participating in natural rubber biosynthesis[J]. European Journal of Biochemistry, 2003, 270(23): 4671- 4680.
Takahashi S, Lee H J, Yamashita S, et al. Characterization of cis-prenyltransferases from the rubber producing plant Hevea brasiliensis heterologously expressed in yeast and plant cells[J]. Plant Biotechnology, 2012, 29(4): 411-417.
Post J, van Deenen N, Fricke J, et al. Laticifer-specific cis-prenyltransferase silencing affects the rubber, triterpene, and inulin content of Taraxacum brevicorniculatum[J]. Plant Physiology, 2012, 158(3): 1406-1417.
Dai L, Kang G, Li Y, et al. In-depth proteome analysis of the rubber particle of Hevea brasiliensis (para rubber tree)[J]. Plant Molecular Biology, 2013, 82(1-2): 155-168.
Uthup T K, Rajamani A, Ravindran M, et al. Distinguishing CPT gene family members and vetting the sequence structure of a putative rubber synthesizing variant in Hevea brasiliensis[J]. Gene, 2019, 689: 183-193.
Ding Z, Fu L, Tan D, et al. An integrative transcriptomic and genomic analysis reveals novel insights into the hub genes and regulatory networks associated with rubber synthesis in H. brasiliensis[J]. Industrial Crops and Products, 2020, 153: 112562 .
Dai L, Nie Z, Kang G, et al. Identification and subcellular localization analysis of two rubber elongation factor isoforms on Hevea brasiliensis rubber particles[J]. Plant Physiology and Biochemistry, 2017, 111: 97-106.
Tong Z, Wang D, Sun Y, et al. Comparative proteomics of rubber latex revealed multiple protein species of REF/SRPP family respond diversely to ethylene stimulation among different rubber tree clones[J]. International Journal of Molecular Sciences, 2017, 18(5): 958.
Wang D, Sun Y, Chang L L, et al. Subcellular proteome profiles of different latex fractions revealed washed solutions from rubber particles contain crucial enzymes for natural rubber biosynthesis[J]. Journal of Proteomics, 2018, 182: 53-64.
Berthelot K, Lecomte S, Estevez Y, et al. Homologous Hevea brasiliensis REF (Hevb1) and SRPP (Hevb3) present different auto-assembling[J]. Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics, 2014, 1844(2): 473-485.
Berthelot K, Lecomte S, Estevez Y, et al. Hevea brasiliensis REF (Hev b 1) and SRPP (Hev b 3): An overview on rubber particle proteins[J]. Biochimie, 2014, 106: 1-9.
Priya P, Venkatachalam P, Thulaseedharan A, et al. Differential expression pattern of rubber elongation factor (REF) mRNA transcripts from high and low yielding clones of rubber tree (Hevea brasiliensis Muell. Arg.) [J]. Plant Cell Reports, 2007, 26(10): 1833-1838.
Oh S K, Kang H, Shin D H, et al. Isolation, characterization and functional analysis of a novel cDNA clone encoding a small rubber particle protein from Hevea brasiliensis[J]. Journal of Biological Chemistry, 1999, 274(24): 17132- 17138.
Collinssilva J, Nural A T, Skaggs A, et al. Altered levels of the Taraxacum kok-saghyz (Russian dandelion) small rubber particle protein, TkSRPP3, result in qualitative and quantitative changes in rubber metabolism[J]. Phytochemistry, 2012, 79: 46-56.
Hillebrand A, Post J, Wurbs D, et al. Down-regulation of small rubber particle protein expression affects integrity of rubber particles and rubber content in Taraxacum brevicorniculatum[J]. PLoS One, 2012, 7(7): e41874.
Laibach N, Hillebrand A, Twyman R M, et al. Identification of a Taraxacum brevicorniculatum rubber elongation factor protein that is localized on rubber particles and promotes rubber biosynthesis[J]. The Plant Journal, 2015, 82(4): 609- 620.
Chakrabarty R, Qu Y, Ro D K. Silencing the lettuce homologs of small rubber particle protein does not influence natural rubber biosynthesis in lettuce (Lactuca sativa)[J]. Phytochemistry, 2015, 113: 121-129.
Arokiaraj P, Jones H, Cheong K F, et al. Gene insertion into Hevea brasiliensis[J]. Plant Cell Reports, 1994, 13(8): 425-431.
Arokiaraj P, Yeang H Y, Cheong K F, et al. CaMV 35S promoter directs β-glucuronidas expression in the laticiferous system of transgenic Hevea brasiliensis (rubber tree)[J]. Plant Cell Reports, 1998, 17: 621-625.
Montoro P, Rattana W, Pugade-Renaud V, et al. Production of Hevea brasiliensis transgenic embryogenic callus lines by Agrobacterium tumefaciens: roles of calcium[J]. Plant Cell Reports, 2003, 21: 1095-1102.
Blanc G, Baptiste C, Oliver G, et al. Efficient Agrobacterium tumefaciens-mediated transformation of embryogenic calli and regeneration of Hevea brasiliensis Mull Arg. plants[J]. Plant Cell Reports, 2006, 24: 724-733.
Montoro P, Lagier S, Baptiste C, et al. Expression of the HEV2.1 gene promoter in transgenic Hevea brasiliensis[J]. Plant Cell Tissue and Organ Culture, 2008, 94(1): 55-63.
Leclercq J, Lardet L, Martin F, et al. The green fluorescent protein as an efficient selection marker for Agrobacterium tumefaciens-mediated transformation in Hevea brasiliensis (Mull. Arg)[J]. Plant Cell Reports, 2010, 29: 513-522.
Leclercq J, Martin F, Sanier C, et al. Over-expression of a cytosolic isoform of the HbCuZnSOD gene in Hevea brasiliensis changes its response to a water deficit[J]. Plant Molecular Biology, 2012, 80: 255-272.
Rekha K, Nazeem P A, Venkatachalam P, et al. Development of osmotin transgenics in Hevea brasiliensis Muell. Arg. using explants of zygotic origin[J]. Journal of Tropical Agriculture, 2014, 52(1): 7-20.
Lestari R, Rio M, Martin F, et al. Overexpression of Hevea brasiliensis ethylene response factor HbERF‐IXc5 enhances growth and tolerance to abiotic stress and affects laticifer differentiation[J]. Plant Biotechnology Journal, 2018, 16(1): 322-336.
Jayashree R, Nazeem P A, Rekha K, et al. Over-expression of 3-hydroxy-3- methylglutaryl-coenzyme A reductase 1 (hmgr1) gene under super-promoter for enhanced latex biosynthesis in rubber tree (Hevea brasiliensis Muell. Arg.)[J]. Plant Physiology and Biochemistry, 2018, 127: 414-424.
Fan Y, Xin S, Dai X, et al. Efficient genome editing of rubber tree (Hevea brasiliensis) protoplasts using CRISPR/ Cas9 ribonucleoproteins[J]. Industrial Crops and Products, 2020, 146: 112146 .
戴雪梅, 黃天带, 李 季, 等. 不同外植体对橡胶树原生质体分离和再生的影响[J]. 分子植物育种, 2014, 12(6): 1259-1264.
Wang X, Shi M, Lu X, et al. A method for protein extraction from different subcellular fractions of laticifer latex in Hevea brasiliensis compatible with 2-DE and MS[J]. Proteome Science, 2010, 8: 35.
Chow K, Ghazali A, Hoh C, et al. RNA sequencing read depth requirement for optimal transcriptome coverage in Hevea brasiliensis[J]. BMC Research Notes, 2014, 7(1): 69.
Makita Y, Ng K K, Singham G V, et al. Large-scale collection of full-length cDNA and transcriptome analysis in Hevea brasiliensis[J]. DNA Research, 2017, 24(2): 159-167.
Xia Z, Xu H, Zhai J, et al. RNA-Seq analysis and de novo transcriptome assembly of Hevea brasiliensis[J]. Plant Molecular Biology, 2011, 77(3): 299.
Li D, Deng Z, Qin B, et al. De novo assembly and characterization of bark transcriptome using Illumina sequencing and development of EST-SSR markers in rubber tree (Hevea brasiliensis Muell. Arg.)[J]. BMC Genomics, 2012, 13(1): 192.
Pirrello J, Leclercq J, Dessailly F, et al. Transcriptional and post-transcriptional regulation of the jasmonate signalling pathway in response to abiotic and harvesting stress in Hevea brasiliensis[J]. BMC Plant Biology, 2014, 14(1): 341.
Fang Y, Mei H, Zhou B, et al. De novo transcriptome analysis reveals distinct defense mechanisms by young and mature leaves of Hevea brasiliensis (para rubber tree)[J]. Scientific Reports, 2016, 6: 33151.
Wang X, Wang D, Sun Y, et al. Comprehensive proteomics analysis of laticifer latex reveals new insights into ethylene stimulation of natural rubber production[J]. Scientific Reports, 2015, 5: 13778.
Xiang Q, Xia K, Dai L, et al. Proteome analysis of the large and the small rubber particles of Hevea brasiliensis using 2D-DIGE[J]. Plant Physiology and Biochemistry, 2012, 60: 207-213.
Wang X, Shi M, Wang D, et al. Comparative proteomics of primary and secondary lutoids reveals that chitinase and glucanase play a crucial combined role in rubber particle aggregation in Hevea brasiliensis[J]. Journal of Proteome Research, 2013, 12(11): 5146-5159.
Habib M A H, Gan C Y, Othman F, et al. Proteomics analysis of latex from Hevea brasiliensis (clone RRIM 600)[J]. Biochemistry and Cell Biology, 2017, 95(2): 232-242.
Liu J, Zhuang Y, Guo X, et al. Molecular mechanism of ethylene stimulation of latex yield in rubber tree (Hevea brasiliensis) revealed by de novo sequencing and transcriptome analysis[J]. BMC Genomics, 2016, 17(1): 257.
Li D, Wang X, Deng Z, et al. Transcriptome analyses reveal molecular mechanism underlying tapping panel dryness of rubber tree ( Hevea brasiliensis)[J]. Scientific Reports, 2016, 6: 23540.
Chao J, Chen Y, Wu S, et al. Comparative transcriptome analysis of latex from rubber tree clone CATAS8-79 and PR107 reveals new cues for the regulation of latex regeneration and duration of latex flow[J]. BMC Plant Biology, 2015, 15: 104.
Wei F, Luo S, Zheng Q, et al. Transcriptome sequencing and comparative analysis reveal long-term flowing mechanisms in Hevea brasiliensis latex[J]. Gene, 2015, 556(2): 153-162.
Piyatrakul P, Yang M, Putranto R A, et al. Sequence and expression analyses of ethylene response factors highly expressed in latex cells from Hevea brasiliensis[J]. PLoS One, 2014, 9(6): e99367
Nie Z, Kang G, Li Y, et al. Whole-transcriptome survey of the putative ATP-binding cassette (ABC) transporter family genes in the latex-producing laticifers of Hevea brasiliensis[J]. PLoS One, 2015, 10(1): e0116857.
Shearman J R, Sangsrakru D, Jomchai N, et al. SNP identification from RNA sequencing and linkage map construction of rubber tree for anchoring the draft genome[J]. PLoS One, 2015, 10(4): e0121961.
Makita Y, Kawashima M, Lau N S, et al. Construction of Pará rubber tree genome and multi-transcriptome database accelerates rubber researches[J]. BMC Genomics, 2018, 19(Suppl 1): 922.
Ding Z, Fu L, Tan D, et al. An integrative transcriptomic and genomic analysis reveals novel insights into the hub genes and regulatory networks associated with rubber synthesis in H. brasiliensis[J]. Industrial Crops and Products, 2020, 153: 112562.
