新型猪α干扰素YNS突变体的构建及其抗病毒活性检测
2020-12-09王朋涛梁秀丽徐盟龙赵福杰闫晓光魏战勇
王朋涛,梁秀丽,徐盟龙,赵福杰,闫晓光,魏战勇, 3*
(1. 河南农业大学牧医工程学院,河南 郑州 450002;2. 安阳工学院,河南 安阳 455000;3. 河南省动物性食品安全重点实验室,河南 郑州 450002)
干扰素(interferon, IFN)是一类具有抗病毒、抑制细胞增殖等多功能糖蛋白,在适应性免疫调节中起着重要作用[1]。干扰素在病原入侵机体时诱导相关抗病毒蛋白的表达,例如:蛋白激酶R、干扰素诱导黏病毒抵抗蛋白等[2-4],使机体处于抗病毒状态。干扰素广泛用于养殖业,在蓝耳病、口蹄病等病毒性疾病治疗中效果显著[5-6]。
猪α干扰素基因编码166个氨基酸,其空间结构主要由5个α螺旋组成,无内含子,有至少17个亚型[7-8]。猪α干扰素在机体内分布广泛,但表达量较低,无法满足生产需要[9]。因此许多学者利用基因工程对猪α干扰素进行研究。Lefevre等[10]对猪α干扰素进行体外克隆、基因序列分析和少量表达。陈涛等[11]改变猪α干扰素第86 位氨基酸, 并对其密码子进行优化,获得蛋白活性为52 000 IU/mg的突变体。李爽等[12]改变猪α干扰素不同的氨基酸活性位点,获得了蛋白活性为2.97× 108IU/mg的突变体。本研究将天然猪α干扰素的第58位组氨酸H、59位谷氨酸E及61位亮氨酸L分别突变为酪氨酸Y、天冬氨酸N及丝氨酸S,成功构建了猪α干扰素YNS突变体,运用大肠杆菌系统表达纯化后,其抗病毒活性与天然猪α干扰素相比明显提高,为干扰素的临床应用提供理论基础。
1 材料与方法
1.1 质粒与菌株
含有猪α干扰素基因的重组质粒、原核表达载体pET-32a、大肠杆菌感受态细胞DH-5α和Rosetta(DE3)由河南省动物性食品安全重点实验室保存。
1.2 细胞与病毒
Vero细胞和水泡性口炎病毒(VSV-Indiana)由中科院武汉病毒研究所惠赠。
1.3 主要试剂
限制性内切酶、T4 DNA连接酶等购自北京宝日医生物技术有限公司,猪α干扰素单克隆抗体(G16,Santa Cruz)购自北京百奥曼科技有限公司,羊抗鼠IgG(HRP标记)购自武汉三鹰生物技术有限公司,其他试剂均为国产分析纯。
1.4 引物设计及合成
根据猪α干扰素基因(登陆号:AB369102.1)设计两对引物, 其中F1和R1用于扩增完整的猪α干扰素基因并包含BamH Ⅰ和XhoⅠ酶切位点,W1和W2反向互补且包含突变位点(表1)。引物由郑州尚亚生物工程有限公司合成。
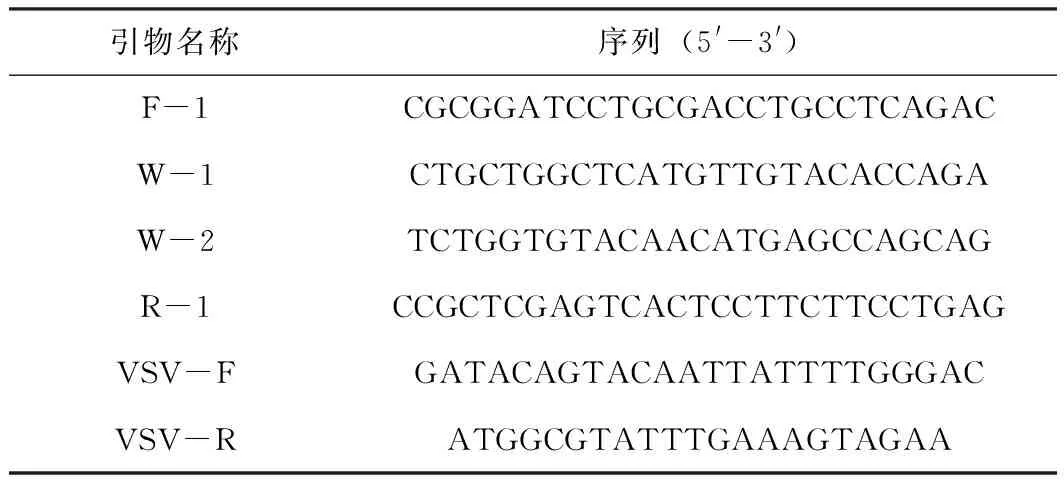
表1 引物序列
1.5 猪α干扰素YNS突变体基因的扩增
以猪α干扰素基因重组质粒为模板,利用F-1、W-1和W-2、R-1两对引物进行PCR扩增,扩增片段命名为P1和P2。PCR反应程序为:95 ℃预变性5 min,95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸20 s,35个循环。反应结束后,以F-1、R-1为引物,以P1、P2为模板进行扩增,扩增程序如上。反应结束后用1%的琼脂糖凝胶电泳检测PCR产物。
1.6 重组表达载体pET-32a-IFN-α的构建
用BamHⅠ、XhoⅠ分别对PCR产物和表达质粒进行双酶切,16 ℃连接。转入大肠杆菌DH5α,筛选阳性克隆并送至武汉奥科生物有限公司进行序列测定。
1.7 重组质粒pET-32a-IFN-α的表达及鉴定
将鉴定正确的阳性质粒转至表达菌Rosetta中,挑选阳性克隆,37 ℃、200 r/min 振荡扩大培养至OD值为0.6~0.8,加入IPTG(1 mmol/L)诱导8 h。收集菌体进行超声波裂解,4℃、12 000 r/min离心,取沉淀和上清进行SDS-PAGE检测和Western blot鉴定。
1.8 表达产物的纯化
经超声波破碎后,4 ℃、12 000 r/min离心,4 mol/L尿素(无菌PBS配制)洗涤沉淀3次以除去杂蛋白,4 ℃、12 000 r/min离心。取适量的6 mol/L尿素溶解沉淀,分别用5、4、3、2、1 mol/L尿素溶液依次透析,每个阶段6 h,最后用无菌的PBS(pH 7.2)透析24 h。测定蛋白含量,-80 ℃保存。
1.9 蛋白内毒素测定
利用ToxinSensorTM内毒素检测试剂盒(L00350)检测纯化后干扰素内毒素的含量,具体步骤参照试剂盒说明书。
1.10 干扰素的生物活性测定
VSV的半数细胞感染量(TCID50)测定:将Vero细胞接种到96孔板中, 24 h后每孔加入10倍倍比稀释的VSV病毒100 μL,每个稀释度设6个重复孔。继续培养72 h,按Reed-Muench法计算TCID50。
MTT法检测干扰素在Vero细胞上的安全浓度:利用MTT试剂盒(索莱宝M1020-500T)检测,酶联免疫检测仪在OD490nm处测量生物活性。
抗病毒活性的测定:采用细胞病变(CPE)抑制法在Vero-VSV系统上测定猪α干扰素突变体蛋白的抗病毒活性。同时对VSV的TCID50和基因拷贝数进行检测。将Vero细胞接种到6孔板中,24 h后每孔加入浓度分别为100 ng/mL和1 ng/mL的干扰素100 μL,同时设置对照组。继续培养24 h,试验组每孔接入100 TCID50/0.1 mL VSV。培养至病毒对照组有75%细胞出现病变时,分别收取上清和细胞检测。VSV(Real-time pCR)检测方法及其标准曲线参照文献[13]方法建立。引物序列如表1。
1.11 统计分析
采用Prism 6.0进行的统计分析,每个数据重复3次,试验数据是用平均值显示,P<0.05为差异显著,P<0.01为差异极显著。
2 结果
2.1 猪α干扰素突变体的克隆
猪α干扰素突变体基因扩增产物,核酸电泳和测序显示,扩增片段大小符合预期,长 501 bp并含有3个预期突变位点,与参照序列同源性97.6%。双酶切鉴定结果显示成功构建猪α干扰素突变体表达质粒(如图2)。
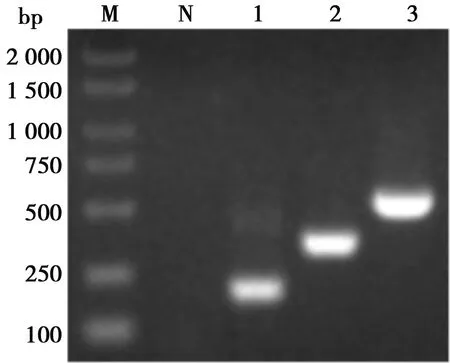
M. DL 2000 DNA Marker;1. 片段P1; 2. 片段P2; 3. 猪α干扰素;N. 阴性对照
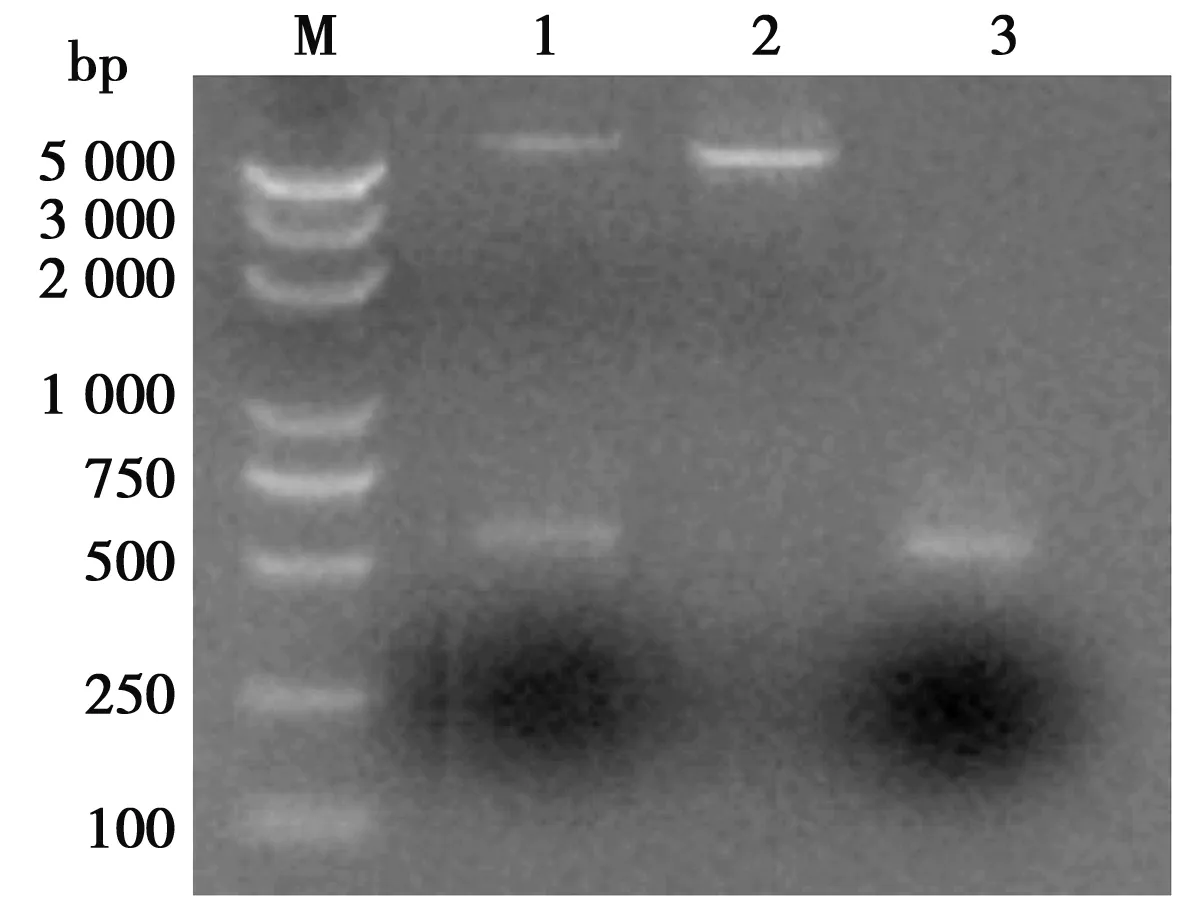
M. DL 5000 DNA Marker;1. pET-32a--IFN-α双酶切产物; 2. pET-32a 双酶切产物; 3. 猪α干扰素
2.2 重组蛋白的表达及鉴定
将重组质粒转入Rosetta(DE3)诱导表达,超声破碎后,SDS-PAGE检测(如图3)结果显示,蛋白分子量约33 kDa,符合预测结果,蛋白表达形式为包涵体。电泳结束后,将蛋白转移到硝酸纤维素膜上,与猪α干扰素单克隆抗体和羊抗鼠HRP抗体反应,结果显示在33 kDa处显示一条清晰的特异性条带,与目的蛋白相对分子质量一致(如图4)。
2.3 内毒素检测
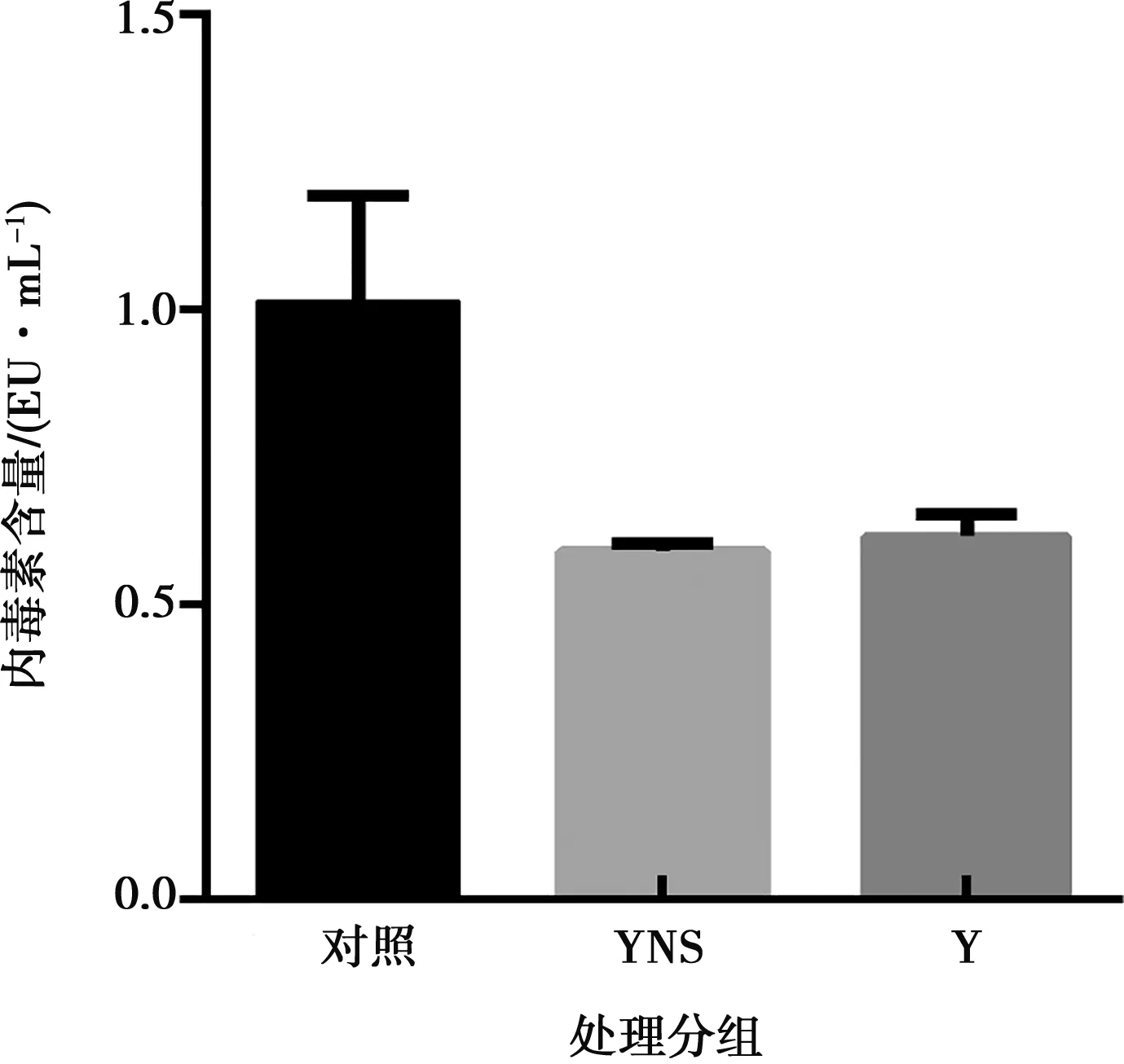
利用内毒素检测试剂盒,检测纯化后干扰素蛋白内毒素的含量。检测结果显示,猪α干扰素突变体和参考蛋白的内毒素(0.8 mg/mL)的检测平均值分别为0.59 EU/mL和0.62 EU/mL,符合2015版《中国药典》中通则1143要求(如图5)。

M. 蛋白Marker;1. Rosetta;2. pET-32a空载体诱导;3.重组质粒pET-32a--IFN-α诱导;4. 沉淀中的重组蛋白;5. 上清中的重组蛋白
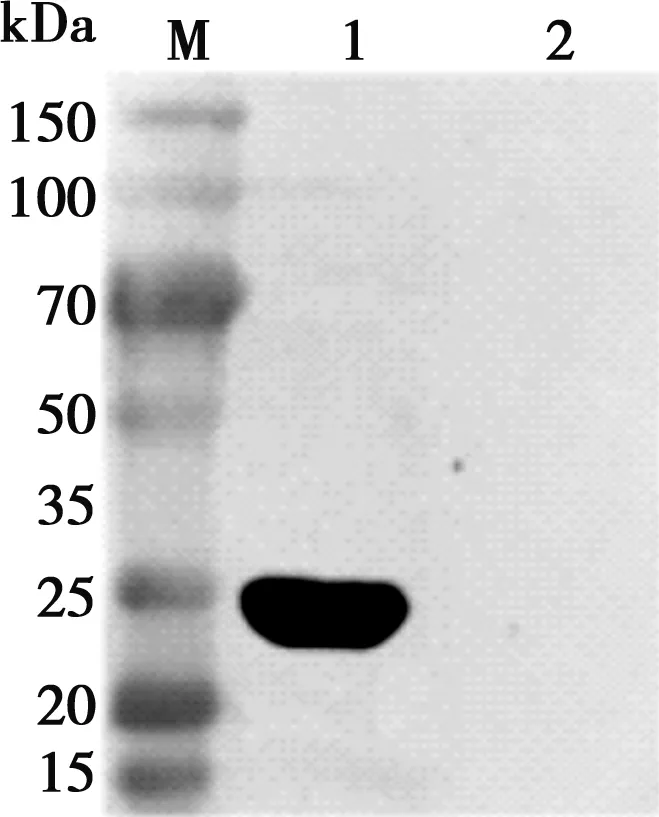
M. 蛋白Marker;1. 重组质粒pET-32a-IFN-α诱导;2. pET-32a空载体诱导
注:Y表示参照序列蛋白,YNS 表示猪α干扰素YNS突变体。下同
2.4 蛋白生物活性测定结
2.4.1 干扰素细胞安全浓度检测
利用MTT法,在Vero细胞上检测干扰素蛋白的安全浓度。结果表明,猪α干扰素突变体的CC50为462.7 μg/mL,参考序列蛋白的CC50为402.9 μg/mL,二者对细胞活性的影响呈现浓度依赖性,倍比稀释到约25 μg/mL后对细胞增殖没有影响(如图6)。
2.4.2 抗病毒活性检测结果
采用细胞病变抑制法,在Vero/VSV系统测定猪干扰素的抗病毒活性。检测结果表明,猪α干扰素突变体表现出较高的抗病毒活性,突变体蛋白活性为1.63×106IU/mg。利用TCID50和Real-time PCR测定病毒滴度和基因拷贝数,结果显示猪α干扰素能够有效地抑制VSV增殖,与参考序列蛋白相比差异显著,具有更高的生物活性。
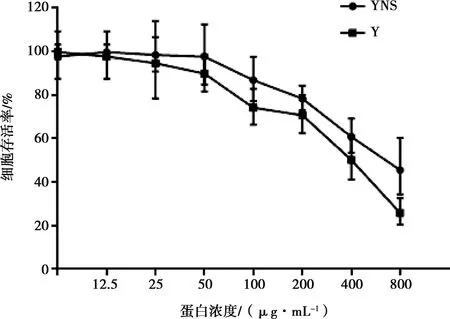
图6 细胞活性检测
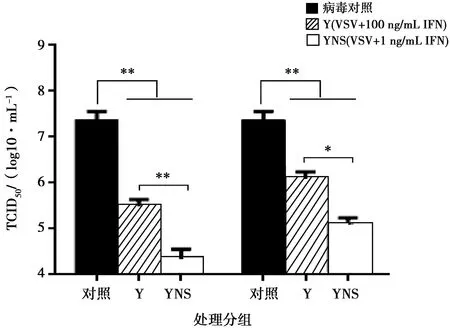
注:*表示差异显著(P<0.05),**表示差异极显著(P<0.01)。下同
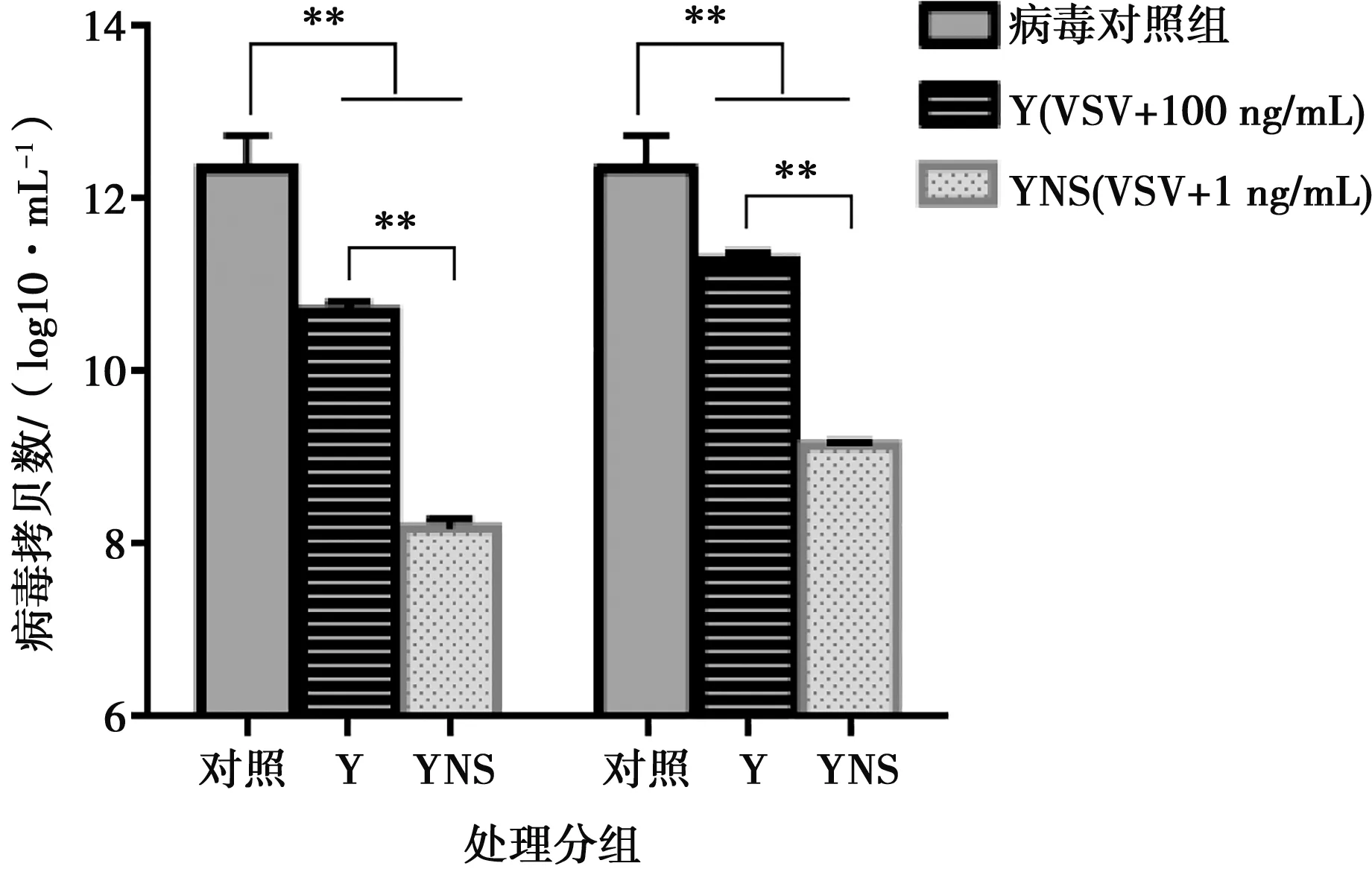
图8 VSV基因拷贝数测定
3 讨论
猪α干扰素具有速效广谱的抗病毒效应,在预防和治疗病毒性疾病方面发挥着不可替代的作用[14]。近年来,国内外许多学者利用原核、真核和杆状病毒等表达系统对干扰素进行表达[15-17]。Lefevre等[8]在大肠杆菌中表达猪α干扰素,并对其生物活性检测。曹瑞兵等[18]对猪α干扰素密码子进行优化,获得干扰素蛋白的生物活性为6. 4×106IU/mg。王彦彬等[15]利用杆状病毒表达系统表达干扰素,蛋白在细胞上有效抑制猪繁殖与呼吸综合征病毒的增殖。Huang等[17]利用基因工程的方法改变猪α干扰素基因并在毕赤酵母中大量表达,获得了具有高活性的干扰素。
研究表明,改变人IFNα2的3个氨基酸位点H57Y、E58N和Q61S,可使其活性相比野生型人IFN-α2得到提高[19]。人干扰素α和猪α干扰素同源性高达70%,因此本试验采用融合PCR的方法克隆包含58、59和61位氨基酸突变位点的猪α干扰素突变体基因,利用大肠杆菌系统表达突变体,优化蛋白纯化方式,缩短了纯化时间,更加适合大规模制备和生产应用。
本试验利用试剂盒检测纯化后的猪α干扰素内毒素残留,结果表明,内毒素含量低于1 EU/mg,符合细胞因子制品标准。MTT试验结果表明突变体蛋白的抗增殖能力呈现浓度依赖性,在蛋白浓度为25 μg/mL时,不影响Vero细胞增殖,对细胞无毒性。试验还运用TCID50和Real-time PCR方法分别从病毒滴度和病毒基因拷贝数上探究猪α干扰素抑制VSV增殖的能力。结果表明,YNS突变体和参照序列蛋白均能显著降低VSV的病毒滴度和基因拷贝数,YNS突变体抑制病毒增殖作用更明显,与参照序列蛋白相比降低约2个病毒滴度和2log10病毒基因拷贝数。
王彦彬等[16],通过对干扰素与其受体IFNAR2三级结构分析,突变猪α干扰素与受体结合的氨基酸位点,可以使猪α干扰素与受体更快、更紧密的结合,从而使干扰素活性增强,但是具体某个氨基酸的改变对干扰素活性影响较大,仍需进一步探究。
总之,本研究成功构建了新型猪α干扰素YNS突变体,表达纯化后具有较高的生物活性,为干扰素的临床应用提供理论基础。
