高强度聚焦超声对宫颈癌大鼠免疫功能及生存时间的影响
2020-12-09彭月享高卫元黄红丽
黄 敏,彭月享,高卫元,黄红丽
(1.武汉市第三医院光谷院区 超声科,武汉 430000; 2.武汉市第三医院光谷院区 妇产科,武汉 430000)
宫颈癌早期常无明显症状和体征,主要采用外科手术治疗,中晚期主要表现为不规则阴道流血、阴道排液等,严重者可表现为贫血、恶病质等全身衰竭症状,主要采用放射治疗或化疗,但其治疗效果并不十分令人满意[1]。高强度聚焦超声治疗(high intensity focused ultrasound,HIFU)是近年来发现的一种新型的肿瘤治疗方法,利用高强度超声波聚焦后,穿透到人体内,杀灭靶区内的肿瘤细胞,还可能激活机体的免疫系统,提高患者的免疫功能,从而达到治疗肿瘤的目的[2]。已有研究显示,HIFU可以用于临床晚期胰腺癌[3]、子宫肌瘤[4]、宫颈癌[5]等的治疗,延长患者的生存期,且毒副反应小。但HIFU治疗宫颈癌研究报道较少,杀灭肿瘤细胞的机理尚不明确,对宫颈癌患者免疫功能的影响亦尚不清楚。因此,本研究探索了HIFU对宫颈癌大鼠免疫功能和生存时间的影响,旨在为HIFU在宫颈癌治疗中的应用提供一定的理论支撑。
1 材料和方法
1.1 实验动物
60只6~8周龄Wistar大鼠,清洁级雌性,体重均为160~200 g,由湖北省实验动物研究中心提供[SCXK(鄂)2015-0018],经武汉市第三医院伦理委员会批准(20170119-03),饲养于本院动物中心实验室[SYXK(鄂)2019-0080],保持室温恒定为25℃,模拟昼夜光照,自由摄食与饮水,严格按实验动物3R原则给予实验动物人道主义关怀。
1.2 主要试剂与仪器
FACSCanto II流式细胞仪购自美国BD公司;全自动酶标仪购自Thermo Scientific公司;人宫颈癌HeLa细胞由上海钰博生物科技有限公司提供,接种于含有100 U/mL青链霉素和10%胎牛血清的RPMI 1640培养液,于37℃、5% CO2培养箱中培养。MTT检测试剂盒购自上海信裕生物科技有限公司;Annexin V-FITC/PI 细胞凋亡检测试剂盒购自上海一研生物科技有限公司。
1.3 实验方法
1.3.1 动物造模与给药
大鼠预饲养7 d后,随机分为对照组、模型组和HIFU组,每组20只,每组随机选取10只用于观察大鼠的生存时间和体重变化,剩余10只用于病理、免疫相关指标的检测。模型组和HIFU组采用左侧腋窝处皮下注射人宫颈癌HeLa细胞建立宫颈癌大鼠模型[6],均经左侧腋窝处皮下注射接种人宫颈癌HeLa细胞(0.5 mL,1×107/mL),密切观察,肉眼可见大鼠左腋窝处有明显肿瘤结节生长即为造模成功,对照组于左侧腋窝处皮下注射等体积生理盐水。造模后第7天,HIFU组进行局部HIFU治疗,辐照强度为2.3 MPa,单点单次治疗时间为10 s,共250 s,对照组和模型组治疗程序与HIFU治疗相同,但功率源开关关闭。对照组、模型组和HIFU组20只大鼠中,10只用于观察大鼠的生存时间和体重变化,于造模之日开始观察,观察时间共9周;剩余10只大鼠于治疗后14 d立即处死,分离大鼠的血液,无菌剥离移植瘤组织,分离大鼠脾,用于病理及免疫相关指标的检测。
1.3.2 观察各组大鼠的生存时间
于造模之日开始观察大鼠的生存状态,记录各组大鼠9周内的生存状态(生存或死亡),分别于造模前、造模后1周给药即刻、造模3周、造模5周和造模7周称取大鼠的体重。
1.3.3 观察各组大鼠的移植瘤体积和重量
处死大鼠后,剥离大鼠移植瘤组织,测移植瘤长径、短径,计算其肿瘤体积=(长径×短径2)/2,同时称取移植瘤重量,计算HIFU的抑瘤率=(1-实验组肿瘤组织重量/对照组肿瘤组织重量)×100%。
1.3.4 HE染色观察大鼠移植瘤组织病理变化
采集大鼠移植瘤组织,进行常规切片制作和HE染色,显微镜下观察移植瘤组织的病理变化。
1.3.5 MTT检测脾淋巴细胞活力
取各组大鼠脾组织,剪碎研磨,过滤,离心(1500 r/min,10 min),弃上清,加入10 mL氯化铵37℃水浴10 min,加入2 mL的RPMI 1640培养液中进行培养,采用台盼蓝染色,计数活细胞在95%以上,制备成脾淋巴细胞液。将脾淋巴细胞悬液以每毫升1×105个接种于96孔培养板,在37℃、5% CO2条件下培养,分别于0 h、24 h、48 h、72 h,进行MTT检测,酶标仪测定波长为570 nm处的吸光度值(OD570),绘制细胞生长曲线,严格按照试剂盒说明操作。
1.3.6 流式细胞仪分析外周血T淋巴细胞亚群
分离腹主动脉血液,抗凝离心(3000 r/min,5 min),弃上清,室温避光孵育30 min,加红细胞裂解液作用15 min,加70%乙醇混合,4℃静置48 h,弃上清,采用1 mL PBS 重悬,加入5 μL浓度为10 mg/mL的RNase,37℃下孵育1 h,分别加入相应的流式抗体(CD4-APC,CD8-PE),室温避光孵育30 min,上机流式细胞仪检测CD4+和CD8+T细胞比例。
1.3.7 流式细胞仪检测外周血T淋巴细胞凋亡
分离腹主动脉血液,抗凝离心(3000 r/min,5 min),采用淋巴细胞分离液分离外周血单个核细胞,PBS重悬后,收集各组细胞,采用不含EDTA的胰蛋白酶进行消化,离心(3000 r/min,5min),用冷PBS洗涤,以每毫升1×105个接种于6孔板,采用Annexin V-FITC/PI试剂盒染色,上机流式细胞仪检测细胞凋亡,严格按照试剂盒说明操作。
1.4 统计学方法
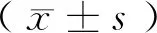
2 结果
2.1 HIFU对各组大鼠生存时间的影响
生存分析结果显示,模型组大鼠于造模后43 d开始出现死亡,HIFU组大鼠于造模后46 d开始出现死亡;与模型组相比,HIFU组的中位生存时间明显延长[(54.51±3.16) vs (48.03±1.05),Log Rank χ2=7.504,P=0.006],见图1。

图1 各组大鼠的生存曲线比较Figure 1 Comparison of survival curves of rats in each group
2.2 HIFU对各组大鼠体重的影响
造模前各组大鼠的体重均无明显差异(P>0.05);与对照组相比,模型组和HIFU组大鼠造模3周、5周和7周时大鼠体重均明显下降(P<0.05);与模型组相比,HIFU组大鼠造模3周、5周和7周时大鼠体重均明显升高(P<0.05),见表1。
2.3 HIFU对各组大鼠移植瘤体积和重量的影响
与模型组相比,HIFU组的肿瘤体积和重量明显降低(P<0.05),HIFU的抑瘤率为35.25%,见表2。
2.4 各组大鼠移植瘤组织的病理变化
HE染色结果显示,模型组大鼠移植瘤组织细胞呈椭圆形,胞核呈两个或多个,结构和细胞形态未见异常;HIFU组大鼠移植瘤组织细胞皱缩、核染色质固缩,出现片状坏死区,见图2。
2.5 HIFU对各组大鼠脾淋巴细胞活力的影响
MTT实验结果显示,与对照组相比,模型组和HIFU组脾淋巴细胞活力明显下降(P<0.05);与模型组相比,HIFU组脾淋巴细胞活力明显升高(P<0.05),见图3。
2.6 HIFU对各组大鼠外周血中CD4+和CD8+ T细胞水平的影响
流式细胞分析结果显示,与对照组相比,模型组和HIFU组外周血CD4+T细胞和CD8+T细胞和CD4+/CD8+T细胞比值均明显下降(P<0.05);与模型组相比,HIFU组外周血CD4+T细胞和CD8+T细胞和CD4+/CD8+T细胞比值均明显升高(P<0.05),见表3。
2.7 HIFU对各组大鼠外周血中T淋巴细胞凋亡的影响
流式细胞分析结果显示,与对照组相比,模型组和HIFU组T淋巴细胞凋亡率明显升高(P<0.05);与模型组相比,HIFU组T淋巴细胞凋亡率明显下降(P<0.05),见图4、表4。

表1 HIFU对各组大鼠体重的影响Table 1 Effect of HIFU on body weight of rats in each group
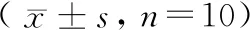
表2 各组大鼠移植瘤的体积和重量Table 2 Volume and weight of transplanted tumor in each group
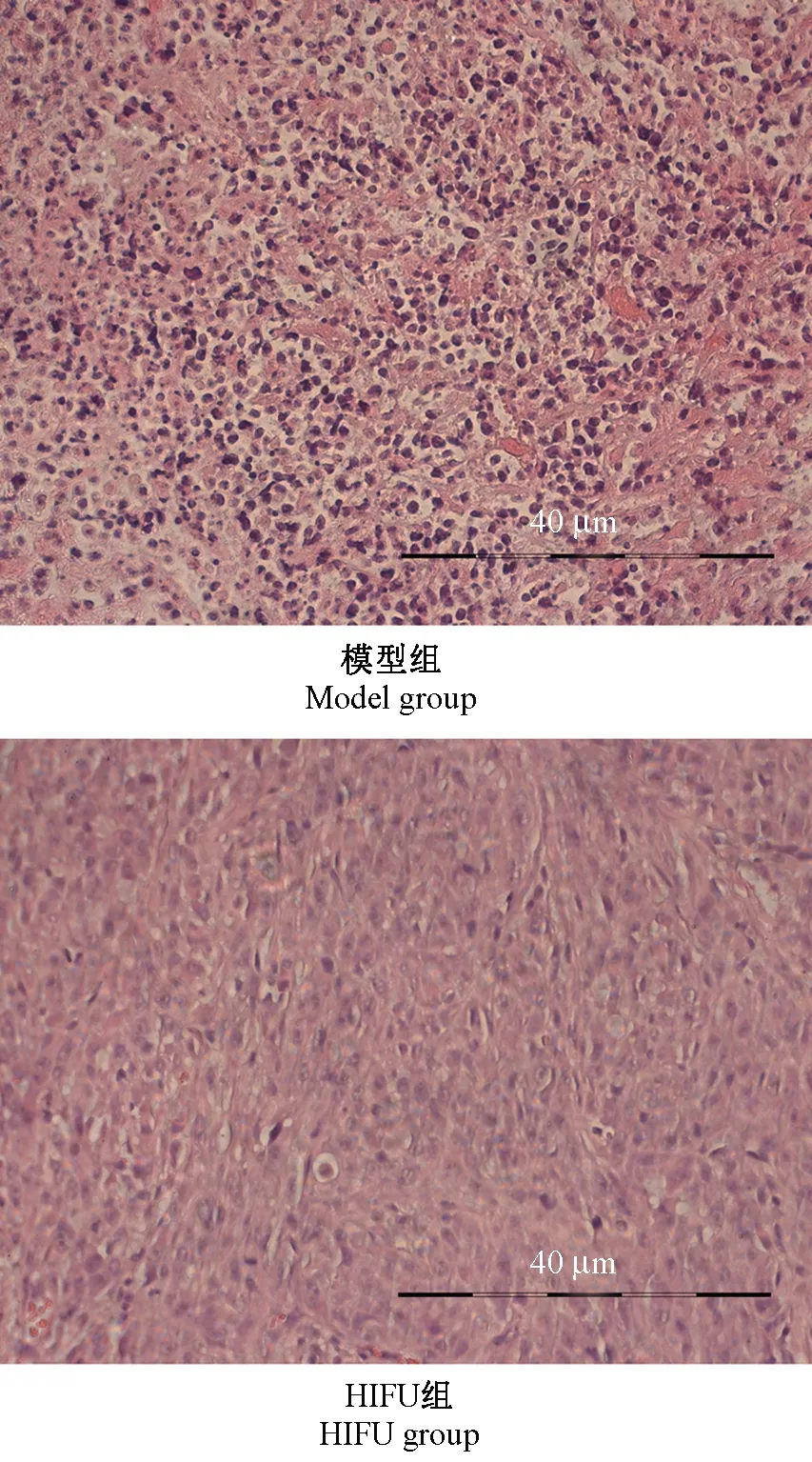
图2 各组大鼠移植瘤组织的病理变化(HE染色)Figure 2 Pathological changes of transplanted tumor tissues in each group of rats (HE staining)

注:与对照组相比,*P<0.05;与模型组相比,#P<0.05。图3 HIFU对各组大鼠脾淋巴细胞活力的影响Note. Compared with control group,*P < 0.05. Compared with model group,#P < 0.05.Figure 3 Effect of HIFU on spleen lymphocyte activity in each group
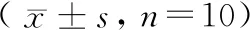
表3 各组大鼠外周血中CD4+和CD8+ T 细胞水平

图4 HIFU对各组大鼠外周血中T淋巴 细胞凋亡的影响Figure 4 Effect of HIFU on T lymphocyte apoptosis in peripheral blood of rats in each group
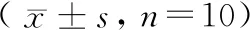
表4 HIFU对各组大鼠外周血中T淋巴细胞凋亡的
3 讨论
宫颈癌是常见的女性三大恶性肿瘤之一,临床主要采用外科手术联合放化疗,预后较差[7]。HIFU是一种新型的非侵入性治疗手段,可以将超声波进行聚焦后,安全地将能量密度较低的超声波汇聚至靶区,利用焦点处超声波的热效应,使靶区组织细胞发生不可逆的损伤,达到抗肿瘤的作用[8]。目前,HIFU已被用于前列腺癌、乳腺癌、软组织肿瘤以及子宫腺肌症等多种疾病的治疗[9],但对宫颈癌的作用研究报道较少。因此,本研究分析了HIFU对宫颈癌大鼠生存时间的影响。本研究中,HIFU作用后可明显延长宫颈癌大鼠的生存时间,提示HIFU可能通过抗肿瘤作用,延长大鼠的生存时间。许涛等[10]的研究显示,HIFU可用于晚期宫颈癌患者的治疗,减少局部复发,提示HIFU对宫颈癌具有的一定的抗肿瘤作用,有望应用于临床。本研究中,HIFU作用后可明显改善宫颈癌大鼠的体重,诱导肿瘤组织坏死,减少移植瘤体积和重量。Hectors等[11]的研究显示,HIFU可以将超声波能量汇聚于肿瘤组织,通过热效应,使肿瘤细胞发生凝固性坏死,提示HIFU可能通过破坏宫颈癌肿瘤细胞,诱导肿瘤细胞坏死,发挥其抗肿瘤作用,延长大鼠的生存时间。
细胞免疫是机体抗肿瘤的主要机制,肿瘤细胞可通过改变细胞表面抗原、降低或不表达组织相容性抗原Ⅰ(major histocompatibility complex,MHC-Ⅰ)和MHC-Ⅱ、分泌多种免疫抑制因子等多种途径,发生免疫逃避或免疫抑制,发生恶性增殖[12]。本研究中,宫颈癌大鼠的脾淋巴细胞活力明显下降,HIFU作用后可明显提高大鼠的脾淋巴细胞活力。脾是机体最大免疫系统中的最主要的免疫器官之一,含有大量淋巴细胞和巨噬细胞,可以清除血细胞抗原和异物,是机体免疫系统的中心,脾淋巴细胞增殖活性可以反应机体淋巴细胞的功能[13]。许涛等[14]的研究显示,HIFU可以改善原发性肝癌的免疫功能,延长患者的生存时间,提示HIFU可能通过诱导肿瘤细胞坏死,抑制肿瘤细胞分泌的免疫抑制因子,提高脾淋巴细胞活力,提高机体的细胞免疫功能和抗肿瘤能力,从而延长宫颈癌大鼠的生存时间。
本研究中,宫颈癌大鼠的外周血CD4+T细胞和CD8+T细胞和CD4+/CD8+T细胞比值均明显下降,HIFU作用后可明显提高大鼠外周血。T淋巴细胞亚群是机体抗肿瘤免疫的主要免疫细胞,按功能可分为辅助T细胞(T helper cells,Th)、记忆T细胞、细胞毒性T细胞(Cytotoxic T cells,Tc)、调节性T细胞(regulatory T cells,Treg)和抑制性T细胞(suppressor T cell,Ts)[15]。CD4+T 细胞主要为Th细胞,CD4分子主要与MHC-Ⅱ分子相结合,CD8分布于Tc细胞及Ts细胞表面,可以与MHC-Ⅰ分子结合,共同调节细胞的免疫功能[16]。Th细胞可以分泌多种细胞因子,促进其他T细胞的分化成熟,在协助诱导细胞免疫中具有重要作用,还可以辅助B细胞分化为抗体分泌细胞,协助B细胞产生抗体,Tc细胞主要通过分泌各种细胞因子参与免疫作用,清除病毒、肿瘤等靶细胞,Ts细胞则能抑制Th细胞,负向调节细胞的免疫功能[17-18]。已有研究显示[19],CD4+T/CD8+T细胞比值可反映机体的整体免疫功能,提示HIFU作用后,可明显改善宫颈癌大鼠降低的免疫功能。本研究中,宫颈癌大鼠的外周血T淋巴细胞凋亡率明显升高,HIFU作用后可明显降低T淋巴细胞凋亡率。已有研究显示[20],肿瘤细胞可通过诱导T淋巴细胞凋亡,发生免疫逃避或免疫抑制,进行恶性增殖,提示HIFU作用可能通过破坏宫颈癌肿瘤细胞,抑制肿瘤细胞诱导的T淋巴细胞凋亡,改善机体的免疫功能,抑制肿瘤细胞的免疫逃避或免疫抑制,提高其抗肿瘤作用。
综上所述,HIFU可以明显升高大鼠的CD4+T细胞、CD8+T的数量以及CD4+/CD8+T细胞比值,提高脾淋巴细胞活力,改善大鼠降低的免疫功能,延长宫颈癌大鼠的生存时间,但HIFU调节机体免疫功能的具体机制尚不明确,需进一步深入研究探索。
