羊栖菜多糖对3T3-L1前脂肪细胞分化及其相关基因表达的影响※
2020-12-09杨旭东杨骄霞王桂云宋高臣
●杨旭东 石 杰 杨骄霞 王桂云 宋高臣 张 杰▲
脂肪细胞是人体中重要的能量储存库,现代研究表明,脂肪细胞的数目增加、过度分化及代谢紊乱,与糖尿病、冠心病、动脉粥样硬化、肿瘤等疾病密切相关[1]。因此,如何控制脂肪细胞生长和分化已成为治疗相关疾病的作用研究靶点。羊栖菜是一种食用海藻,隶属于褐藻门、马尾藻科、马尾藻属。羊栖菜多糖(Sargassum fusiforme polysaccha-ride,SFPS)从海藻羊栖菜中提取,研究发现其具有降血脂、抗氧化、抗疲劳、抗衰老、增强免疫力等生物活性[2-4],本课题组前期的实验研究发现,SFPS 具有降低糖尿病大鼠血脂、改善胰岛素抵抗等作用[5-6],但SFPS 对脂肪细胞的增殖分化的影响及其机制未见报道。本研究观察SFPS对3T3-L1 前脂肪细胞是否具有抑制增殖分化的作用,并研究其对相关基因表达的影响。
1 材料
1.1 材料与试剂前脂肪细胞3T3-L1 购自美国ATCC公司(批号:62996847);DMEM高糖培养液购自美国Gibco 公司(批号:1782825);Trizol 购自美国Gibco 公司(批号:15596-026);MTT 购自索莱宝有限公司(批号:303H0524);胰蛋白酶购自上海生工(批号:825J041);PPARγ 抗体购自英国Abcam 公司(批号:ab24509);FAS 抗体购自美国CST 公司(批号:31080T);β-actin 抗体购自美国CST 公司(批号:4970T);HRP 标记IgG 二抗购自英国Abcam 公司(批号:ab45966);其他试剂为国产分析纯。
1.2 仪器和设备RCO-3000T-5V CO2恒温培养箱(美国G.S.公司);7500 ABI 荧光定量PCR(美国Bio-Rad公司);UV-5200PC紫外可见分光光度计(上海元析仪器有限公司);Elx808酶标仪(美国Biotek 公司);DYJ-909 倒置显微镜(上海点应光学仪器有限公司);Universal HoodII凝胶成像系统(美国Bio-Rad公司)。
2 实验方法
2.1 SFPS 的制备经200 目粉碎的干燥羊栖菜,先用水煮醇沉法提取[7-8],经3次水煮,3倍体积的95%乙醇沉淀,得到羊栖菜粗多糖(深褐色),然后用Sevag法去除羊栖菜粗多糖中的蛋白成分得到初步纯化的多糖,通过SephadexG200凝胶柱用双蒸水洗脱分离纯化SFPS。用苯酚-硫酸比色法测定多糖含量,以葡萄糖为标准品,测得羊栖菜粗多糖中多糖含量为55.13%。
2.2 细胞培养根据参考文献[9],3T3-L1 细胞培养于DMEM高糖培养基(10%新生牛血清、100mg/L链霉素、100IU/L青霉素),5%CO2培养箱,37℃培养。
2.3 MTT 检测3T3-L1 前脂肪细胞相对增殖率3T3-L1 前脂肪细胞中选取对数生长期的,以1×104/mL 的细胞浓度,接种于96 孔板,培养12h 后,将细胞分为对照组(Control Group)、SFPS 100 mg/L 组(SFPS 100 mg/L Group)、SFPS 200 mg/L 组(SFPS 200 mg/L Group)和SFPS 400 mg/L 组(SFPS 400mg/L Group),每个剂量设6 个平行孔。继续培养24h、48h、72h 后,每孔加入20μL MTT(5g/L)(调零组除外),4h后,弃去上清,加入150μL二甲基亚砜(DMSO),振荡15min,结晶物完全溶解。酶标仪于570nm处比色,测定各孔光密度(OD)值。根据OD 计算细胞相对增殖率(Relative Growth Rate,RGR),按下列公式计算RGR。RGR=实验组OD值/对照组OD值×100%。
2.4 3T3-L1 细胞内总脂质及细胞分化抑制率的测定3T3-L1 前脂肪细胞以1×104/mL 的细胞浓度,接种于96 孔板,将细胞分为对照组(Control Group)、SFPS 100 mg/L 组(SFPS 100 mg/L Group)、SFPS 200 mg/L 组(SFPS 200 mg/L Group)和SFPS 400 mg/L 组(SFPS 400 mg/L Group),每个剂量设6 个平行孔。待细胞生长融合后48h(开始诱导分化,诱导分化第0天),含10%胎牛血清的DMEM 培养液中加入胰岛素(10μg/mL)、IBMX(0.5mmol/L)、地塞米松(1mmol/mL)诱导分化培养2d。弃上清,然后用加入胰岛素(10mg/L)的DMEM 培养液继续培养2d。更换DMEM培养液,继续培养9d,细胞分化基本完成,细胞胞浆中充满脂滴,形状接近圆形。另未分化细胞组(Undifferentiated cell group,UD Group)培养于DMEM高糖培养基(10%FBS),5%CO2培养箱,37℃培养,隔天换液,继续培养9d。在分化第9d,细胞用多聚甲醛(4%)固定30min,加入油红O∶去离子水=3∶2的染料,染色60min,PBS 清洗2 次,显微镜下观察细胞内有红染的脂滴,细胞分化成熟。加入异丁醇250μL,反复吹打振荡5min,溶解油红O 染料,吸取150μL 染料溶解液,酶标仪于510nm,测定各组OD 值,半定量脂肪细胞中总脂质含量并计算细胞分化抑制率。细胞分化抑制率(%)=(OD 对照组-OD 药物组)/OD 对照组×100%。
2.5 SFPS 对3T3-L1 细胞TG 的影响在分化第9d,收集分化成熟的细胞后,用细胞裂解液裂解细胞,离心取上清,按照TG 测定试剂盒说明操作,测定TG含量。于500nm 处测定吸光度值,吸光度值与TG 浓度呈正比,TG单位为mmol/L。
2.6 SFPS对3T3-L1细胞中PPARγ、FAS蛋白表达的影响按照上述方法诱导3T3-L1 前脂肪细胞分化,在诱导分化开始,加入不同浓度的SFPS,每个剂量设6 个平行孔。在分化第9d,收集分化成熟的细胞,测定PPARγ、FAS 蛋白表达量。裂解细胞提取蛋白:加入100μL细胞裂解液,冰上裂解细胞10min,用细胞裂解液裂解细胞提取总蛋白,BCA 法定量。电泳:每组取40μg 蛋白,加样于10%SDS-PAGE 中电泳分离。转膜封闭:电泳结束后,湿式转膜法280mA 70min 转移蛋白至PVDF 膜,5%脱脂奶封闭液,室温封闭2h。特定蛋白测定:分别加入对应的一抗,4℃孵育12h;TBST 洗膜10min×3 次,加入相应的辣根过氧化物酶(HRP)标记的二抗,孵育2h 后,弃去二抗;TBST 洗膜10min×3 次,加入显影剂ECL200mL,定影。用凝胶成像系统进行灰度值分析。
2.7 统计学分析统计学处理采用SPSS 18.0 软件,实验数据以()表示,组间差异比较采用ANOVA检验。以P<0.05为差异有统计学意义。
3 结果
3.1 SFPS 对3T3-L1 前脂肪细胞相对增殖率的影响不同浓度的SFPS 处理3T3-L1 前脂肪细胞24h、48h后,与对照组比较,各剂量组的细胞相对增殖率无统计学差异(P>0.05);而在72h 后,与对照组比较,400 mg/L 组的细胞相对增殖率显著下降(P<0.05)。表明SFPS 在100~400 mg/L 的剂量范围内,培养72h,对3T3-L1的增殖有抑制,但抑制作用不显著。见表1。
3.2 SFPS对3T3-L1细胞总脂质及分化抑制率的影响与对照组比较,不同浓度SFPS作用后,分化成熟的脂肪细胞中总脂质含量显著降低(P<0.01),SFPS 400 mg/L组降低最明显,说明SFPS在脂肪细胞分化过程中能够减少细胞中总脂质含量。并通过测定的OD值,计算出脂肪细胞分化抑制率,SFPS 100 mg/L 组、SFPS 200 mg/L组和SFPS 400 mg/L组的细胞分化抑制率分别为14.51%、21.82%、44.11%。说明不同浓度SFPS 均可抑制脂肪细胞的分化(P<0.01),SFPS 400 mg/L组抑制效果最显著(P<0.01)。见图1。
表1 SFPS对3T3-L1前脂肪细胞相对增殖率的影响(,n=6)
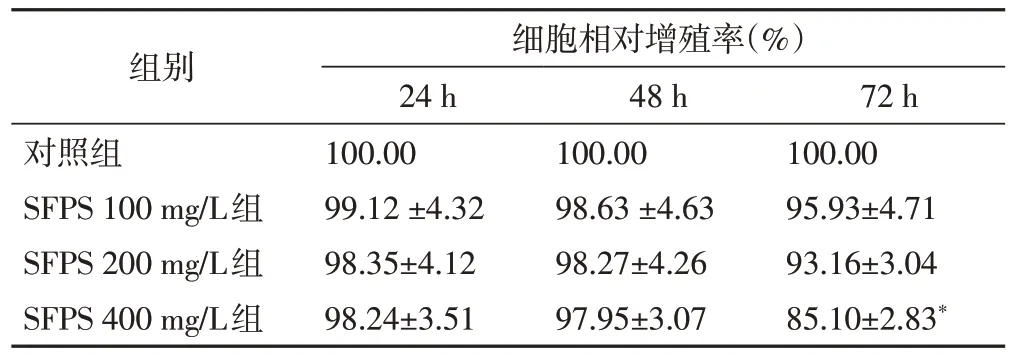
表1 SFPS对3T3-L1前脂肪细胞相对增殖率的影响(,n=6)
注:与对照组比较,*P<0.05
3.3 SFPS 对3T3-L1 细胞中TG 含量的影响与对照组比较,不同浓度SFPS作用后,分化成熟的脂肪细胞中TG含量显著降低(P<0.01),SFPS 400 mg/L组TG含量降低最明显,说明SFPS 在脂肪细胞分化过程中能够减少细胞中TG含量。见图2。
3.4 SFPS对3T3-L1细胞中PPARγ、FAS蛋白表达的影响与对照组比较,SFPS 各剂量组PPARγ、FAS蛋白表达量均显著降低(P<0.01),且PPARγ、FAS 蛋白表达量随着SFPS 浓度的增高而逐渐降低。说明SFPS 在脂肪细胞分化过程中,能够通过影响细胞中PPARγ、FAS 蛋白表达量来抑制3T3-L1 细胞分化。见图3。
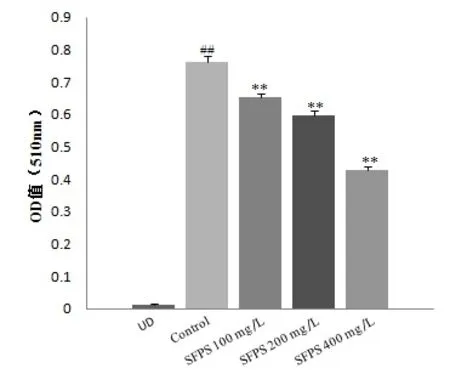
图1 SFPS对3T3-L1细胞中脂质含量的影响

图2 SFPS对3T3-L1细胞甘油三酯含量的影响
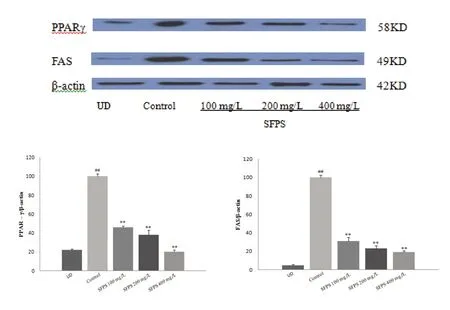
图3 SFPS对3T3-L1细胞中PPAR-γ、FAS蛋白表达的影响
4 讨论
SFPS 是从褐藻门食用海藻羊栖菜中提取的多糖成分,主要包括褐藻淀粉、褐藻糖胶和褐藻酸。SFPS已被证实在脂代谢中具有降血脂、抑制脂质沉积和保护脂肪变的肝细胞等作用[10-11],本课题组前期的实验研究也进一步验证了其在脂代谢中的作用。肥胖、脂肪细胞的过度增殖分化及代谢紊乱与多种疾病相关[12],因此,本实验进一步研究SFPS对3T3-L1前脂肪细胞分化是否具有抑制作用,并初步探讨其作用机制。
前脂肪细胞要经过融合前增殖、接触抑制、克隆扩增、扩增停止四个阶段分化为成熟的脂肪细胞[13],此过程中需要多种转录因子诱导细胞转化,促进脂滴形成。PPARγ属于核内受体转录因子超家族,是众多脂肪分化因子中最关键的,可直接调控脂肪细胞分化,参与脂的代谢[14-15],PPARγ与生理性或药理性配体结合后,改变构象,结合相关DNA上的PPARγ反应元件,从而调节相关基因的转录。PPARγ是脂肪细胞分化过程中必须的转录因子,可进一步调控脂代谢的相关酶的表达。为了研究SFPS 对3T3-L1 前脂肪细胞分化的影响,诱导分化开始,加入不同浓度的SFPS。实验结果显示,在分化第9d,不同浓度的SFPS各组细胞中PPAR-γ蛋白的表达量显著减少。
FAS 是脂肪酸合成的关键酶[16],以乙酰辅酶A 为原料催化生成长链脂肪酸,并进一步形成甘油三酯储存于细胞中。实验研究表明,脂肪组织中FAS 的mRNA 表达量与肥胖是正相关的,抑制FAS的量可以减少脂滴的生成[17-18]。PPARγ是前脂肪细胞分化关键的转录因子,而FAS 出现在分化的中期、后期,属于PPARγ 下游靶基因之一,调节脂类的合成、储存。实验结果显示,在分化第9d,不同浓度的SFPS各组细胞中FAS 蛋白的表达量显著减少,表明SFPS 可通过降低FAS蛋白的表达,抑制3T3-L1中脂质的生成。
本研究结果显示:①SFPS 抑制3T3-L1 前脂肪细胞分化,减少脂肪细胞中总脂质及TG的含量,浓度越大,抑制作用越明显。②SFPS 可以明显下调3T3-L1细胞PPARγ蛋白的表达,降低FAS蛋白的表达。实验结果提示,SFPS 抑制3T3-L1 前脂肪细胞分化的分子机制可能与调控PPARγ和FAS蛋白的表达有关。
