明胶基骨粘合剂在外科手术中的应用研究
2020-12-08朱艺丹
朱艺丹

摘 要:骨组织是由有机和无机成分组成的复合材料。在外科手术中常常需要涉及到骨骼的固定和修复,传统的植入钢钉固定连接方法不仅与组织不相容,增加感染风险而且需要二次去除,给患者增加额外痛苦,而采用生物友好型的骨粘合剂则有效的避免了上述弊端,且骨粘合剂在对骨组织进行粘接后,随着骨组织的愈合,降解为无毒产物。文章旨在概述骨粘合剂的发展、现状和当今的知识的基础上。指出明胶基复合材料具有良好的生物相容性,可降解性,能够很好的运用于骨组织修复和骨粘合剂中。在基础研究人员和外科医生的共同努力下,这一课题取得了巨大的进展。结果表明,人工合成生物材料的应用将在未来的骨科手术中取得成功。
关键词:骨粘合剂; 明胶; 降解性; 生物相容性
中图分类号:TQ431.3;R318.08 文献标识码:A 文章编号:1001-5922(2020)10-0005-05
Abstract:Bone tissue is a composite material composed of organic and inorganic components. In surgical operations, the fixation and repair of bone are often involved. The traditional fixation and connection method of implanted steel nail is not only incompatible with the tissue, increasing the risk of infection, but also needs to be removed twice, which causes extra pain to the patients. However, the use of bio-friendly bone adhesive can effectively avoid the above disadvantages, and after the bone adhesive is bonded to the bone tissue, it degrades into a non-toxic product as the bone tissue heals. The following paper aims to summarize the development, current situation and current knowledge of bone adhesives. It is pointed out that gelatin-based composite materials have good biocompatibility and degradability, and can be used in bone tissue repair and bone adhesive. With the joint efforts of basic researchers and surgeons, great progress has been made in this subject. The results show that the application of synthetic biomaterials will be successful in the orthopedic surgery.
Key words:bone adhesive; gelatin; degradability; biocompatibility
0 引言
開发骨粘合系统的第一次尝试来自埃及,已有4000多年的历史。几个世纪后的1772年,巴黎石膏被引进,至今仍被用于骨折固定。其他的如环氧树脂,氰基丙烯酸酯,聚氨酯和纤维粘合剂。但这些探索多以失败告终,因为它们不符合医学要求,如生物相容性、储存期间的稳定性、对人体无毒性、可消毒、易于使用、可吸收和降解、能在潮湿环境中固化。
尽管这一领域的研究由来已久,目前尚未找到一种有效运用于临床上适用的替代方法。而明胶基复合材料,能够快速地粘合组织,即使在有水分的情况下,作为一种外科粘合剂和止血剂取得了良好的应用效果,具有良好的生物相容性,粘接能力以及可降解能力,被认为是最有可能运用于骨粘合剂的实际应用中。文章概述了骨粘合剂的要求、发展历史、现状和研究成果总结,指出明胶基复合材料具有良好的生物相容性,可降解性,能够很好的运用于骨组织修复和骨粘合剂中。
1 医用骨粘合剂发展历史
一个多世纪前,柏林的Gluck提出了利用生物材料进行骨结合的想法,当时他将软组织与鸡血衍生物结合,将骨组织与“litocolle”结合。他报告了用树脂、浮石和巴黎石膏制成的骨胶。第一种骨粘合剂是在1931年由Hedri描述的。他把胶原蛋白和纤维蛋白的混合物称为“骨细胞”。这种“骨细胞”促进骨折愈合并展现了良好的初始结合强度,但严重的过敏反应阻止了其使用。
1.1 环氧树脂
在1958年报告了一例用环氧树脂在人体内固定植入物的病例,据了解,这种植入物已经放置了10多年。然而,由于这些材料,特别是硬化剂的毒理学性质可疑,已发表的研究很少。在另一个用环氧树脂材料粘合植入物的实例中,这种材料能够承受一定的外力,从而在不锈钢假体中产生弯曲,而不会导致粘接断裂。在矫正假体的手术中,髓质没有反应。在随后的死后检查中,假体附近的组织含有双折射材料、纤维组织、一些滑膜衬里和许多巨细胞。在这种情况下,使用了带有聚酰胺硬化剂的传统树脂,因为人们认为这克服了对这些材料可能毒性的反对意见。进一步研究表明,环氧树脂材料存在难以吸收以及不利于愈合的缺陷。环氧树脂会在粘合剂周围引发纤维囊,起到阻碍骨痂形成的作用,不会因水分、脂质或血液而粘附在骨骼上,并因聚合热而导致组织坏死。
1.2 聚氨酯泡沫
1959年,一种叫做“Ostamer”的聚氨酯泡沫被开发出来。最初,它被认为是可生物降解的,并且具有适当的孔径以允许骨生长,提供良好的初始粘附性,并且被组织很好地耐受。在相关的研究报道中,详细介绍了6例3年~ 4个月的成功病例,其中采用硬质聚氨酯泡沫塑料填隙,夹板固定骨折骨。该材料是由异氰酸酯和多元醇组分混合加热而成。不幸的是,其他在动物和人类病例中使用这种材料的经验非常不令人满意。聚合温度高达70℃,附着力弱,吸收慢。许多研究观察到假关节炎、感染、组织坏死和瘢痕形成延迟。虽然在某些情况下获得了成功的结果,但高百分比的失败表明,材料本身可能存在变异性,随之产生的毒性以及操作的临界性。这导致了强烈的反作用。
1.3 氰基丙烯酸酯
氰基丙烯酸酯胶粘剂是由开发于1959年。它们巨大的结合强度和在潮湿环境中的结合能力立即引起了医学界的关注。通过改变所附烷基链的长度,可以合成各种有用的2-氰基丙烯酸酯。一般来说,在空气中用较短的烷基链氰基丙烯酸酯进行聚合更快,但由于表面的良好润湿性,聚合速率和组织中的结合强度随着烷基链长度的增加而增加。
1.4 聚甲基丙烯酸甲酯(PMMA)
自20世纪30年代以来,聚甲基丙烯酸甲酯(PMMA)已广泛应用于牙科和骨科手术中,用于修复体的密封。这不是真正的粘连,但与松质骨紧密相连。研究表明,只要骨折表面没有被完全封闭,人类骨折就可以在PMMA周围愈合。这促使PMMA在各种骨折情况下的应用,其中PMMA被用作常规固定的空间填充物或加固物。PMMA也被认为是一种主要的内固定方法。使用液体丙烯酸树脂、磷酸蚀刻或三丁基硼烷也提高了PMMA与骨的粘合质量。大多数研究显示这种材料可以使骨折具有良好的固定强度和充分的愈合。虽然在下颌骨骨折、脊柱骨折和孤立性长骨骨折中有良好的结果,但晚期移位和不愈合阻止了它们推荐作为骨粘合剂的使用。
1.5 纤维蛋白粘合剂
纤维蛋白粘合剂的使用始于1940年。目前它们是最流行的软组织粘合剂。大多数纤维蛋白粘合剂系统由含有纤维蛋白原、凝血酶、钙和因子XIII的混合物组成。因子XIII被认为是体内成功粘附的必要稳定剂。同源纤维蛋白原治疗效果较好。
博世公司对纤维蛋白凝块作为粘合剂的体外特性进行了广泛的研究。其研究的纤维蛋白粘合剂(通常缩写为FKS,来自德国的“纤维蛋白klebesystem”)在欧洲已被广泛用于普通外科、眼科、耳鼻咽喉、泌尿外科和神经外科等等。除了用作粘合剂外,纤维蛋白粘合剂还被证明有助于止血和加速愈合,可通过增加骨移植、皮质骨愈合、肌腱修复和截骨术中的血运重建率。一些研究表明纤维蛋白粘合剂在组织中具有良好的耐受性。
1.6 明胶间苯二酚醛
这种材料的基础是明胶的性质与结缔组织相似,并且本身具有粘性。明胶与甲醛和间苯二酚交联以提高耐水性和强度,制备出一种粘合剂,该粘合剂通过与甲醛交联而与湿组织结合。动物研究结果表明,GRF组分既可用作组织粘合剂,也可用作止血剂。组织刺激性低于氰基丙烯酸酯,尽管这仍然带来一些问题,特别是在血管闭合方面。这种材料在体外的结合强度优于甲基氰基丙烯酸酯。具有优异的拉伸强度和组织相容性。但是,使用这种材料在家兔的脾-肝接合手术实验中发现,与传统缝合方法中脾-肝之间很快建立了血管连接相比,在使用这种材料作为粘合剂时,家兔没有获得脾-肝血管连接,这容易导致器官因缺血而坏死。说明这种粘合剂在实际应用上仍存在一定的问题。
1.7 低聚聚内酯胶粘剂
脂肪族羟基羧酸衍生的生物可降解聚酯已被开发用于外科缝线、药物递送装置、组织支架和骨内固定植入物等医疗应用。这些材料大多是由高分子量线性聚酯,如聚乳酸、聚乙醇及其共聚物制成。低聚物酯的研究较少,因为这些低聚物通常不具备缝合或植入所需的机械和热性能。
2 试验方法
在葡聚糖主链上化学修飾引入2-异氰酸酯-甲基丙烯酸乙酯(IEMA)光交联乙烯基,高碘酸钠与邻二醇和明胶氧化反应引入醛基,不仅可以形成分子间网络,还可以形成分子间网络通过醛基增加组织交联。同时测定体系的物理性能(粘接强度、溶胀率)。观察水凝胶对细胞的粘附和增殖作用。表明该材料能够有效应用于骨粘合剂中。
2.1 材料
右旋糖酐(Mw 20 kDa)购自国药化学试剂有限公司(中国上海)。2-异氰酸酯甲基丙烯酸乙酯(IEMA)购自中国上海金瑞化学试剂有限公司。以二月桂酸二丁酯(DBTL)为催化剂,从阿拉丁试剂公司(中国上海)采购,光引发剂2-羟基-1-[4-(羟基乙氧基)苯基-2-甲基-1-丙酮,二甲基亚砜等试剂均来自北京化学试剂有限公司(中国北京)。
2.2 光交联明胶复合材料的制备
采用前驱体溶液光交联法制备水凝胶。分别以5%的明胶和一系列浓度为15%、25%、35%、45%的Dex-U-AD浓度在PBS中制备递推溶液,制备出Dex-U-AD/明胶水凝胶。具体步骤如下:在40℃水浴下将溶液剧烈搅拌10min,然后添加1%的光引发剂Irgacure 2959(I-2959)。光引发剂的最终浓度保持在1wt%。均匀化后,将溶液注入模具。该系统在紫外光源(320~480nm)下照射,导光板与样品之间的距离固定在44mm,光强调整为5、10、15、30和50mW/cm~2。
2.3 粘合强度的测量
将20%明胶溶液均匀地涂在玻璃片表面,模拟活体组织。一块玻璃的尺寸为5mm×20mm×50mm。在70℃干燥20min后,玻璃表面有一层均匀的明胶。然后,将玻璃片叠放在10mm内,将Dex-U-AD溶液分散在其中,粘合面积为20mm×10mm。用30mw/cm~2的紫外光照射10min,使DexU在明胶片之间交联。采用美国Instron公司的1185型万能试验机,在室温下以5mm/min的十字头速度对紫外光固化后的玻璃样品进行测试。每个实验测量5个样品。
2.4 溶胀动力学的测定
干凝胶(重量W0)在37℃下浸入PBS中,并在一定时间间隔内持续振荡。去除多余的表层水后,测量膨胀水凝胶(Ws)的重量,直到不再检测到重量变化为止。
2.5 细胞毒性分析
采用ISO10993-5标准试验方法,在DMEM培养基中培养小鼠成纤维细胞(L929),加入10%胎牛血清、1.0%青霉素链霉素和1.2%谷氨酰胺。培养物主要保存在37℃、含5%二氧化碳的潮湿大气中。当细胞达到80%汇合时,用含1×103m乙二胺四乙酸(EDTA)的0.25%胰蛋白酶进行胰蛋白酶化。
用MTT法(3 - [ 4-二甲基噻唑-2-基] - 2,5 -二苯基四唑溴;噻唑蓝)测定细胞活性。MTT法:用高压蒸汽对厚度为0.2 mm(不含醋酸)的薄膜进行消毒15min,置于24孔培养板上。然后将样品在37℃的1mL DMEM培养基中培养24h。提取率为100 mg/mL。在此期间结束时,去除薄膜,获得所谓的提取物。L929细胞接种于96孔板上,每孔103个细胞。培养24h后,取出培养基,用已制备好的提取液代替,再培养24h,然后向每个孔中加入100μLMTT溶液。在37℃孵育4h后,加入200μL二甲基亚砜以溶解福尔马赞晶体。用振动筛均匀旋转溶解溶液约10min。用ELISA阅读器(芬兰Labsystem公司的Multiscan MK3)在570nm处检测福尔马赞溶液的光密度。
3 结果和讨论
3.1 粘结强度分析
图1(a)表明,随着DO的增加,凝胶的粘合强度显著提高。醛基不仅增加了Dex- U-AD与明胶的交联密度,而且提高了胶粘剂的粘接力,随着醛含量的增加,凝胶的粘结强度最终达到饱和。用30 wt%(25%Dex-U-AD+5%明胶)Dex-U-AD/明胶的溶解氧(DO)为41.6%表征了这种饱和状态,得到的最高断裂强度为4.16mpa,是Dex-U体系相同含量时的2倍。图1(b)~(d)表明5%的明胶有助于提高粘合强度。特别是当凝胶的固含量达到30%(25%Dex-U-AD)时,Dex-U-4(DO:22.82%)/明胶(4.16±0.72mpa)和Dex-U-8-AD(DO:10.95%)/明胶凝胶(3.46±0.032mpa)比Tisseel(0.05mpa)高83倍。
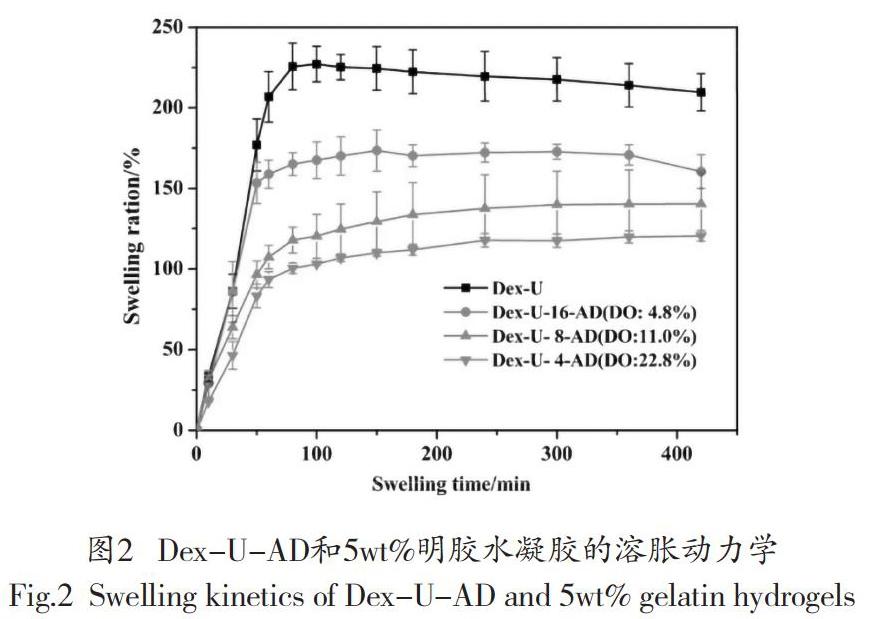
3.2 溶脹动力学
未添加明胶的Dex-U-AD水凝胶由于膨胀率高和机械强度差而破碎成不同大小的碎片。它不能以不规则的形状精确称重。图2显示了Dex-U-AD/明胶水凝胶在pH7.4的PBS中的溶胀动力学。随着醛含量的增加,Dex-U-AD/明胶水凝胶的最大溶胀率降低。当固定总固形物含量为25 wt%的Dex-U-4-AD(DO:22.82%)和5 wt%的明胶时,在100 min时,Dex-U-4-AD(DO:22.82%)凝胶的固形物含量从227±11%显著降低到103±0.77%。
溶胀率对交联密度、凝胶组成和电荷密度有较大影响。溶胀率的下降归因于与其他互穿明胶的席夫反应。因此,醛基含量越高,交联密度越高,说明平衡溶胀率越低。
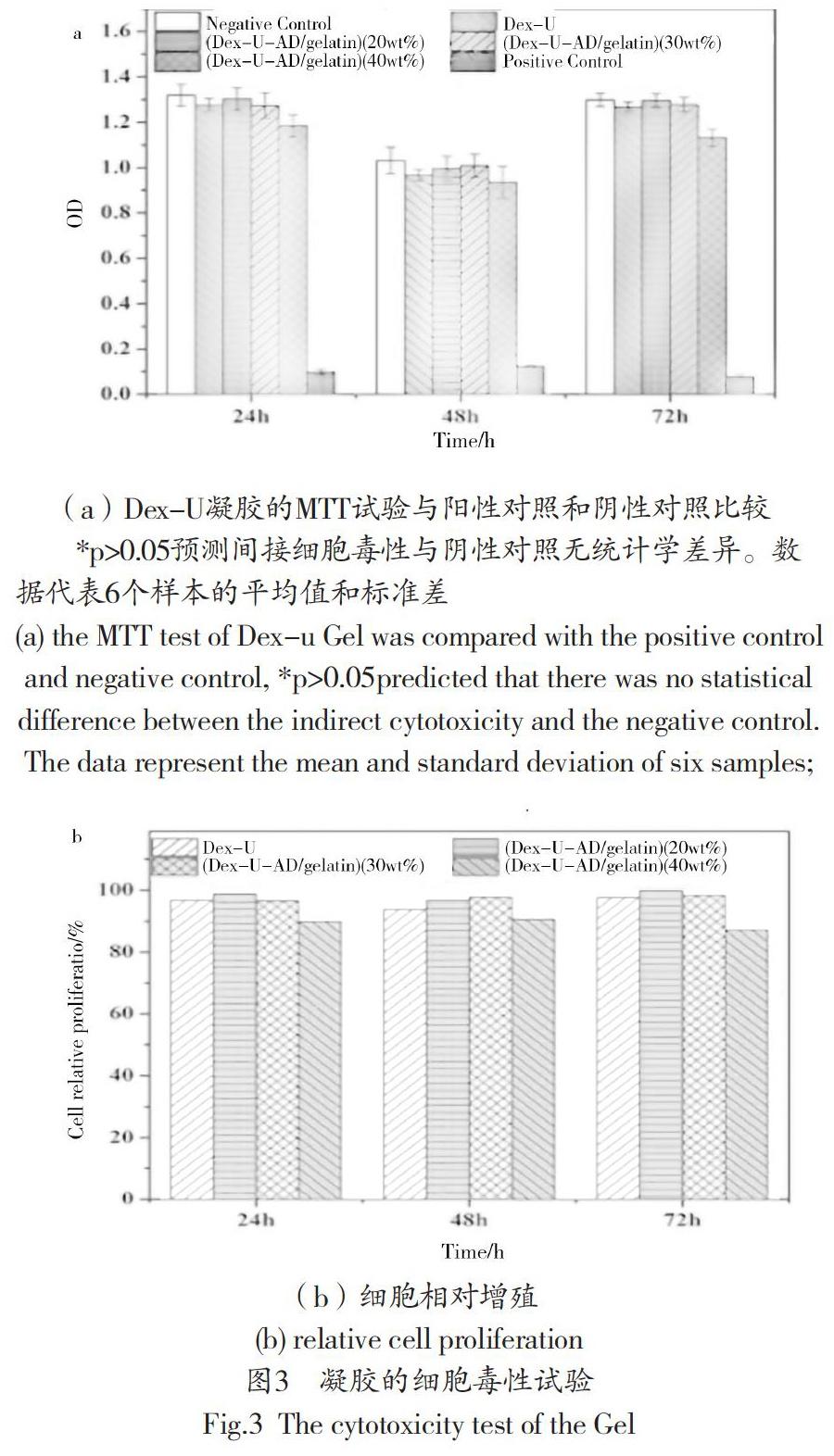
3.3 细胞毒性分析
毒性试验是生物材料的一个重要方面。理想的生物粘附剂不应释放毒性产物或产生对抗性作用,可通过体外细胞毒性试验进行评价,是生物材料的一项基本性能。图3所示为小鼠成纤维细胞(L929)的MTT法测定所得的吸光度,该细胞是用不同类型标本的提取液培养的。L929细胞活性在72h内,除Dex-U-AD/明胶(40 wt%)外,大多数水凝胶提取物与阴性对照组比较,差异无统计学意义(p<0.05),72h内细胞活力与对照组相比无统计学差异(p>0.05),但细胞活力仍达到阴性细胞的85%左右控制。这表明Dex-U-AD/明胶对L929细胞的毒性较小。
4 结语
尽管在过去的10年里在组织和骨粘合剂方面做了大量的工作,但是很明显,成功的骨粘合剂的发展还处于早期阶段。环氧树脂、氰基丙烯酸酯、聚氨酯等材料的研究,由于强度不够和生物相容性差,一直没有得到证实。然而,这一概念似乎是切实可行的,开发一种具有快速有效作用、相对无毒的材料应该是可能的。此外,这种粘合剂还可以作为药物的培养基,类似于今天使用的抗生素骨水泥。
参考文献
[1] 李均明,张姣,王爱娟,等.医用骨粘合剂粘接性能研究进展[J].材料导报,2013,27(13):145-147.
[2] 梁仟,朱飞燕,黄江鸿,等.纳米骨粘合剂在骨折固定中的研究进展[J].生物骨科材料与临床研究,2018,15(03):66-70.
[3] 罗洁. 基于人血清白蛋白与明胶的医用软组织粘合剂的研究[D].济南:山东大学,2014.
[4] Ranganathan S, Balagangadharan K, Selvamurugan N. Chitosan and gelatin-based electrospun fibers for bone tissue engineering[J]. International journal of biological macromolecules, 2019.
[5] Raucci M G, D'Amora U, Ronca A, et al. Bioactivation routes of gelatin-based scaffolds to enhance at nanoscale level bone tissue regeneration[J]. Frontiers in bioengineering and biotechnology, 2019, 7:27.
[6] Aldana A A, Abraham G A. Current advances in electrospun gelatin-based scaffolds for tissue engineering applications[J]. International journal of pharmaceutics, 2017, 523(2):441-453.
[7] Lin W H, Yu J, Chen G, et al. Fabrication of multi-biofunctional gelatin-based electrospun fibrous scaffolds for enhancement of osteogenesis of mesenchymal stem cells[J]. Colloids and Surfaces B:Biointerfaces, 2016, 138:26-31.
[8] Saravanan S, Leena R S, Selvamurugan N. Chitosan based biocomposite scaffolds for bone tissue engineering[J]. International journal of biological macromolecules, 2016, 93:1354-1365.
[9] Liu M, Zeng X, Ma C, et al. Injectable hydrogels for cartilage and bone tissue engineering[J]. Bone research, 2017, 5(1):17014.
