口腔癌合并全身系统性疾病患者的多学科协作诊疗模式专家共识
2020-12-08张东升郑家伟张陈平蔡志刚李龙江廖贵清尚政军孙沫逸韩正学尚伟孟箭0龚忠诚黄圣运
张东升 郑家伟 张陈平 蔡志刚 李龙江 廖贵清 尚政军孙沫逸 韩正学 尚伟 孟箭0 龚忠诚 黄圣运
1.山东第一医科大学附属省立医院口腔颌面外科,济南 250012;2.上海交通大学附属第九人民医院口腔颌面-头颈肿瘤科,上海 200011;3.北京大学口腔医学院口腔颌面外科,北京 100081;4.口腔疾病研究国家重点实验室 国家口腔疾病临床医学研究中心四川大学华西口腔医院头颈肿瘤外科,成都 610041;5.中山大学附属口腔医院口腔颌面外科,广州 510120;6.武汉大学口腔医院口腔颌面外科,武汉 430070;7.空军军医大学第三附属医院口腔颌面外科,西安 710032;8.首都医科大学附属北京口腔医院头颈肿瘤科,北京 100050;9.青岛大学附属医院口腔颌面外科,青岛 266003;10.徐州市中心医院口腔科,徐州 221009;11.新疆医科大学第一附属医院口腔颌面外科,乌鲁木齐 830054
头颈部是肿瘤的好发部位,其中口腔癌和咽癌是全球十大恶性肿瘤之一,约占全身恶性肿瘤的7%。根据世界卫生组织的预测,在未来70年内,其发病率将持续上升[1-2]。随着双向转诊、分级诊疗制度的建立和医联体的组建,大型综合医院在急危重症和疑难疾病的诊疗上承担着重要的职责,前来就诊的口腔癌患者尤其是老年患者通常伴有全身系统性疾病,病情更加复杂,传统单一诊疗模式已经难以满足治疗需求。为此,多学科协作诊疗(multidisciplinary team,MDT)模式应运而生。
MDT是指由多个关联学科专家构成的医疗团队针对一种或几种相关疾病开展临床会议讨论,进而提出针对性诊疗意见的模式[3]。该治疗模式在许多拥有相对集中医疗中心的国家已经得到广泛开展并日趋完善,成为国家医疗体系的重要构成[4-6]。与传统不同,MDT不是将几种治疗方法进行机械地组合,而是一种依托于MDT并将患者作为中心多方面诊疗相结合的模式。
口腔作为消化道和呼吸道的起点,一旦产生癌变将影响众多相关功能器官,进而引发或加重患者的全身系统性疾病;伴发全身系统疾病的患者,其全身病情不仅会影响口腔局部病变的发展,更加大了口腔癌治疗的难度。因此,伴有全身系统疾病的口腔癌患者的治疗方案不同于简单的口腔癌综合序列治疗,其过程常需不同科室根据专业要求给予相应检查及后继治疗方案。普通诊疗模式下患者往往要经多次转诊或者会诊,期间各专业在诊治计划上可能出现一定的分歧,造成患者诊疗时间延长,甚至影响最终治疗效果。MDT模式以患者为中心,通过多学科专业人员的有效结合,系统化提高会诊效率,缩短诊疗周期,提高诊疗效果,降低医疗成本。
MDT不仅是口腔癌患者获得全方位个体化高质量规范诊疗的根本保障,同时对医学教育与科研同样有所帮助,有助于推进人才培养和科研团队协作,为学科发展注入活力。随着医疗中心逐步构建,综合性医院在条件允许情况下均应开展构建MDT诊疗机制,从而达到医患双方双赢的目的。然而,由于我国人口众多、医疗资源分布不均等医疗现状,目前MDT模式还远未得到普及开展,其组织模式和管理运作有待进一步规范和完善,尚缺乏相应的临床应用指南,无最新文献和指南支持的MDT只能原地踏步。因此,制订口腔癌伴全身系统疾病的相关MDT专家共识具有重要临床意义。笔者在参阅国内外MDT相关文献资料的基础上,结合我国的医疗现况与已有临床经验,组织相关专家讨论并制订口腔癌合并全身系统性疾病患者的MDT临床应用专家共识,旨在推广和规范MDT诊疗模式的临床应用,以供广大一线医师参考借鉴。本共识未来也会根据国内外MDT的研究进展进行定期更新。
1 MDT机构的设立
MDT是以包含多个健康专业人士的团队与一个共同讨论、决策的平台为核心的有组织系统。MDT组员可依据职责功能分为牵头人、参与专家及协调员[3,7]。患者来诊后以主诊科室的专家作为MDT牵头人根据患者需要安排检查并上报MDT会诊中心进行预约,由专门的协调人员负责邀请相关领域专家进入团队,收集患者相关资料信息并安排会诊时间,于专门场地进行统一会诊,相关会诊结果及临床资料由MDT会诊中心进行记录备份并统一管理。目前,随着数码信息发展,利用云平台,将相关患者数据资料整理并上传至线上,实行线上线下统一管理,可以更加方便各参与科室及时了解患者动态,进行实时交流沟通,定期回访、查阅相关病例资料等。同时,积极鼓励基层医院及口腔专科医院参与到医联体构建中来,形成以大型综合医院为中心辐射带动周边的合作医疗模式,依托医联体与大数据平台,不仅可实行远程会诊,扩大专家团队范围,整合优化医疗资源,更有利于信息资源共享,带动学科发展,是MDT组织结构进一步发展的方向。
2 MDT模式适应证
根据口腔癌临床诊断、位置、大小、转移以及病理表现等多种因素,结合患者全身系统疾病情况综合制订MDT治疗方案。目前,临床考虑运用单一治疗方式在清除病灶、减少并发症、提高生存质量等方面并不理想的口腔癌患者均建议在MDT模式下进行诊治。尤其是对于大部分晚期或复发的口腔癌患者、伴有多种全身系统性疾病的患者、全身情况欠佳的患者以及病变累及范围较广的患者,都应考虑进行MDT[7-8]。同时,本共识鼓励各医疗中心根据临床情况,积极探索MDT模式的适用范围,在多学科团队的指导下开展前瞻性临床研究,并鼓励患者积极参与到个性化的MDT诊疗中来。
3 MDT模式诊疗流程
MDT通常由患者首诊科室或住院科室牵头组织,采用入院前MDT与住院后MDT相结合的方式,制订诊疗流程[8]。不同于传统的专家会诊,MDT使得不同学科的医师能够一起分析讨论患者相关病例资料,发挥多学科优势,将各学科相关知识与经验进行汇总,优化治疗过程连续性,制订出个性化、规范化、高效化的最佳综合诊疗方案,从而充分实现患者个体利益最大化。
3.1 入院前MDT
对于门诊首诊且符合纳入标准的患者,首诊医师应首先评估患者病情,进行必要的相关检查,根据病情及检查结果,牵头组织相关科室进行入院前MDT(图1)。牵头人在口腔癌的 MDT诊疗中,需了解各个相关学科的特点,从而明确入院前MDT的参与科室,并综合运用各种治疗理念和临床经验,为最终方案的制订和各科室平稳过度奠定基础,一般由经验丰富的外科医师担任。确定参与科室后,由专门的协调人员组织各科室专家在MDT会诊中心进行会诊,详细记录各学科专业诊疗意见,定期随访观察治疗效果[7],必要时复查结果后进行客观评估。根据患者情况及治疗方案,决定患者是否办理入院。若需入院治疗,入院后仍需监测相应系统性疾病的病情变化,并继续组织住院患者的MDT。
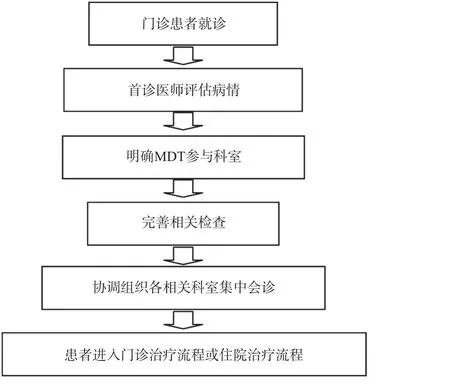
图1 入院前口腔癌患者MDT流程图Fig 1 Flow chart for MDT consultation of patients with oral cancers before hospitalization
3.2 住院后MDT
患者住院后,针对不同病情,MDT 团队可以分为核心诊疗小组与拓展诊疗成员(图2)。口腔癌患者住院后MDT的核心团队通常由口腔颌面外科、肿瘤放化疗科、医学影像科、麻醉手术科、介入科、病理科、康复科、专科护理等共同构成;在此基础之上,根据患者全身系统性疾病,联系不同学科专业,包括但并不局限于心脏内科、内分泌科、神经内科、肾内科、风湿免疫科、呼吸科、消化科、外科重症监护室等。各学科专业充分评估口腔癌及合并的全身系统性疾病,影像科、病理科专家阅片后分析肿瘤分期,外科医师决定根治性手术的可行性和手术方式,肿瘤放化疗科专家制订放疗剂量和化疗方案,康复科专家根据患者病情特点提供全程康复支持,老年科针对高龄患者进行综合分析并跟踪指导等。专家团队共同确定围术期诊疗及监测方案,保证手术的顺利实施和围术期安全。同时,根据患者病情变化,必要时可组织多次住院患者MDT,随时调整诊疗方案。
4 MDT模式临床应用
目前,临床上常见的口腔癌患者合并全身系统性疾病有高血压、糖尿病、冠心病、呼吸系统疾病、血液系统疾病等。共识针对口腔癌患者癌变区域及部分常见系统性疾病的MDT诊疗进行总结如下。
4.1 口腔癌合并系统性疾病的安全治疗原则
目前,以手术为主的综合序列治疗在口腔癌治疗中得到广泛认可。对于早期或局部晚期但可切除的口腔癌患者,首选手术治疗,依据TNM分期及临床有无危险特征综合考虑应用放疗或化疗进行辅助;对于晚期但可切除患者,考虑术前化疗保存器官;对于T4NX但仍可手术的患者也可选择放疗或化疗;对不能手术切除的晚期、转移或复发患者,考虑化放疗或单纯放疗[8-9]。当患者合并系统性疾病时,围术期还应通过MDT全面了解患者全身系统情况,制定局部治疗计划时加强综合考虑,预防或降低并发症的发生。尤其是针对身体耐受较差的患者,应以口腔癌治疗原则为基础,结合MDT各相关科室诊疗意见,适当调整治疗计划。手术尽可能选择创伤更小的修复重建方式,邻位组织瓣、组织补片等能获得良好修复效果时可代替游离皮瓣,减少术中失血,缩短手术时间;局麻及镇静药物可以达到手术需要时,可以替代全麻;由于口腔癌手术多涉及舌、口底、口咽部等上呼吸器官,易发生呼吸道梗阻,因此针对合并系统性疾病的口腔癌患者,其预防性气管切开指征可相应放宽,以保证术后的呼吸平稳过渡;合并系统性疾病的口腔癌患者术后易发生进食困难,需注意术后营养支持。相关手术科室应根据MDT情况,灵活应用不同治疗方式,制定个性化的具体治疗措施,以保障患者得到针对性治疗。

图2 入院后口腔癌患者MDT流程Fig 2 Flow chart for MDT consultation of patients with oral cancers after hospitalization
4.2 高血压
4.2.1 纳入标准 术前,患者符合以下2条中的1条,即可诊断:1)既往经由心脏内科诊疗并明确病史者;2)既往病史未明或血压偶有超标升高,住院后测量血压连续2次以上升高幅度大于基础血压的30%,或收缩压≥18.66 kPa或舒张压≥12.00 kPa者。
4.2.2 围术期处理 口腔癌患者术前出现血压升高的情况常与其基础血压及受刺激程度有关,应进行血压动态监控。年龄<60岁的患者,血压应控制<18.66/12.00 kPa;年龄≥60岁者,如不伴糖尿病、慢性肾病等,收缩压应<19.99 kPa;高龄(>80岁)患者,收缩压应维持在18.66~19.99 kPa;如伴糖尿病、慢性肾病等,血压控制目标<18.66/12.00 kPa[10-11]。建议推迟患者手术入室后血压>23.99/14.66 kPa的择期手术;如有明确手术指征(如伴出血的肿瘤),必须征得知情同意方可进行手术。对无高血压病史的患者,术前轻、中度血压升高(收缩压18.66~23.85 kPa,舒张压12.00~14.53 kPa),原则上不影响手术进行[12],可严密观察,不急于处理,情绪安抚、消除紧张状态后血压多可恢复正常。若患者高血压病史明确,且治疗规律、控制稳定者,可继续沿用目前治疗方案。对控制不良者,则可组织住院患者MDT,对患者进行针对性血压调控。术前常以药物治疗,包括β受体阻滞剂(如比索洛尔等)、钙拮抗剂(如硝苯地平等)、血管紧张素Ⅱ受体拮抗剂(angiotensin receptor blockers,ARB,如缬沙坦等)和血管紧张素转换酶抑制剂(angiotensin converting enzyme inhibitors,ACEI,如卡托普利等)等[13]。根据MDT方案,选用其中的1种或几种药物联合治疗,并全程依据血压及心率变化情况及时对药物种类或剂量进行调整。手术当天可晨服降压药,防止麻醉诱导插管等刺激引起血压突然升高。
术中常通过静脉药物降压,即刻目标是使舒张压在30~60 min内降至14.66 kPa或较之前取得10%~15%降幅,但不应达到25%。如患者耐受情况良好则可将其血压在2~6 h内逐步降低至21.32/13.33 kPa[11]。术后第1天可恢复术前降压方案,因头颈部手术患者术后多经胃管进食,降压药物也应从胃管给入。期间注意控制补液量与速度,防止因过量或过速补液影响血容量进而导致血压上升;注意镇痛,减少疼痛引起的血压一过性升高。头颈部患者手术位置特殊,易出现呼吸道梗阻,要密切关注呼吸道,积极给氧,防止低氧血症性升压。
4.3 冠状动脉粥样硬化性心脏病(冠心病)
4.3.1 纳入标准 1)既往经由心脏内科诊疗并明确病史者;2)既往病史未明,住院后行心电图、心脏彩超、冠状动脉CT及动态心电图(Holter)等相关检查见冠脉病变由心脏内科会诊为冠心病者。
4.3.2 围术期处理 目前冠心病临床上主要分为慢性心肌缺血综合征和急性冠状动脉综合征[14]。围术期刺激会导致患者心肌耗氧量增加、供血不足进而诱发心血管风险。欧洲心脏病学会将不同手术围术期发生心脏并发症的风险分为:低风险、中等风险、高风险。多数患者在病情稳定时不必额外评估即可接受中低风险型手术;针对情况复杂者则需要MDT综合性评估,优化围术期药物使用以减少并发症等情况。
术前,患者若已经使用β受体阻滞剂或他汀类药物进行治疗,围术期可继续服用,未使用者可加用。应从手术2 d(最好1周)前由小剂量开始使用β受体阻滞剂治疗,依血压心率变化调整药量最终达到目标心率60~80次·min-1且维持收缩压>13.33 kPa。术后继续应用。应用他汀类药物治疗目标与普通冠心病患者相同,低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)应控制在<1.8 mmol·L-1且非高密度脂蛋白胆固醇(non high-density lipoprotein cholesterol,nonHDL-C)<12.6 mmol·L-1或低于LDL-C基线水平50%。左心室功能不全患者应尽可能推迟手术,明确原因并针对性治疗。必要时,应用ACEI或ARB,密切监控血压及心率变化。缺血性心绞痛者可在避免血压过低的同时以硝酸酯类进行治疗[14]。抗血小板药(如阿司匹林)及抗凝药物(如华法林),则需均衡评估出血或血栓风险后针对性选择应用与否。桥接抗凝是目前普遍应用的用药方式,即短期内将口服抗凝药停用改为使用短效抗凝药(如低分子肝素)注射,避免围术期血栓形成的同时减少术中出血。推荐术前5 d停药,选择皮下注射低分子肝素过渡性治疗,术前24 h进行最后一次注射,术后第1天重启华法林抗凝治疗[15]。对于介入治疗术后的冠心病患者,术前除非阿司匹林相关的手术出血有致命风险,否则推荐手术置入裸金属支架(bare metal stent,BMS)时使用阿司匹林4周,置入药物洗脱支架(drug eluting stent,DES)时使用3~12个月;若手术没有因P2Y12受体拮抗剂引发的致命性出血风险,推荐BMS置入者应用该药物4周、DES置入者应用该药物3~12个月。术中采用动态心电监护,静脉用药,将血压及心率维持在相对稳定的状态。术后仍采用动态监护,根据心律、血压和血氧饱和度,及时调整用药,同时加强镇痛治疗;可通过患者自控的静脉持续镇痛,降低术后应激反应,从而更好地维持机体内环境稳定[16]。
4.4 糖尿病
4.4.1 纳入标准 1)既往糖尿病诊断明确者;2)既往病史未明,住院后空腹血糖异常,满足以下3个条件中的1项者即可诊断:①空腹静脉血糖值(fasting plasma glucose,FPG)≥7.0 mmol·L-1;②口服糖耐量试验(oral glucose tolerance test,OGTT)2 h静脉血糖值≥11.1 mmol·L-1;③随机静脉血糖值≥11.1 mmol·L-1[17]。
4.4.2 围术期处理 糖尿病患者围术期若不能得到合理治疗则有低血糖、酮症酸中毒等相关并发症风险[18]。同时,血糖控制不佳可能影响手术预后且患者容易发生相关并发症,因此对血糖调控需要进行全面评估。口腔癌患者进食多受限,这使得围术期血糖调控更加复杂。患者术前需要进行多点法血糖检测,对多数的住院患者推荐血糖控制目标为7.8~10.0 mmol·L-1;少数患者如发生低血糖风险较低、拟行手术较精细,则建议应用更为严格的血糖控制目标6.1~7.8 mmol·L-1[17]。对难控制性高血糖或发生低血糖风险较高的患者应行MDT,制订有针对性血糖控制及治疗方案。口服降糖药效果欠佳,或中、大型手术术前3~7 d,患者应停服降糖药物,行胰岛素强化治疗,即睡前22点皮下注射长效胰岛素,三餐时皮下注射短效胰岛素,通过基础胰岛素联合餐时胰岛素的治疗方式,改善血糖控制[19]。
术中,除了单纯饮食治疗或口服小剂量的降糖药物即可控制血糖于合理范围内且拟行小型手术的患者可不用胰岛素外,其余患者均应该静脉滴注胰岛素;严密监测血糖,定时复查血气,控制血糖在7.8~10.0 mmol·L-1。术中为避免低血糖可静滴5%葡萄糖溶液,控制速度100~125 mL·h-1,现多以葡萄糖—胰岛素—钾行联合输注治疗并注意血糖情况及时进行调整[15]。患者术后鼻饲饮食时需继续静脉输注胰岛素,可正常饮食改为皮下注射胰岛素。对不能进食的患者,可仅给予基础胰岛素;正常进餐者,则给予基础胰岛素联合餐时胰岛素的强化治疗方案。需重症监护或机械通气的患者通过静脉输注胰岛素维持血糖为7.8~10.0 mmol·L-1,行中、小手术的患者维持FPG<7.8 mmol·L-1且随机血糖<10.0 mmol·L-1。若患者既往血糖控制情况良好则考虑对其施行相对严格的管控标准。关注电解质水平,避免低血糖。
4.5 呼吸系统疾病
4.5.1 纳入标准 1)既往明确患有慢性阻塞性肺病(chronic obstructive pulmonary disease,COPD)、哮喘、慢性支气管炎等基础呼吸系统疾病者;2)住院行胸片、肺部CT、肺功能等相关检査见异常结果,并由呼吸内科明确诊断为呼吸系统疾病者。
4.5.2 围术期处理 围术期呼吸系统常见肺部感染、气道痉挛、肺水肿、肺不张、呼吸衰竭、原有的呼吸系统疾病急性加重、各种形式的气道阻塞等并发症[20-21]。口腔癌患者手术术区多涉及舌、口底、口咽、颈部等位置,常因舌、口底组织后坠或呼吸道周围组织水肿等原因,造成气道阻塞。同时,头颈部皮瓣移植术后患者长期制动卧床,为保障气道通畅行气管切开等,使术后出现呼吸系统感染的概率增加。围术期MDT有助于加强气道管理,通过适当的处理措施,降低呼吸道并发症发生率,促进患者术后安全康复,提高生活质量。
术前应完善呼吸系统检查,常用检查如肺功能测试、动脉血气分析、心肺功能运动试验、支气管舒张试验、呼气峰流速检测等,结合患者病史,评估围术期发生呼吸道并发症的风险[21-23];组织MDT,由口腔颌面外科、呼吸科、麻醉手术科、康复科、心理科及专业护理等共同参与,制订个性化呼吸道管理方案。术前,康复科医师针对加速康复外科相关知识向患者进行宣传教育,并对合并高危因素患者进行术前肺康复(物理康复、药物康复和心理康复)训练指导,制订训练时间及方案。患者术前需戒烟并学习有效的咳痰方式及呼吸功能锻炼方法,同时告知患者术后可能出现的临床症状,缓解焦虑、紧张情绪,增加依从性,实现加速康复[22,24]。术前对COPD患者或其他有明显咳痰症状者行药物治疗,以袪痰药、平喘药及消炎药为主[22,25]。存在明显焦虑或抑郁的患者,请心理科医师进行协助[22]。
术中应尽可能减少气管插管造成的损伤,加强血氧饱和度监测,维持气道压力不超过20 cmH2O,对有COPD者不超过30 cmH2O,保持血氧饱和度>90%同时使用低浓度氧通气。要制订规范化、个体差异化的药物应用方案,慎重联合用药,在监测肌松与麻醉深度的条件下尽量减少药量和用药时长,首选短效药物[22,26]。采用目标导向式补液,对由麻醉引发的血管扩张通过缩血管药物进行小剂量持续输注来拮抗以达到减少液体量的目的。补液过程中监测患者的心率血压,降低应在术前基础值20%以内,控制中心静脉压范围在0.80~1.07 kPa之间,混合静脉血氧饱和度75%以上,血乳酸含量不超过2 mmol·L-1,每搏量变异度维持在13%以内,尿量不少于0.5 mL·(kg·h)-1[22,27-28]。术中规范操作,减少手术创伤。
术后应掌握好拔出气管导管的时机,情况允许时尽早拔管。对于手术可能引起术后呼吸道阻塞的患者,行预防性气管切开的指征可以适当放宽。保持气道通畅,防止误吸,若出现黏膜水肿、气道痉挛等情况应及时针对性处理。通过早期有效咳痰与深呼吸恢复患者肺功能,依据咳痰情况适当给药,并通过拍背辅助吸痰治疗以防止细小支气管堵塞。同时加强患者呼吸训练,积极镇痛,控制胃食管反流,尽早下床活动等,及时排出呼吸道分泌物,促进肺通气量恢复,减少术后发生呼吸系统相关并发症[22,28-30]。若发生肺部感染,要留取痰液,进行培养和药敏试验,针对性抗感染治疗。
4.6 血液系统疾病
4.6.1 纳入标准 1)既往经血液科确诊有明确血液病病史者;2)入院后多次检查出现血象异常或凝血功能异常,结合患者出血史、输血史,经血液科会诊诊断为血液病者。
4.6.2 围术期处理 血液病是指所有发生于血液和造血组织,以血液学异常为主要表现的疾病。口腔癌伴血液病患者不同于一般手术患者,因具有特殊的基础情况,围术期处理需要包括血液科在内的众多科室互相协作进行,从规范诊断、药物使用、血液制品应用、麻醉和手术处理等多方面,尽可能避免并发症,保证患者的手术安全。
患者围术期需要按其血液病的严重程度进行监测,术前完善相关检查对于评估患者围术期风险具有重要意义。检查以外周血象观察为主,结合多项生理功能监测,包括血常规检查、凝血检查、血小板功能检测、纤维蛋白溶解系统功能检测、综合凝血功能检测等,从而了解病情累及范围及严重程度,有助于鉴别诊断,指导治疗及判断预后[31]。贫血、全血细胞减少或出凝血异常等血液病常见临床表现术中会影响循环系统及呼吸系统,为确保手术麻醉的安全性,必须作好各项呼吸与循环系统相关生理指标的监测。通过MDT,加强基于循证医学和多学科联合的患者血液管理(patient blood management,PBM),使患者获得更好的临床转归[32]。术中常见出血并可能因此而导致血压降低、心率加快,除了对症措施外必要时应及时根据情况进行血液制剂输注。优化手术操作技术,术者操作应仔细、轻柔、敏捷,避免意外性出血和精细止血是有效减少术中出血和异体输血的关键。术后应继续关注出凝血问题及基本实验室指标,如血小板数量及功能、综合凝血功能等[33]。对于血液病患者尤其是有贫血情况者应重视康复支持治疗,持续进行营养支持[34-35]。根据情况必要时进行术后MDT,与血液科、重症医学科、康复科等相关科室密切交流,从而保障患者安全度过围手术期。
以血友病为例,必须明确血友病分型,首选通过活化部分凝血活酶时间(activated partial thromboplastin time,APTT)以及血浆凝血酶原时间(prothrombin time,PT)进行诊断。若APTT显示延长而PT未见异常则考虑内源性凝血途径存在异常,但此结果不能用以区分血友病A、B型,同时患者的血小板计数、纤维蛋白原、出血时间、凝血酶原时间等相关检测结果均可显示正常。通过对血浆凝血因子FⅧ:C及FⅧ抗原(FⅧ:Ag)的检测已经完成血友病A的确诊,FⅨ:C与FⅨ抗原(FⅨ:Ag)的检测可确诊血友病B,前者表现为低FⅧ:C水平而FⅨ抗原正常;后者表现为FⅧ:C正常但FⅨ抗原含量及其活性下降。同时注意血管性血友病(von Willebrand disease,vWD)和获得性血友病(acquired hemophilia,AH)等其他出血性疾病与血友病A的鉴别诊断[36-38]。进行抑制物筛选实验检测患者体内是否存在抑制物,结果阳性者应该暂缓行择期手术。此外,针对其他出血情况严重者也应考虑以重组人活化FⅦa(recombinant human FⅦa,rhFⅦa)制品进行治疗。现在临床上多以替代疗法作为血友病主流治疗方法,通过输注高纯度的浓缩凝血因子Ⅷ或Ⅸ来提高患者血浆中的凝血因子活性,达到止血目的。至少于手术开始1 h前实施替代治疗,根据手术部位、手术类型等决定治疗所需凝血因子活性及其维持时间。术前应该将FⅧ提高至正常水平(60%~100%),Ⅷ:C维持于25%~50%,待病情逐步稳定可减量并继续使用7~10 d或直至痊愈。由FⅧ和FⅨ的代谢半衰期时长决定,血友病A患者应每8~12 h进行1次输注,而血友病B患者应每12 h进行1次输注,间隔时间可依情况延长,直至患者创区愈合不再出血且FⅧ:C/FⅨ:C水平与术前持平[36,38-39]。术前需准备足够的凝血因子,以确保替代治疗的顺利进行;若患者未经替代治疗便发生不同程度的出血,则需根据出血程度补充凝血因子。此外,术中应注意止血,减少手术时间与创伤,避免不必要的有创操作,禁用各种类型的抗血小板药及含抗血小板成分的复方制剂。术后检测FⅧ或FⅨ水平,最好每天2次。
4.7 慢性肾脏病
4.7.1 纳入标准 1)既往于肾内科就诊治疗明确有慢性肾病或肾移植病史者;2)既往病史未明,入院检查见:①白蛋白尿[尿白蛋白排泄率≥30 mg/24 h;尿白蛋白肌酐比值≥30 mg·g-1(或≥3 mg·mmol-1)];②尿沉渣异常;③肾小管相关病变;④组织学异常;⑤影像学所见结构异常;⑥肾小球滤过率(glomerular filtration rate,GFR)下降,肾小球滤过率估算值(estimated GFR,eGFR)<60 mL·(min·1.73 m2)-1。有以上情况任何一项并持续时间超过3个月,经肾内科会诊确诊为慢性肾脏病者[40]。
4.7.2 围术期处理 慢性肾脏病(chronic kidney disease,CKD)往往起病隐匿,不易早期发现,病情后期常伴多种并发症,晚期表现为终末期肾病(end stage renal disease,ESRD)。除肾小球肾炎外,糖尿病、高血压和高脂血症等也是CKD的传统危险因素,因此,当口腔癌患者伴有以上系统疾病时也应重视患者的肾功能相关检查,及时发现与治疗CKD,减少围术期不良事件的发生。围术期CKD患者内环境不稳定,除心血管事件外,还可能出现贫血、低蛋白血症、水电解质与酸碱平衡紊乱及凝血功能障碍、感染和内分泌功能异常等多种问题。并发症复杂且多样化导致CKD患者尤其是ESRD患者围术期风险及死亡率明显高于一般人群,因而需要更加谨慎的制订MDT方案。围术期对CKD患者进行MDT,由包括肾内科等相关内科科室医师评估心、肺、肝脏、凝血等生理功能,制订围术期肾功能保护方案;麻醉手术科医师对患者容量水平评估,制订相应容量管理方案;康复科及营养科等相关专业医师评估术前营养状态,通过合理地加速康复方案来保持患者得到充分的热量和蛋白质摄入,促进术后恢复。MDT方案的制订不仅可以延缓CKD的进展,更有助于减少术后并发症的发生,提高患者的生存质量,其意义十分重要。
围术期有效血压控制是CKD治疗的首要目标,无白蛋白尿者血压控制为<18.66/12.00 kPa;有白蛋白尿且<1 g/24 h者,血压控制为<17.33/10.66 kPa,以防止蛋白尿增多;有白蛋白尿且>1 g/24 h者,应维持血压在16.66/10.00 kPa[11,41]。对于CKD患者的降压治疗,起始阶段中应以ACEI或ARB其中一种单独应用或与其他降压药物联合,以达到降压目的同时减少蛋白尿发生,减缓肾功能衰退。根据血肌酐情况调整用药,高于基础值30%以内时使用应慎重,超过30%则需减量或停用。密切监测糖尿病合并CKD患者的血糖,糖化血红蛋白(glycosylated hemoglobin,HbA1c)控制目标为7.0%,对病史较短、预后较好的患者可以应用更加严格的控制标准HbA1c<6.5%;中重度慢性肾脏病患者的HbA1c可以适当放宽控制在7.0%~9.0%。肾功能不全者应该尽量选用非经肾代谢的降糖药物,而对已有严重肾功能不全者应该选用胰岛素治疗。依据的患者肾功能分期与GFR水平调整胰岛素及口服降糖药剂量。对eGFR<30 mL·(min·1.73 m2)-1的糖尿病肾病患者,应积极准备肾脏替代治疗[17,41-42]。血液透析常在术前24 h内进行以充分降低容量负荷、减少高钾血症发生[43]。术中加强血流动力学监测,保持血流动力学稳定,根据各项检测指标进行输液和处理。术中、术后对少尿和无尿患者应限制输液量。考虑术后出血的可能,需依据患者的状况对透析方案进行调整,手术24 h后可以对依赖透析者实施透析治疗。对需要血液净化以维持生命的危重患者可采取持续肾替代治疗[44-45]。由于CKD患者病情复杂,发生并发症风险增加,围手术期必须加强MDT团队合作,随时交流沟通,灵活调整MDT方案,从而及时对患者病情作出针对性处理,帮助患者安全度过围手术期。
4.8 静脉血栓栓塞症(venous thromboembolism,VTE)
VTE是肺血栓栓塞症(pulmonary embolism,PE)和深静脉血栓形成(deep vein thrombosis,DVT)的统称,是重要的围术期并发症,常导致院内非预期死亡。口腔癌患者发生VTE风险主要由于其围术期制动、活动减少、长期卧床等情况使得静脉流速减缓,创伤导致组织因子释放启动外源性凝血系统引发人体呈高凝状态,患者存在高龄或肥胖等因素。此外,伴系统性疾病如冠心病、周围血管疾病等患者往往长期使用抗栓药物,术前应综合评估,并根据其结果制订抗栓药物管理方案[46-48]。对于有围手术期抗栓治疗指征的患者,必须考虑潜在出血风险,应组织相关科室行MDT,共同制定VTE防治方案。MDT专家团队成员除口腔颌面外科还应包含血管外科、心脏内科、血液科、肿瘤科、重症医学科甚至呼吸内科、肾脏内科等临床科室,以及放射科、超声科、实验医学科等医技平台科室灵活机动组合。多学科专家组协助进行患者VTE风险评估并制定VTE患者预防与治疗方案,同时加强对科室医务人员的院内VTE防治知识培训,以提高针对发生PE患者的抢救效率,加强围术期VTE风险管理。
术前推荐采用Caprini模型[49]评估VTE风险:1)计算风险评分;2)判断风险等级[50]。同时,对于疑诊为首发下肢DVT的患者,建议用DVT验前概率(Well’s评分系统)进行临床评估来指导诊断,而不是所有患者均行相同的检查,通过验前概率评估、D-二聚体检测以及超声检查的联合应用作出诊断[51]。所有患者均应尽早下床活动,对低危及以上风险者以预防VTE为主,均衡考虑VTE及出血风险,依据MDT方案采取适当的机械或(和)药物预防VTE,期间适时调整策略,对手术患者的预防措施应实行7~14 d或持续到出院。对VTE风险高而出血可能较小且不能耐受肝素类药物的患者,可采取磺达肝癸钠或阿司匹林进行药物预防。对明确患有下肢DVT者,不建议预防性置入下腔静脉滤器[46-48]。对手术患者需以药物长期抗栓治疗时,应通过MDT综合决定是否停药以及停药期是否行桥接治疗,减少围术期凝血障碍发生。
4.9 精神心理类疾病
大多数系统性疾病(冠心病、高血压、糖尿病等)均为身心疾病,口腔癌患者并发系统性疾病时往往伴有更加明显的心理应激反应或情绪障碍,如焦虑、抑郁、恐惧等,这些负性心理情绪严重影响治疗效果和患者的生活质量,甚至可能加速口腔癌恶化进程。随着心理社会肿瘤学的提出,其作为一门新兴交叉学科越来越受到临床医师的重视,是多学科合作不可或缺的部分。精神科医师、心理科医师等应积极参与到口腔癌的MDT中,调节并改善躯体精神症状,对患者的心理社会问题进行治疗,强化医患沟通[52]。在MDT中加入精神心理方面的诊疗意见有助于改善部分临床医师只聚焦于躯体症状的观念[53]。
口腔患者的躯体症状与心理症状常相伴并存,心理症状由躯体症状诱发后又导致其加重。因此,不仅要关注对躯体的对症诊治,更要对情绪心理的诊疗给予重视[54]。以术后谵妄(postoperative delirium,POD)为例,口腔癌本身及其并发症均可能导致谵妄的发生,许多相关治疗如手术、化疗等也会增加POD风险[55]。通过对多种危险因素进行提早干预来预防和治疗POD,术前合并多种系统性或精神性疾病、血清白蛋白高、酗酒或药物滥用、吸烟史、术后失眠等均是发生POD的重要危险因素[56-58]。对于高风险住院患者,建议每日观察患者在认知、躯体功能或行为方面是否发生改变或波动,如果有任何的改变出现,应由经过培训的人员进行评估以确定谵妄的诊断[56],并通过MDT团队采取综合措施来干预潜在的问题,预防可能的不良事件。围术期对麻醉深度加强监控,完善镇痛,做到POD早期诊断及时处理[57]。必要时给予药物治疗,小剂量应用氟哌啶醇和(或)非典型抗精神病药物,但不宜常规应用苯二氮卓类。针对于酒精滥用者预防POD,可应用α2受体激动剂(右美托咪定或可乐定)、长效苯二氮卓类、抗精神病药物和适量酒精[56-57,59]。此外维持术中血压稳定,防止低氧血症,可能对POD预防有一定作用[60]。同时,构建一个有益认知、社交、情绪的环境可能有利于对POD的预防和治疗。
4.10 合并多种系统性疾病患者MDT
临床上患者往往合并多种全身系统疾病,此时,需要多科室专家进行集中会诊讨论,对患者不同的病情,以及病情严重程度、进展速度、对口腔癌围术期与后继治疗可能产生的影响等相关因素进行综合考虑,制定个性化治疗方案。由于病种多,参与成员不固定,组织需要一定磨合期,因此这不仅需要在单病种MDT的基础上增加会诊专家团队成员,更需协调员及主持人有较高的组织能力,同时对制订的诊疗方案能够妥善执行,并及时与相应科室就系统性疾病相关治疗进展进行交流沟通,建立良好的反馈,根据患者情况对诊疗方案进行动态调整。通过主诊科室与各相关科室协调合作,使患者得到适合病情的最佳治疗,减少围术期不良并发症的发生,增强治疗效果,达到延长患者生存期、提高生活质量的治疗目的。
4.10.1 高血压合并冠心病 血压水平与心脑血管病发病和死亡风险之间存在密切的因果关系。收缩压每升高2.67 kPa或舒张压每升高1.33 kPa,在行非心脏手术时,围术期出现心血管事件而死亡的相对危险度呈倍数增高[11,14]。因此,血压控制既要降低心脏负担又要改善心肌供血,围术期MDT的开展对于心脏内科医师充分了解患者情况,与各相关科室共同评估围术期心血管风险,进行血压的有效控制,实现“降压又护心”的治疗目标是十分必要的。对高血压合并冠心病,通常推荐β受体阻滞剂和ACEI、ARB作为首选,尤其是伴有心衰、左心室功能不全等患者优先考虑使用ACEI,不能耐受者以ARB替代。同时,ACEI、ARB对合并有糖尿病的患者血压控制也有良好效果。如不宜采用β受体阻滞剂,在患者不伴有左心室功能障碍的情况下可行非二氢吡啶类(如维拉帕米)药物治疗,但对有症状的冠心病患者行β受体阻滞剂和非二氢吡啶类联用时需注意其可能增加心动过缓和心力衰竭的发生风险。高血压合并稳定型心绞痛或冠心病的患者在使用抗血小板药物或抗凝药物时无特殊禁忌证。对于正在接受抗凝或抗血小板治疗的患者,若血压过高难以控制,需立即降压以降低出血性脑卒中的发生风险。高血压合并冠心病患者血压推荐控制<18.66/12.00 kPa,能耐受者可<17.33/10.66 kPa,同时维持舒张压>8.00 kPa,对高龄或伴有严重冠状动脉狭窄等情况的患者,避免血压过低[11,35]。在治疗期间应严密观察血压的变化,及时将治疗情况向心脏内科医师进行反馈,并根据患者全身情况、血压控制效果等及时调整口腔癌相关治疗计划,灵活实施MDT治疗方案。
4.10.2 高血压合并糖尿病 高血压患者常合并有血糖升高,两者互为高危风险因素。控制高血压可显著降低糖尿病并发症发生和发展的风险,同时,良好的血糖控制与高血压合并糖尿病患者的心脑血管风险改善显著相关[11,17]。一般两病合并者血压应该控制<17.33/10.66 kPa,对高龄或伴严重冠心病者可以适当放宽要求。强调药物干预和生活干预相结合方式综合调控血压血糖。对伴血压升高的糖尿病患者常见降压药物均可使用,以ACEI、ARB为核心用药[17]。新型钠-葡萄糖协同转运蛋白2抑制剂或胰高血糖素样肽(glucagon-like peptide 1,GLP-1)受体激动剂在降糖降压方面均有作用,且能减轻体重,降低心血管不良事件的发生风险[11]。用药时应关注降压药与降糖药之间的相互影响[11]。由于糖尿病患者易出现夜间升压现象,可实行24 h动态血压评估,由此指导并调整用药种类剂量及用药时间。以长效药物作为首选从而有效维持血压平稳,以减少昼夜波动,预防心脑血管不良事件发生[17]。围术期MDT有利于口腔癌治疗过程中更好地协调内分泌科和心脏内科,使两科室能够同步了解患者相关的临床资料,通过会诊和讨论,针对患者病情,制订针对性诊疗方案。
4.10.3 糖尿病合并冠心病 糖尿病是心血管疾患的独立危险因素。与非糖尿病人群相比,糖尿病患者发生冠心病的概率是非糖尿病者的2~4倍。对存在空腹或餐后血糖升高但未确诊为糖尿病者,其心血管疾病风险高于健康者[17]。对普通冠心病患者的血糖应做到:FPG<7.0 mmol·L-1,餐后2 h血糖<10.0 mmol·L-1,HbA1c<7.0%;若糖尿病患者病史短,症状轻则可控制HbA1c<6.5%,终末期慢性病者则可放宽至HbA1c<8.5%甚至<10%,同时应避免低血糖诱发不良事件。伴有高血压的患者ACEI和ARB是治疗的重要组成部分,减少出现心血管事件的同时改善微血管病变及延缓大血管病变进展,提高预后效果,ARB还可用于伴微量白蛋白尿者的治疗。抗血小板药物及硝酸酯类药物均可用于冠心病合并糖尿病患者。β受体阻滞剂用于冠心病合并糖尿病患者获益大于风险[17,61]。对于口腔癌患者,围术期禁食、鼻饲饮食等使得血糖调控更加困难,通过MDT在内分泌科、心脏内科及营养科等相关科室医师的指导下,对多重危险因素进行综合控制从而降低围术期不良事件发生的风险。
4.10.4 合并多种系统性疾病 口腔癌患者尤其是老年患者可能伴发多种全身系统性疾病,除常见的心血管、内分泌及呼吸系统疾病外,全身情况往往更为复杂,其他系统疾病也必须给予重视。伴发疾病的增加使得围手术期管理的难度增加,治疗过程中各系统并发症的发生概率增加,此时,MDT诊疗制度的优势更加明显。通过充分发挥MDT诊疗模式的主观能动性,灵活调整参与科室,发挥其多学科优势,集中各学科专家的知识与经验,将不同科室的工作紧密相连,提高治疗效率,优化治疗方案。针对复杂病例,患者的病历资料是否详尽至关重要。组织MDT讨论会议应提供患者的完整病历资料,包括病例说明和相关检查结果等,以便给予治疗建议。患者信息不完整则可能导致治疗方案不恰当,治疗时间延长。对于后继需要进一步完善相关检查的病例,应及时向相关科室进行结果反馈,必要时可举行不止一次MDT讨论,以达到最佳治疗效果。
5 展望
MDT模式有利于合并全身系统性疾病的口腔癌患者综合序列治疗的开展,使患者得到与病情相适应的最佳治疗,更好地保障患者围术期安全,提高医疗质量。MDT案例的诊疗反馈和经验总结还可以为日后相近患者的诊疗提供指导。MDT过程中针对复杂疑难危重的病例讨论,可以促进专科医师开阔视野,增强综合思维能力,从而培养更多复合型人才。通过MDT对复杂、疑难病例的资料收集整理以及全程随访,完善了临床病例的积累,对临床科研工作的开展提供有力支持,为相关研究设计提供了多元化思路。而且,MDT使得各学科之间积极沟通协作,相互协调配合,打破了学科之间的界限,对于增进学术交流,培养团队精神,增强医院凝聚力,均有重要作用。
总之,MDT诊疗模式的建立和完善,对提高口腔癌合并全身系统性疾病患者的治疗效果非常必要;同时,其方案不是机械不变的,必须坚持因人而异的设计理念,在临床实践中不断调整,以便更好地服务于患者。
致谢:感谢山东第一医科大学附属省立医院王荣教授、王欣教授、管庆波教授等在论文撰写过程中给予指导和帮助,感谢山东第一医科大学附属省立医院吴海威医师、于淼医师在论文撰写过程中所作的工作。
利益冲突声明:作者声明本文无利益冲突。
