miR-193a-3p通过HR通路促进食管鳞癌细胞放射抵抗的初步研究
2020-12-08钱立庭
孟 芳,钱立庭,吕 磊
1.无锡市锡山人民医院肿瘤血液科,江苏 无锡 214001; 2.安徽省肿瘤医院肿瘤放疗科;3.安徽省肿瘤医院表观遗传研究室
1 材料与方法
1.1 材料
1.1.1 实验细胞:食管鳞癌细胞系KYSE150、KYSE180、KYSE410、KYSE450由北京国家分子肿瘤重点实验室詹启敏院士惠赠。
1.1.2 主要试剂:RPMI-1640培养基和质量浓度为100 g/L的胎牛血清购自美国Invitrogen公司。mimic、antagomiR、the scramble sequence control (NC)和the ribo FECT CP transfection kit均购自中国广州锐博公司。Rad51抗体(AT3548a)和anti-GAPDH(AM1020a),辣根过氧化物酶标记的anti-raddit IgG二抗(LP1001b)均购自美国Abgent公司,r-H2AX抗体(P16104)购自UniProt公司,二甲基亚砜(Dimethyl sulfoxide,DMSO)购自Sigma公司。
1.1.3 仪器:6-MV-X射线机器型号CX-SN5340(VARIAN,美国),美国Thermo Scientific公司8000DH CO2培养箱及酶标仪等。
1.2 方法
1.2.1 细胞培养:KYSE150、KYSE450细胞置于含质量浓度为100 g/L胎牛血清的RPMI-1640培养基与F12培养基(1∶1),KYSE410、KYSE180细胞置于含质量浓度为100 g/L胎牛血清的RPMI-1640培养基中,于37 ℃、体积分数为5%的CO2条件下培养,2~3 d换液传代1次。取对数生长期细胞进行实验。
1.2.2 实验分组:本实验分为对照组(NC组)和实验组(包括3PM组、3PA组),3PM组为KYSE150细胞中转染miR-193a-3p mimic,3PA组为KYSE410细胞中转染miR-193a-3p antagomiR。利用6-MV-X射线(CX-SN5340)辐照,X射线源距离样品表面100 mm,能量为6-MV,照射剂量率为300 cGy/min。
1.2.3 MTT实验:根据细胞生长特性,在96孔板中接种细胞,每组细胞设3个复孔,待细胞贴壁后,分别给予0、0.5、1.5、4.5、8、12 Gy(6-MV-X射线)单次吸收剂量照射,根据顾玉明教授等[3]报道,细胞照射处理需再培养5 d,故我们将照射后的细胞放置在37 ℃,体积分数为5%的CO2培养箱中5 d,5 d后向每个孔中加入10 μl MTT(10 mg/ml),于培养箱中继续培养4 h,吸出培养液,向每个孔中加入150 μl DMSO,震荡充分溶解紫色结晶,酶标仪570 nm处测定吸光度值,算出的值均加上或减去平均值误差,最后算出绘图,此实验重复3次。
(2)计划全面引入BEPS第8项至第10项行动计划成果关于转让定价的定义。转让定价是中国在BEPS成果转化中关注的重点,2015年9月17日,国家税务总局政策法规司发布《特别纳税调整实施办法(征求意见稿)》,对《特别纳税调整实施办法》进行修订,它包含了与无形资产交易相关的全新章节,其中无形资产的规定完全对接了BEPS第8项至第10项行动计划成果相同的宽泛定义,但为适应中国实际情况,某些方面的规定还是与BEPS报告中的意见有差异。
1.2.4 RNA抽提及qRT-PCR:总RNA用TRIzol(Tiangen Biotech公司)抽提剂提取。利用miRNA特异性RT-primer(Ribobio),采用茎环反转录法使用SYBR Green在FTC-3000P(Funglyn Biotech Inc.,Canada)中定量检测miR-193a-3p及miR-22-3p的表达水平,U6 RNA作为内参。使用2-ΔΔCt方法计算不同组相对水平。
1.2.5 细胞转染:转染miR-193a-3p mimic(3PM)和miR-193a-3p antagomiR(3PA) 50 nm/L,用Lipofectamine 2000转染试剂进行转染。将KYSE150细胞以2×105个/孔,KYSE410细胞以4×105个/孔的密度接种于6孔板培养过夜,待细胞融合度达到50%时,转染24 h后进行RT-PCR实验或48 h后收集蛋白进行Western blotting实验。
1.2.6 细胞增殖实验:KYSE150细胞每孔2 000个,KYSE410细胞每孔4 000个接种于96孔培养板中,5块96孔板,每组设3个复孔,24 h后分别转染,KYSE150中转染miR-193a-3p mimic,KYSE410中转染miR-193a-3p antagomiR,培养24 h后的第1块96孔板最后的平均值为对照,其他依次顺序,最后1块培养板培养96 h,每次均是每孔加入10 μl MTT,继续孵育4 h,弃上清液,每孔加入150 μl DMSO,震荡充分溶解紫色结晶,酶标仪上570 nm测定吸光度值。细胞生长率(%)=[实验组平均值(48 h/72 h/96 h)-空白对照/对照组平均值(24 h)-空白对照]%。
1.2.7 细胞凋亡分析:收集细胞(对照组和实验组),细胞数为2×106ml-1,800 r/min离心5 min,弃去培养液。用孵育缓冲液洗涤2次,800 r/min离心5 min。用100 μl的标记溶液重悬细胞,室温下避光孵育10~15 min。800 r/min离心5 min,沉淀细胞孵育缓冲液中洗1次。加入荧光(SA-FLOUS)溶液4 ℃下孵育20 min,避光并不时振动。流式细胞术通过流式细胞仪分析,流式细胞仪激发光波长用488 nm,用一波长为515 nm的通带滤器检测FITC荧光,另一波长大于560 nm的滤器检测PI。结果通过FlowJo7.6.1软件分析。本实验通过3次独立实验完成。
1.2.8 蛋白质印迹法:收集the scramble sequence control(NC)、miR-193a-3p mimic(3PM)和miR-193a-3p antagomiR(3PA),RIPA蛋白裂解液提取、收集细胞蛋白。每孔5 μl上样量,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecylsulfate-polyacrylamide gel eleetrophoresis,SDS-PAGE),半干法转至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上,质量浓度为50 g/L牛血清白蛋白(BSA)封闭1 h,加入一抗4 ℃孵育过夜(Rad 51∶1 000,GAPDH 1∶2 000)。PBST洗膜后,加入辣根过氧化物酶(horseradish peroxidase,HRP)标记的二抗(1∶3 000),室温孵育2 h。PBST充分洗掉背景后,采用增强ECL底物曝光。目的条带使用chemiluminescence reaction(pierse)显色底物进行显色,相对条带轻度以GAPDH条带为内参,通过Gelgel-Pro Analyzer(media cybernetics)进行测定。
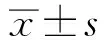
2 结果
2.1 食管鳞癌细胞的放射敏感性分析及miR-193a-3p在4株细胞中的表达如图1A所示,KYSE150细胞在4株细胞中最敏感(4.3 Gy),KYSE410细胞最耐受(13.9 Gy),我们采用MTT法检测4株人食管鳞癌细胞(KYSE150、KYSE180、KYSE410、KYSE450)的放射敏感性,相对IC50结果如图1B所示。并在4株细胞中检测了miR-193a-3p的表达,结果发现,miR-193a-3p在4株细胞中的表达量与细胞的敏感性呈负相关(见图1C),即在敏感株细胞中表达少,而在耐受株细胞中表达相对较多,由此说明miR-193a-3p可能与放射耐受性有关。


注:A:4株食管鳞癌细胞对不同照射剂量的放射敏感性,其中KYSE150最敏感,KYSE410最耐受;B:4株细胞IC50的值;C:miR-193a-3p在4株细胞中的表达水平对比,其中KYSE150表达量最少,KYSE410表达量最多。
2.2 qRT-PCR检测miR-193a-3p在放射敏感株和耐受株中的表达水平从图2可以看出,miR-193a-3p表达量在敏感株中显著低于耐受株(1∶192)。

图2 miR-193a-3p在两株细胞中表达量的差异 Fig 2 Difference expression of miR-193a-3p in two cell lines
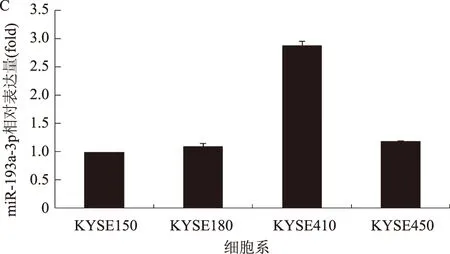
2.3 MTT检测miR-193a-3p对食管鳞癌放射敏感性的影响在放射耐受株KYSE410(内源性miR-193a-3p高表达)中转染miR-193a-3p antagomiR(3PA)抑制miR-193a-3p的表达,在放射敏感细胞株KYSE150(内源性miR-193a-3p低表达)中转染miR-193a-3p mimic(3PM)上调miR-193a-3p的表达,经过剂量0、0.5、1.5、4.5、8、12 Gy 6-MV-X射线照射后,与NC组比较,3PA组细胞存活率降低(P<0.05)(见图3A),3PM组细胞存活率升高(P<0.05)(见图3B)。
2.4 MTT检测miR-193a-3p对食管鳞癌细胞增殖能力的影响如图4所示,与NC组相比,3PM组细胞增殖能力增加,3PA组细胞增殖能力明显下降。由此得出,miR-193a-3p与食管鳞癌细胞的增殖能力呈正相关。
2.5 流式细胞术分析miR-193a-3p对食管鳞癌细胞凋亡的影响采用流式分析法检测miR-193a-3p对食管鳞癌细胞凋亡的影响,与NC组相比,3PM组细胞凋亡率下降11.10%(见图5A);3PA组细胞凋亡率增加3.63%(见图5B),此结果表明,miR-193a-3p抑制食管鳞癌细胞凋亡,结合MTT实验的数据表明,miR-193a-3p有辐射抑制的效果。

A:在KYSE410细胞株中抑制miR-193a-3p的表达水平,该株细胞的放射敏感性增加;B:在KYSE150细胞株中增加miR-193a-3p的表达水平,该株细胞的放射敏感性下降。
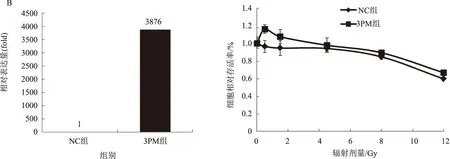
2.6 检测miR-193a-3p不同水平对r-H2AX及RAD51的影响为了验证miR-193a-3p是否通过影响DNA双链修复促进放射耐受性,我们通过Western blotting检测细胞辐照18 h后r-H2AX及RAD51的表达,结果证明,在KYSE150中转染miR-193a-3p mimic可以促进r-H2AX蛋白表达(1.00∶1.25),抑制RAD51蛋白表达(1.00∶0.63),而在KYSE410中转染miR-193a-3p antagomiR则可以抑制r-H2AX蛋白表达(1.00∶0.85),促进RAD51的表达(1.00∶1.55),这一结果表明,miR-193a-3p可能通过ATM/HR通路促进DNA双链断裂后的修复(见图6)。


注:A:低表达miR-193a-3p,细胞凋亡率增加;B:高表达miR-193a-3p,细胞凋亡率下降。
图6 高表达或低表达miR-193a-3p对RAD51和r-H2AX蛋白表达的影响Fig 6 The effect of high or low expression of miR-193a-3p on the protein expressions of RAD51 and r-H2AX
3 讨论
目前我们对于肿瘤放射耐受的机制已有一定的认识,除了DNA damage repair等[4]经典机制外,其中非编码RNA尤其是miRNA对于肿瘤放射治疗的影响在近些年来引起了越来越多人的关注,有文献报道,miRNA可促进食管鳞癌细胞的放射抵抗性[5],miRNA是真核生物中广泛存在的一种长21~23个核苷酸的RNA分子,可以通过与特定蛋白编码基因的mRNA 3′-UTR区的RNA发生序列特异性结合,继而抑制翻译或引起mRNA降解,导致这些蛋白编码基因的表达下调[6]。我们前期研究发现,miR-193a-3p通过调控其下游基因早老素1重组蛋白(presenilin1,PSEN1)/赖氨酰氧化酶样蛋白4(lysyl oxidase-like 4,LOXL4)促进食管鳞癌细胞抗放射性[7-8]。
miRNA影响放射耐受性的机制是多样和复杂的,Zhou等研究报道,miR-381通过下调其靶基因影响食管癌放射耐受性[9],Yan等表明,miR-24通过调控FERMT1影响食管癌放射耐受性[10],Zheng等研究表明,miRNA-200c通过调控P21影响食管癌细胞的放射耐受性[11],本研究对细胞凋亡变化进行了检测,结果发现,与NC组相比,3PM组细胞凋亡率下降11.10%,3PA组细胞凋亡率增加3.63%,以上数据说明miR-193a-3p抑制食管鳞癌细胞凋亡,我们知道细胞的放射抵抗性受很多因素影响,但其中最重要的影响因素是DNA双链断裂后的修复能力,组蛋白2A变异体(H2AX)是DNA双链断裂后修复的重要蛋白,它是细胞照射后较早出现修复DNA双链的蛋白,其在DNA双链断裂损伤可发生不同翻译修饰促进局部DNA修复,其主要通过ATM介导DNA双链断裂形成时磷酸化,是衡量DNA损伤程度的重要指标[12]。通过Western blotting验证发现,miR-193a-3p可能通过促进食管癌细胞DNA双链断裂修复来增加放射抵抗性,为了更进一步了解miR-193a-3p影响DNA双链断裂修复的分子机制,我们对此研究了HR通路,HR通路即同源重组修复通路,它的分子机制最早在细菌和酵母中阐明,在哺乳动物中保守,它的主要过程有DNA损伤位点的加工处理,链侵入和修复性合成等,而HR修复的关键步骤是RAD51依赖性链侵入性过程,RAD51是HR通路的关键蛋白和修复HR通路的核心分子[13],由此我们检测了改变miR-193a-3p水平后对RAD51表达水平的影响,结果表明,上调miR-193a-3p并辐射18 h后,RAD51蛋白表达增加(1.00∶1.55),抑制miR-193a-3p表达,RAD51蛋白表达减少(1.00∶0.63),并有文献表明,过表达RAD51可以增加哺乳动物细胞的放射抵抗性[14],故认为miR-193a-3p影响食管癌放射耐受性可能与HR通路有关,所以我们得出miR-193a-3p是通过影响食管癌细胞DNA双链断裂修复能力,从而促进食管癌细胞放射耐受性,但ATM的其他下游底物如MEC1[15],HR通路的其他蛋白如HP1、SUV39H1/2[16]未进行研究,miR-193a-3p是否还会通过这些基因影响放射耐受性仍值得进一步探索。
总之,miR-193a-3p可能是食管癌放疗耐受的一个潜在标志物,其促进DNA双链断裂修复可能是其促进放射耐受性的一个机制,而miR-193a-3p是否通过其他机制参与耐受,还需要进一步探索。
