“嗅三针”对帕金森病小鼠黑质高迁移率组蛋白B1及核因子-κB表达的影响
2020-12-08亢恺雯郭新荣
亢恺雯,王 渊,郭新荣,李 杰,马 雪 ,王 强
[1.陕西中医药大学第二临床医学院,陕西 咸阳 712046;2.陕西中医药大学针灸推拿学院,陕西 咸阳 712046;3.陕西省针药结合重点实验室,陕西 咸阳 712046 ;4.咸阳市神经生物学(针灸)重点实验室,陕西 咸阳 712046]
帕金森病(Parkinson’s disease,PD)是发病率仅次于阿尔茨海默病的第二大神经系统退行性疾病[1]。PD多好发于中老年人,典型临床表现主要包括运动迟缓、静止性震颤、肌强直、姿势平衡障碍和认知障碍等症状。其主要病理学特点为中脑黑质致密部多巴胺能神经细胞选择性死亡与残存神经细胞出现以α-突触核蛋白为主要成分的路易小体[2],导致纹状体多巴胺合成减少,黑质-纹状体通路多巴胺神经支配减弱,胆碱能神经功能相对增强,二者之间的平衡被打破,出现上述临床症状。PD的发病与遗传、环境、免疫、氧化应激等多种因素综合作用有关,其具体的发病机制尚未明确[1,3],但神经炎症反应在其中起着至关重要的作用[4]。尸检结果表明,PD患者脑组织黑质区小胶质细胞与星型胶质细胞被激活,趋化因子及炎症因子表达增加,加剧了多巴胺神经细胞的损伤[5]。慢性神经炎症会导致多巴胺合成减少,PD病程加重,过度的神经炎症反应产生大量炎症递质,进一步加速多巴胺神经细胞损伤。
在众多炎症反应因子中,由高迁移率组蛋白1(high mobility group box 1,HMGB1)介导的信号通路备受关注[6]。HMGB1是一种高度保守的非组蛋白DNA结合蛋白,可由炎症细胞主动分泌或由坏死细胞被动释放。HMGB1可在炎症因子刺激下,结合晚期糖基化终产物受体(the receptor of advanced glycation end products, RAGE)和Toll样受体(toll-like receptors,TLRs)启动并放大炎症免疫反应,是脑组织神经免疫炎症反应中的关键环节[7-9]。HMGB1可能在PD发病中发挥关键作用。
“嗅三针”疗法由双侧迎香穴和印堂穴组成,是刘智斌教授通过多年的临床实践经验总结并应用于嗅觉障碍及神经退行性病变的特色电针疗法[10-11]。PD作为典型的神经退行性病变,“嗅三针”可明显改善PD患者嗅觉障碍,延缓病程进展。本实验通过经鼻滴注脂多糖(lipopolysaccharide,LPS)构建小鼠PD模型,观察“嗅三针”对PD小鼠学习记忆能力及黑质区HMGB1及核因子-κB(nuclear factor-κB,NF-κB)蛋白表达的影响,探索“嗅三针”改善PD症状,抑制神经炎症因子,延缓病程进展的作用机制。
1 材料
1.1 动物 选取40只清洁级成年健康雄性的C57BL/6小鼠,实验使用许可证号:SYXK(陕)2018-0001,体质量为22~25 g,根据随机数字表法随机分为空白组、模型组、左旋多巴组、电针组,每组10只。动物由西安交通大学实验动物中心提供,生产许可证号:SCXK(陕)2020-0001。小鼠清洁级饲养,环境温度为20~24℃,湿度为40%~70%,12 h明暗交替,自由饮食,适应性喂养1周。对动物的处理遵循《关于善待实验动物的指导性意见》。
1.2 试剂 抗HMGB1兔多克隆抗体(ab191583):英国abcam;抗NF-κB兔多克隆抗体(sc-17984):Santa Cruz;乙醚(批号 81290101400):上海展云化工有限公司;苄丝肼(批号BK7293):美国Invitrogen 公司;脂多糖(lipopolysaccharide,LPS)(批号 SV30010):美国Abcam公司;LPS(批号 DG-L2890)、左旋多巴(批号 GKT137831):Sigma公司。
1.3 仪器 匀浆机(i10型):德国IKN;Morris水迷宫视频分析系统:上海吉量软件科技有限公司;组织切片机:德国Leica公司;SDZ-Ⅱ型电针仪:苏州医疗用品厂有限公司;Image Pro Plus 6.0 图像分析系统:美国Media Cybernetics公司。
2 方法
2.1 实验动物模型复制 采用随机数字表法将40只小鼠分为10只空白组,另外30只用于模型复制,采用LPS经鼻滴注后分为模型组、电针组、左旋多巴组各10只。PD动物模型制备方法:用气体乙醚将小鼠麻醉后,暴露小鼠鼻孔,用移液枪将LPS(1 g/L,溶于生理盐水)缓慢少量滴入小鼠鼻孔内,注意动作轻柔,防止小鼠将液体吸入呼吸道,尽量使LPS在鼻腔吸收。空白组滴入等容积的生理盐水[12]。处理完毕后将小鼠分别放入笼中继续饲养。
2.2 干预方法
2.2.1 “嗅三针”组 小鼠穴位定位:印堂穴于小鼠眼距间向上2 mm处,迎香穴于小鼠鼻腔外侧向上被毛分界处。针刺操作:由内侧向上方向斜刺迎香穴,由指向鼻根方向平刺印堂穴,进针均为0.3 cm。电针参数设置:强度为1 mA,疏密波(2 Hz/100 Hz);正极接印堂穴,负极接一侧迎香穴,刺激时长10 min;负极换另一侧迎香,刺激时长10 min,每日1次。电针干预于模型复制开始后第1天同步进行。共干预10次,5次后休息2 d,共12 d。
2.2.2 左旋多巴组 将左旋多巴(10 mg/kg)和苄丝肼(2.5 mg/kg)溶解于0.9%生理盐水,配置为左旋多巴注射液,每日定时于腹腔注射0.2 mL,每日1次,共10次,5次后休息2 d,共12 d。
2.2.3 模型组及空白组 模型组仅使用LPS经鼻滴注持续进行模型复制,之后不进行任何干预。空白组与电针组同步抓取,不进行固定及针刺干预。
2.3 行为学检测方法 在干预结束后,对各组小鼠进行行为学测试。水迷宫实验包括定位航行实验与空间探索实验。在直径150 cm的圆形水池中加入温水(22~26 ℃),将水池分为4个象限,设置参照物。随机选取一个象限放置平台,位于水下2 cm。需进行5 d定位航行试验,每天定时由同一工作人员将小鼠分别随机从4 个象限放入水中,将其攀爬至平台的时间记为潜伏期。在测试中,如果小鼠60 s内未找到平台,工作人员需要帮助其上平台,随后停留10 s,记录其逃避潜伏期为60 s。记录每次的潜伏期测试值。行为学测试结束后进行心脏灌注取材。
2.4 免疫组织化学法检测HMGB1表达水平 麻醉小鼠后,用4%多聚甲醛固定脑组织,根据小鼠脑立体定位图谱,切除前囟后,于3~4 mm的冠状切面,采用脑模具截取黑质及纹状体部分,梯度乙醇脱水,二甲苯透明后石蜡包埋,将组织包埋块切成厚度约5 μm的组织片,捞片后烘干。切片脱蜡、梯度乙醇水化,PBS清洗,灭活过氧化物酶,并煮沸进行抗原修复,PBS清洗后用BSA封闭液封闭,一抗孵育4 ℃过夜,室温放置30 min,PBS冲洗后滴加二抗孵育,PBS冲洗,滴加SABC,配置DAB溶液显色反应,水洗,苏木精染核,梯度脱水后透明中性树脂封片并观察。
2.5 Western blot检测HMGB1、NF-κB蛋白表达水平 取小鼠脑组织加入RIPA裂解液与PMSF[V(RIPA)∶V(PMSF)=100∶1],在无菌环境下,冰上研磨30 min,于4 ℃、12 000 r/min条件下离心,15 min后取上清液置于离心管-80 ℃储存。测定蛋白含量(Bradford法),分离样品蛋白,制备分离胶与浓缩胶,根据蛋白浓度计算上样量进行蛋白上样,随后进行SDS-PAGE电泳1.5 h,在转模缓冲液中转移至PVDF膜,将其放置于5%脱脂奶粉封闭液室温封闭1 h,于4 ℃冰箱分别置于HMGB1、NF-κB及GAPDH一抗中孵育过夜,TBST洗膜5 min,共3次,使用相应二抗避光室温孵育1 h,TBST洗膜5 min,共3次,使用化学发光试剂显影后,结果用Bio-RAD Quantity one 图像分析软件进行扫描,分析HMGB1、NF-κB及内参GAPDH的灰度值。
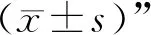
3 结果
3.1 4组小鼠行为学测试结果比较 模型组小鼠抵达终点用时多于空白组(P<0.05);电针组到达终点时间较模型组明显减少(P<0.05)。见表1。

表1 4组小鼠行为学测试结果比较
3.2 4组小鼠黑质区HMGB1阳性细胞表达水平比较 与空白组比较,模型组黑质中 HMGB1阳性细胞数升高(P<0.05);与模型组比较,电针组黑质中HMGB1阳性细胞数降低(P<0.05)。见图1、表2。
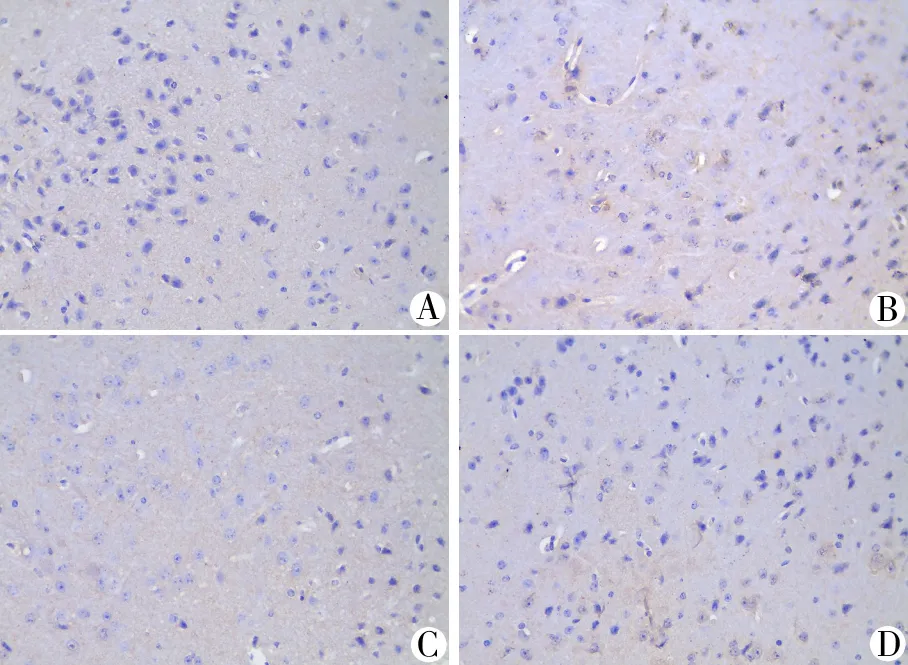
注:A.空白组;B.模型组;C.左旋多巴组;D.电针组

表2 4组小鼠黑质区HMGB1阳性细胞数比较
3.3 4组小鼠黑质区HMGB1、NF-κB蛋白表达水平比较 与空白组比较,模型组小鼠黑质区HMGB1、NF-κB蛋白表达水平升高(P<0.05);与模型组比较,电针组黑质中HMGB1表达水平降低(P<0.05),而NF-κB表达水平的差异无统计学意义(P>0.05)。见图2、表3。
4 讨论
PD的致病机制复杂,遗传、年龄、环境等多种因素交错影响导致发病。目前中国人口老龄化趋势明显,PD患者逐步增多,其治疗多采用多巴胺类药物替代治疗缓解患者运动障碍,而长期服用后存在疗效减退,症状波动,容易出现并发症。因此,深入探究PD发病的分子机制并寻找新的治疗靶点至关重要。

图2 4组小鼠黑质中NF-κB蛋白、HMGB1蛋白表达水平比较

表3 4组小鼠黑质区HMGB1、NF-κB蛋白表达水平比较
HMGB1作为促炎因子,在炎症反应晚期作用突出[13-16]。HMGB1在大脑中主要位于神经细胞、小胶质细胞和星型胶质细胞[17-18],主要功能是参与维持核小体结构稳定,调节基因转录、细胞迁移和神经细胞生长[19]。在PD患者中,HMGB1主要位于路易小体及路易神经细胞突起[20],是PD病理中的关键细胞死亡因素。有研究[21]表明,大鼠的HMGB1可特异性结合α-突触核蛋白。因此,抑制HMGB1表达是PD的一个新的治疗靶点[22]。免疫组织化学及蛋白免疫印迹法检测结果表明,“嗅三针”干预后,小鼠黑质区HMGB1的表达水平降低。课题组前期研究结果[23]证实了“嗅三针”早期干预对肿瘤坏死因子-α、白细胞介素-6等有抑制作用。结合本次实验结果,证实“嗅三针”可以抑制HMGB1表达及神经炎症的发展,起到延缓疾病进程的作用。
有研究[24]表明,在大鼠神经细胞及胶质细胞原代培养中,HMGB1可以与MAC1作用后结合小胶质细胞膜上的受体,并激活NF-κB信号通路,促进还原型烟酰胺腺嘌呤二核苷酸磷酸酶氧化酶活化,诱导慢性持续进展的神经炎症反应及黑质致密部多巴胺能神经细胞的变性缺失。TLR4作为一种细胞表面识别受体,可识别内源性HMGB1,募集髓样分化因子MyD88样接头蛋白,随后与白细胞介素-1等受体相关激酶家族蛋白形成复合物,最终促使核转录因子进入细胞核发挥调控作用[25-26]。本研究结果表明,“嗅三针”对于NF-κB p65的表达无明显作用,故考虑嗅三针的作用机制可能与HMGB1结合RAGE受体诱导的自噬、基因转录有关,仍需进一步研究其具体机制。
“嗅三针”是刘智斌教授创立的特色电针疗法,多年的临床实践发现该疗法对改善早期神经退行性疾病的嗅觉障碍疗效明确。根据其“感知一体,嗅脑同治”的思想基础,嗅觉作为人体重要感觉之一,中枢位于海马区,而海马区也是机体学习记忆等认知功能的中枢。“嗅三针”通过兴奋嗅觉通路,达到疏通经络、醒智开窍的效果。迎香穴归属于手阳明大肠经,可治疗嗅觉障碍。该穴为手阳明、足阳明经交会之穴,交通经脉气血,既可以应用于胃经病证,也可用于头面五官疾病和神志病等。印堂穴属督脉,“入络脑”,有醒脑开窍之效,该穴多用于鼻渊、鼻衄、嗅觉障碍等,但也可治疗督脉循行远隔的脑部疾患,如痴呆、癫狂。因此,对于神经系统退行性病变,选用此二穴同治。本实验结果显示,“嗅三针”的早期干预可抑制PD小鼠HMGB1表达,抑制神经炎症发展,缓解PD认知功能障碍,为治疗PD提供了理论依据及治疗靶向。
