二至丸对绝经后骨质疏松鼠的作用观察及可能机制研究
2020-12-07姜宜妮梁健闵建新曾文泓
姜宜妮 梁健 闵建新 曾文泓
摘要 目的:观察二至丸对绝经后骨质疏松模型鼠的治疗作用,并探讨其可能的作用机制。方法:将100只雌性SD鼠随机分为空白组(n=20)和造模组(n=80),造模组大鼠均接受双侧卵巢切除术致骨质疏松模型,将成模大鼠随机分为模型组、低剂量组、中剂量组及高剂量组,每组20只,造模12 h低剂量组、中剂量组及高剂量组分别予3、6、12 g/kg二至丸灌胃,1次/d。模型组与空白组均予1 mL生理盐水灌胃,连续干预8周,比较各组骨组织病理学、组织形态计量学、骨密度生物力、血脂代谢、组织Wnt/β-catenin通路标志性因子的改变。结果:与空白组比较,模型组脂肪细胞明显增大,脂肪细胞密度、面积、FLAW、PPARγ显著增加,外周血TC、TG和LDL-C含量上调(P<0.01)。与模型组比较,二至丸中剂量组和高剂量大鼠上述指标表达下调(P<0.05);与空白组比较,模型组大鼠BV/TV、Tb.Th,Joint、骨密度、弹性模量、最大载荷、Wnt3a、β-catenin、LRP5表达均减少(P<0.05);与模型组比较,二至丸中剂量组和高剂量组上述指标表达均显著增加(P<0.05)。结论:二至丸可明显改善骨质疏松症,其作用机制可能与激活Wnt/LRP5/β-catenin通路有關。
关键词 骨质疏松;二至丸;不同剂量;作用机制;Wnt/LRP5/β-catenin通路
Abstract Objective:To observe the therapeutic effects of Erzhiwan on Postmenopausal Osteoporosis Rat Model and discuss the possible mechanism.Methods:A total of 100 female SD rats were randomly divided into blank group(n=20)and ovariectomy group(n=80),the rats of ovariectomy group were given bilateral ovariectomy to induce osteoporosis and randomly divided into model group(n=20),low-dose group(n=20),middle-dose group(n=20)and high-dose group(n=20).About 12 h after modeling,the low-dose group,middle-dose group and high-dose group were given Erzhiwan 3 g/kg,6 g/kg,12 g/kg by gastric perfusion per day.The rats of model group and blank group were given normal saline 1 mL by gavage.The rats were treated for 8 weeks.Bone histopathology,bone histomorphometry,biomechanics,blood lipid metabolism and changes of key factor of Wnt/β-cateni pathway were compared.Results:Compared with the blank group,fat cell hypertrophy,density of lipocyte,cell area,FLAW and PPARγ markedly increased,TC、TG and LDL-C in Peripheral blood were down regulated in model group(P<0.01).Compared with the model group,the above mentioned indexes were markedly decreased in middle-dose group and high-dose group(P<0.05).Compared with the blank group,BV/TV,Tb.Th,Joint,bone mineral density,elastic modulus,maximum load and expressions of Wnt3a,β-catenin and LRP5 markedly decreased in model group(P<0.05).Compared with the model group,the above mentioned indexes were markedly decreased in middle-dose group and high-dose group(P<0.05).Conclusion:Erzhiwan can prevent osteoporosis effectively,the mechanism may be related to the activation of the Wnt/β-catenin signaling pathway.
Keywords Osteoporosis; Erzhiwan; Different doses; Mechanism; Wnt/β-catenin signaling pathway
中图分类号:R285.5文献标识码:Adoi:10.3969/j.issn.1673-7202.2020.21.011
中医并无“绝经后骨质疏松”的病名记载,根据该病的病因病机及相关临床症状将其归于“骨痿”“骨痹”“骨枯”等疾病的范畴[1]。中医认为肾主骨生髓乃先天之本,《证治准绳》曰:“肾虚不能生肝,肝虚无以养筋,故机关不利”,由此可见“肝肾同源”下先后天之精血的互化及相互作用,共同介导骨骼疾病的转归[2]。二至丸是补益肝肾之良方,现代中医将其大量运用于治疗绝经后骨质疏松[3-5],但其作用机制目前尚不明了,基于此我们利用大鼠模型,不同剂量二至丸进行干预,旨在探讨二至丸治疗绝经后骨质疏松的可能机制,为临床提供客观依据,具体报道如下。
1 材料与方法
1.1 材料
1.1.1 动物 雌性SD鼠[购自湖南斯莱克景达实验动物有限公司(许可证号码:SYXK(湘)2016-0002)]100只,体质量(230±15)g,鼠龄(5±0.5)个月。所有大鼠均饲养于江西中医药大学动物实验中心SPF级动物实验室中,许可证号为:SYXK(赣)2014-0008。大鼠接受同批次饲料喂养,饲养环境:温度(23±1)℃,湿度(50±2)%,昼夜12 h/12 h交替,干预操作均在下午14:00-17:00进行。
1.1.2 药物 二至丸(雷允上药业有限公司;国药准字Z32020882)。
1.1.3 试剂与仪器 水合氯醛溶液(广州沛瑜生物制品有限公司,货号:AAPR177-500),总胆固醇(TC)含量检测试剂盒(武汉博士康生物工程有限公司,货号:38293),三酰甘油(TG)含量检测试剂盒(武汉博士康生物工程有限公司,货号:38222),低密度脂蛋白(LDL-C)含量检测试剂盒(武汉博士康生物工程有限公司,貨号:19232),高密度脂蛋白(HDL-C)含量检测试剂盒(武汉博士康生物工程有限公司,货号:18723),Wnt3a一抗抗体(货号:23915),LRP5(货号:57315),DKK1(货号:46875),RUNX2(货号:12556s),β-catenin(货号:12475s),β-actin(货号:4970T)均购自美国CST公司。双能X线BMD仪(奥斯托公司,韩国,型号:EXA-3000),电泳制胶架(碧云天生物公司,货号:E6030),转膜系统(Bio-Rad公司,美国,货号:E1130),台式低温高速离心机(BECKMAN公司,美国,货号:64R),酶标自动分析仪(BIO-BAD公司,美国,型号:ELX800),精密电子万能材料试验机[大迈仪器(上海)有限公司,货号:AGS-J],微计算机断层扫描设备(micro computed tomography,Micro-CT)(BRUKER microCT公司,德国,型号:SKY SCAN-1172)
1.2 方法
1.2.1 分组与模型制备 100只大鼠数字随机分为空白组、模型组、低剂量组、中剂量组及高剂量组,每组20只,所有大鼠在体质量、鼠龄等方面差异无统计学意义(P>0.05),可进行组间比较。参考文献[6]中的模型制备方法:所有大鼠适应性喂养7 d,称重,用10%的水合氯醛溶液(0.2 mL/kg)腹腔内注射麻醉后固定动物于手术台上,常规无菌操作,于大鼠下腹部正中切开约1 cm的切口,逐层切开皮肤、皮下组织进入腹腔,行双侧卵巢切除术。先结扎输卵管与伴行血管再切除卵巢,同法处理对侧。最后,用10%青霉素溶液冲洗切口,逐层缝合。术后3 d每只大鼠臀肌注射青霉素[2万单位/(100 g·d)]预防感染。空白组大鼠开腹后仅切除少量脂肪后缝合。
1.2.2 给药方法 造模12 h后对大鼠进行药物干预,各组干预具体如下:1)二至丸低剂量组:在无菌条件下行双侧卵巢摘除术,同时给予二至丸灌胃(3 g/kg),1次/d。2)二至丸中剂量组:在无菌条件下行双侧卵巢摘除术,同时给予二至丸灌胃(6 g/kg),1次/d。3)二至丸高剂量组:在无菌条件下行双侧卵巢摘除术,同时给予二至丸灌胃(12 g/kg),1次/d。4)模型组:在无菌条件下行双侧卵巢摘除术,1 mL生理盐水灌胃对照观察。5)空白组:大鼠开腹后仅切除少量脂肪后缝合,1 mL生理盐水灌胃对照观察。均连续干预8周。
1.2.3 检测指标与方法
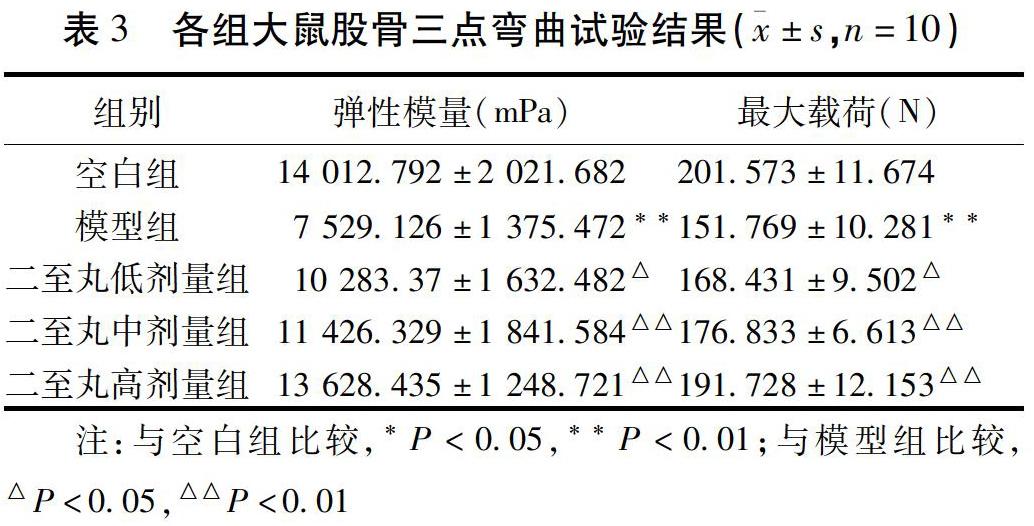
1.2.3.1 各组骨组织病理学改变 干预结束后各组随机选取3只大鼠,充分麻醉后处死,冰上取出右侧胫骨,将组织样本置于4%多聚甲醛中固定24 h,10%EDTA脱钙42 d后,取大鼠右侧胫骨骨骺线下0.5 cm,进行密封脱水[乙醇I(100%),乙醇II(95%),乙醇III(90%),各1 h;乙醇IV(80%),乙醇V(75%),各50 min;乙醇VI(70%),45 min,二甲苯I,二甲苯II,各10 min;二甲苯III,20 min;石蜡I,50 min;石蜡II,1 h;石蜡III,90 min]、石蜡包埋、切片(厚度为5 μm),45 ℃烤片2 h,随后置于倒置显微镜下观察骨组织病理学变化(骨髓脂肪细胞平均直径、密度,脂肪空泡面积)。
1.2.3.2 各组骨组织形态计量学变化 利用microCT对各组大鼠右侧胫骨进行骨组织形态扫描,由此进行计量记录,从胫骨近心端骨垢线消失处开始扫描,直至胫骨远心端,扫描厚度10 μm,共扫描70层。应用全自动图像数字化分析仪对所得图片分析处理,记录单位体积骨小梁骨(BV/TV,1/4)、骨小梁平均宽度(Tb.Th)、骨小梁平均间距(FLAW)、骨小梁节点数(Joint)、相对类骨质量(OV/BV,1/4)、成骨细胞指数(OBI,个/mm)、矿化沉积率(MAR,m/d)、矿化延迟时间(MLT,d)、骨形成率(BFR,m/d)。
1.2.3.3 各组骨密度检测 干预结束后每组随机选择3只大鼠,充分麻醉后处死,取右侧股骨,使用双能X线BMD仪(DXA)检测样本的BMD,将解冻后的骨样本整齐的摆放在检测床上开始检测,结果用g/cm2表示。
1.2.3.4 各组大鼠生物力学指标 检测完BMD的股骨用AGS-J系列精密电子万能材料试验机检测最大载荷和弹性模量。具体方法:将股骨头凹面朝下,股骨头端朝前的位置放置于跨距为17 mm的2个支撑点上,压头大概在股骨长度中间位置的正上方给标本施加向下10 mm/min的载荷,直至股骨断裂,最后记录并计算最大载荷和弹性模量,股骨断裂前所能承受的最大力为最大载荷,股骨断裂时所承受的力为断裂载荷。
1.2.3.5 各组血脂代谢指标 干预结束后每组随机选择3只大鼠,充分麻醉后取腹主动脉血,4 ℃,5 000 r/min,离心半径5 cm条件下离心10 min,取上清液利用全自动生化分析仪检测TC、TG、HDL-C、LDL-C水平。
1.2.3.6 骨组织Wnt/β-catenin通路 干预结束后每组随机选择3只大鼠,充分麻醉后处死,冰上快速取出右侧股骨,加入RIPA蛋白裂解液,匀浆机中匀浆30 min,将样本置于4 ℃,5 000 r/min,离心半径5 cm的条件下离心20 min,取上清液(总蛋白溶液),用BCA法进行蛋白浓度检测并得出各个样本上样量,并将样本加入电泳凝胶内进行跑胶,目的蛋白完全分离后转膜至PVDF膜上,加入5%脱脂奶粉进行条带封闭,2 h后用TBST漂洗条带,术后加入Wnt3a、LRP5、DKK1、RUNX2、β-catenin一抗抗体(均按照1∶1 000比例稀释),4 ℃,孵育过夜,TBST漂洗3次,加入羊抗兔二抗(1∶2 000稀释),室温下孵育2 h,再次用TBST漂洗条带1次,滴加ECL显影液发光显影,利用ImageJ软件分析蛋白相对表达量。
1.3 统计学方法 采用SPSS 22.0统计软件进行数据分析,计量资料由(±s)表示,数据符合正态分布的采用t检验,不符合正态分布采用秩和检验,多组采用单因素方差分析(one-way ANOVA)进行统计分析,检验水准α=0.05,以P<0.05为差异有统计学意义。
2 结果
2.1 各组骨组织病理学改变 与空白组比较,模型组脂肪细胞明显增大,脂肪细胞密度和面积显著增加(P<0.01)。与模型组比较,二至丸中剂量组和高剂量大鼠脂肪细胞明显减小,脂肪细胞密度和面积显著降低(P<0.01)。见表1,图1。
2.2 各组骨组织形态计量学变化 与空白组比较,模型组大鼠BV/TV、Tb.Th,Joint均减少(P<0.05),FLAW明显增加(P<0.05);与模型组比较,二至丸中剂量组和高剂量静力学参数BV/TV、Tb.Th,Joint均显著增加(P<0.05),而FLAW明显减少(P<0.05)。见表2。
2.3 各组骨密度及生物力学比较 与空白组比较,模型组骨密度显著降低(P<0.05),与模型组比较,二至丸中剂量组和高剂量组大鼠BMD显著增高(P<0.01);与空白组比较,模型组弹性模量、最大载荷显著降低(P<0.01),与模型组比较,二至丸中剂量组和高剂量大鼠弹性模量、最大载荷显著增高(P<0.01)。见图2,表3。
2.4 各组血脂代谢指标比较 与空白组比较,模型组大鼠外周血TC、TG和LDL-C含量上调,HDL-C表达减少,差异均有统计学意义(P<0.05),与模型组比较,二至丸中剂量组和高剂量TC、TG和LDL-C含量降低(P<0.05),HDL-C表达上调(P<0.05)。见表4。
2.5 各组骨组织Wnt/β-catenin通路改变 与空白组比较,模型组Wnt3a、β-catenin、LRP5表达显著降低(P<0.05),二至丸中剂量组和高剂量Wnt3a、β-catenin、PPARγ表达明显上调(P<0.05)。见图3。
3 讨论
大量文献资料显示Wnt/β-catenin通路是刺激成骨细胞增殖、成骨分化,抑制其成脂分化的重要通路,Wnt3a是Wnt信号通路重要的因子,Wnt3a与细胞膜上受体卷曲蛋白(Frizzled)结合后启动该通路,由此将细胞内的蓬乱蛋白激活,促使其与体轴发育抑制因子产生互作效应,抑制了β-catenin的磷酸化,由此导致β-catenin大量堆积与胞质内,并移位至细胞核,进一步启动下游靶因子。LRP5是该通路重要的下游靶因子,可促进骨髓间充质干细胞分化为成骨细胞,激活细胞外基质磷酸化糖蛋白(MEPE)基因启动子,从而诱发细胞外基质(ECM)矿化的发生[7-10]。有数据显示在胚胎发育早期,随着Wnt/β-catenin通路被抑制BMSCs成脂分化的程度越明显,从而引起骨量下降和骨密度减少,导致骨质疏松等疾病的发生发展[11]。由此可见Wnt3a、β-catenin、LRP5是关键因子,该3个指标的表达高低是Wnt/β-catenin通路激活状态的直接体现。Wnt/β-catenin通路已然成为中医药领域学者研究骨质疏松的热点,其相关性亦被不断证实。PPARγ是调控脂代谢的重要因子,其在脂肪组织有高表达,是脂肪形成的核心基因,主要调控脂肪细胞分化过程[12]。LPL是介导脂代谢过程的活性酶,在PPARγ调控下LPL可将机体的三酰甘油分解成甘油及游离脂肪酸,有数据显示上调PPARγ的表达及活性可驱动成骨细胞发生成脂分化,随着Wnt/β-catenin信號通路被抑制,最终将进一步加剧骨质流失[13],由此我们认为PPARγ即可促使成骨细胞成脂分化,亦可抑制其成骨分化,从而诱发骨质疏松的发生发展。LRP5是低密度脂蛋白受体,是调控成骨细胞分化的重要因子,LRP5是Wnt/β-catenin信号通路的辅助受体,LRP5的表达缺失可导致Wnt/β-catenin信号通路传导出现障碍,从而影响骨骼系统的调控。本研究中我们发现;模型组脂肪细胞明显增大,脂肪细胞密度、面积、FLAW显著增加,外周血TC、TG和LDL-C、LRP含量上调,BV/TV、Tb.Th,Joint、骨密度、弹性模量、最大载荷、Wnt3a、β-catenin、LRP5表达均减少。由此可见骨质疏松发生时骨密度下降,骨骼弹性、承载力下降,Wnt/β-catenin信号通路受抑制,由此我们认为上调LRP5表达,激活Wnt/β-catenin信号通路,抑制PPARγ将是有效改善骨质疏松的有效途径。
絕经后骨质疏松是女性常见疾病,归属于中医“骨痿”“骨痹”“骨枯”等疾病的范畴。肾乃先天之本,主骨生髓,《医精经义》曰云:“肾藏精,精生髓,髓养骨,故骨者,肾之合也,髓者,精之所生也,精足则髓足,髓在骨内,髓足则骨强”,由此骨质的强健取决于肾精的盛衰[14-15]。《黄帝内经》亦云“年四十而阴气自半”。女性至更年期,肾气渐衰,精亏血少,则肾阴更显不足,如加之肝火、心火之暗耗,故围绝经期妇女以肾阴虚居多,因此补益肝肾是治疗绝经后骨质疏松的关键。二至丸由女贞子、墨旱莲2味药组成,以《医方集解》记载者为常用方,有益肝肾、补阴血、壮筋骨的疗效[16],本研究将不同剂量的二至丸用于干预骨质疏松模型鼠,结果显示随着剂量的增加,二至丸在增加模型鼠骨密度,改善脂代谢方面疗效越显著,且随着浓度的增加,大鼠Wnt3a、β-catenin、LRP5表达越明显,PPARγ表达越下调。
由此我们认为6 g/kg和12 g/kg二至丸均可激活Wnt/β-catenin信号通路而抑制骨质疏松的发展,但是骨髓内微环境复杂多样,仅从一条通路探讨二至丸的作用机制尚不够全面,下阶段将进一步研究,深入探讨二至丸治疗骨质疏松的可能机制。
参考文献
[1]梁伟乔,钟诚,李宇明.骨质疏松症的中医病因病机认识与治疗进展[J].中国骨质疏松杂志,2020,26(1):135-139.
[2]袁丽丽.补肾健脾方对卵巢切除大鼠骨质疏松症的治疗作用及机制初探[D].北京:中国中医科学院,2019.
[3]李冠慧.绝经后骨质疏松症肾阴虚证的病理机制及补肾滋阴法干预研究[D].福州:福建中医药大学,2018.
[4]梁文娜,李西海,胡柳,等.二至丸抑制绝经后骨质疏松大鼠骨代谢紊乱的作用机制研究[J].中医正骨,2017,29(11):1-7,14.
[5]刘振涛,张怡元,林煜,等.二至丸促进围绝经期妇女成骨细胞增殖的分子机制[J].中国骨质疏松杂志,2017,23(4):524-529.
[6]陈朝祥,周淑平,张卫,等.伊班膦酸钠对卵巢切除所致骨质疏松模型大鼠的影响及机制[J].中国组织工程研究,2020,24(17):2625-2629.
[7]李涛,吴山,范志勇,等.基于Wnt/β-catenin通路中医药疗法治疗骨相关疾病研究进展[J].辽宁中医药大学学报,2020,22(4):117-121.
[8]许灿宏,陈跃平,章晓云.成骨信号通路在非创伤性股骨头坏死中的作用[J].中国组织工程研究,2020,24(14):2235-2242.
[9]葛磊.VitD调控Wnt/β-catenin信号通路对关节软骨细胞的作用机制研究[D].济南:山东大学,2019.
[10]赵常红,李世昌,孙朋.不同运动对生长期大鼠Wnt/β-catenin信号及软骨内成骨的影响[J].天津体育学院学报,2019,34(3):238-242,263.
[11]李亚芳,乔义强.NF-κB与Wnt/β-catenin信号通路在调控成骨方面的研究进展[J].河南医学研究,2019,28(4):767-769.
[12]刘亦斌,李小军,刘强,等.Wnt/β-catenin信号通路与自噬在骨关节炎软骨细胞中的相互作用[J].宁夏医科大学学报,2019,41(4):325-331.
[13]谢晚晴,郑洪新.基于Wnt/β-catenin信号通路的中医药干预骨关节炎的研究进展[J].中国骨质疏松杂志,2018,24(5):664-670.
[14]梁桂平.绝经后骨关节炎与骨代谢的相关性及中医证型分布研究[D].广州:广州中医药大学,2019.
[15]赖培茜.绝经后原发性骨质疏松症影响因素的分析研究[D].广州:广东药科大学,2019.
[16]程敏.二至丸及其组方药物防治骨质疏松与作用机制研究[D].西安:西北大学,2012.
(2020-04-30收稿 责任编辑:王明)
