18F-FDG PET/CT双时相显像对胃癌术后监测的临床价值
2020-12-07
内蒙古医科大学附属医院核医学科,内蒙古呼和浩特010050
引言
2015年全国肿瘤登记中心发布的我国癌症统计结果显示我国胃癌发病例数仅次于肺癌位居第2位[1-2]。2018年全球癌症统计报告中显示胃癌的发病率和死亡率分别居全球癌症发病和死亡的第5位和第3位,就地理位置而言,韩国、日本、中国等东南亚国家是胃癌高发区[3]。目前临床上手术切除是治疗胃癌最常用的方法,但是术后仍有30%~80%的患者出现复发转移[4],是临床医生棘手的难题。术后2年内复发称之为早期复发,徐晓燕等[5]研究中胃癌术后早期复发率为61.7%。如何早期诊断胃癌术后复发,对患者的术后治疗及预后有重要意义。目前临床上常用的内镜检查、实验室检查及X线(包括CT)检查对胃癌术后复发的诊断具有一定价值,但也有局限性[6]。随着医学技术的进展,分子影像学技术已被能够用到恶性肿瘤的定性诊断中,18F-FDG PET/CT是将功能性分子代谢显像与解剖图像融合后对病灶进行定性诊断。在非充盈状态下,多种因素会影响PET/CT对胃癌诊断敏感性和特异性,最常用的充盈是水中加高密度对比剂(泛影葡胺),本研究通过对比分析PET/CT双时相显像在胃癌术后复发诊断中的灵敏度、特异度、准确度、阳性预测值及阴性预测值,判断18F-FDG PET/CT双时相显像在胃癌术后监测的价值。
1 资料与方法
1.1 研究对象
2015年4月至2018年9月在内蒙古医科大学附属医院行18F-FDG PET/CT双时相显像的胃癌术后患者194例,纳入标准:①既往患胃癌行手术治疗者;②资料齐全;③患者检查前或检查后行胃镜活检病理诊断胃癌是否复发;④诊断残胃炎和其他良性病变,需随访半年以上证实无复发。排除标准:失访者。入选研究对象中男性145例,女性49例;年龄为 33~84岁,平均为(60.80±10.52)岁;术前组织病理学诊断:高分化腺癌35例,中分化腺癌58例,低分化腺癌74例,印戒细胞癌14例,混合类型13例。
1.2 主要仪器与显像剂
PET/CT为美国GE公司生产的Discover ST PET/CT扫描仪。示踪剂由美国GE公司使用医用回旋加速器(MINtrace)及合成模块自动合成。示踪剂18F-FDG放射化学纯度>95%。
1.3 显像方法及条件
1.3.1 常规显像
受检者禁食6h以上抽血送检,空腹血糖控制在10mmol/L以下,在安静状态下静脉注射18F-FDG,嘱患者静卧约45min,排空膀胱后进行PET/CT全身显像(扫描范围从颅顶至股骨上段,根据患者的身高扫描6~8个床)。PET和CT图像传送到xeleris工作站进行图像融合。
1.3.2 延迟显像
将10 mL复方泛影葡胺注射液与500 mL温水充分混合后,嘱患者尽最大耐受口服造影剂后行胃部局部18F-FDG PET/CT扫描。
1.4 图像分析及诊断标准
1.4.1 图像分析
两位高年资PET/CT中心医师同时进行双盲阅片根据病灶勾勒出感兴趣区,由计算机自动计算SUVmax,分别记录SUV早期及SUV延迟,最后汇总诊断。阅片出现分歧时,请高级职称医师进行共同阅片后讨论出最终诊断意见。
1.4.2 图像判断标准
(1)PET:①阳性:残胃壁局灶性代谢明显增高,显像剂放射性浓聚高于肝脏;②阴性表现:残胃壁有显像剂浓聚,但SUV≤2。
(2)CT:残胃壁局部增厚(CT值>20 HU),伴残胃腔不同程度狭窄或扩张为阳性,否则为阴性。
(3)PET/CT:PET阳性+CT阳性或阴性,均考虑肿瘤复发;PET阴性+CT阳性或阴性,考虑未复发。
1.4.3 诊断标准分析
诊断结果分为4类:a.真阳性,b.假阳性,c.假阴性,d.真阴性;敏感度:a/(a+c),特异度:d/(b+d),阳性预测值:a/(a+b),阴性预测值:d/(c+d),准确度=(a+d)/(a+b+c+d)。
1.5 统计学方法
本次研究所有数据使用SPSS 20.0软件进行数据分析,不同诊断方法与金标准检查结果的比较采用配对χ2检验,年龄采用均数±标准差(±s)表示,组间比较行 t检验,P<0.05为差异有统计学意义。
2 结果
2.1 胃癌术后病灶诊断结果及图像结果
所有患者行胃镜检查,取病灶组织行病理活检,结果提示117例为良性病变,77例为恶性病变。以一例患者(男,68岁)的早期相图像和充盈相图像为例进行展示,贲门部胃壁增厚伴代谢增高,术后病理为胃中低分化腺癌,见图1~2。

图1 早期相图像
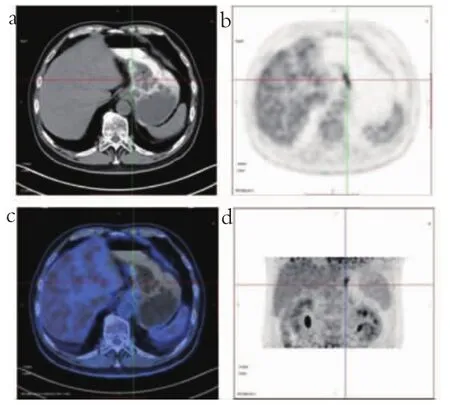
图2 胃部充盈相图像
2.2 胃充盈前不同诊断方法的结果
在胃充盈前,PET、CT及PET/CT三种检查方法分别与病理结果比较,差异均有统计学意义(P<0.05),其中PET检查灵敏度=60/(60+17)=77.9%,特异度=116/(116+1)=99.1%,准确度=(60+116)/(116+1+17+60)=90.7%,阳性预测值=60/(1+60)=98.4%,阴性预测值=116/(116+17)=87.2%;CT检查灵敏度=76/(76+1)=98.7%,特异度=31/(31+86)=26.5%,准确度=(31+76)/(76+86+1+31)=55.2%,阳性预测值=76/(86+76)=46.9%,阴性预测值=31/(31+1)=96.9%;PET/CT检查灵敏度=63/(63+14)=81.8%,特异度=115/(115+2)=98.3%,准确度=(63+115)/(115+2+14+63)=91.8%,阳性预测值=63/(2+63)=96.9%,阴性预测值=115/(115+14)=89.1%(表1)。

表1 胃充盈前PET、CT及PET/CT三种检查方法与病理检查结果比较(例)
2.3 胃充盈后不同诊断方法的结果
在胃充盈后,PET、CT及PET/CT三种检查方法分别与病理结果比较,与病理检查结果相当,差异均无统计学意义(P>0.05),其中PET检查灵敏度=69/(69+8)=89.6%,特异度=111/(111+6)=94.9%,准确度=(69+111)/(111+6+8+69)=92.8%,阳性预测值=69/(6+69)=92%,阴性预测值=111/(111+8)=93.3%;CT检查灵敏度=72/(72+5)=93.5%,特异度=109/(109+8)=93.2%,准确度=(109+72)/(109+72+8+5)=93.3%,阳性预测值=72/(72+8)=90.0%,阴性预测值=109/(109+5)=95.6%;PET/CT检查灵敏度=71/(71+6)=92.2%,特异度=113/(113+4)=96.6%,准确度=(71+113)/(113+4+6+71)=94.8%,阳性预测值=71/(4+71)=94.7%,阴性预测值=113/(113+6)=95.0%(表2)。
2.4 胃癌术后病灶PET/CT不同时相SUV比较
早期时相及延迟时相,胃癌术后恶性病灶处的SUVmax与良性病灶处的SUVmax比较,差异均具有统计学意义(t值分别为-21.723、-24.536,P<0.05),见表 3。
3 讨论
胃癌是目前临床发生率较高的恶性肿瘤,手术切除和放化疗是治疗胃癌主要的手段,胃癌预后与诊断时的分期密切相关,术后复发率依然居高不下[7],因此如何监测胃癌术后复发非常重要。X线双对比造影表现为残胃黏膜破坏、充盈缺损及龛影。有文献报道X线造影对残胃癌的检出率仅为48%[8]。因诊断的敏感性、特异性及准确性较低,临床对于胃癌复发的诊治受到部分限制。
胃镜检查结合黏膜活检是诊断胃癌的可靠方法,也是判断胃癌术后复发的“金标准”[9],但是取材存在不确定性,且与取材操作者关系密切,经验丰富胃镜操作者假阳性较低,经验欠缺或外生性生长者假阴性较高[10],本研究因入选对象均为胃癌术后的患者,全部行胃镜活检检查,但因无法再次手术,因而胃镜的假阴性无法验证,只能以患者临床随访资料为基础,对病理粗略估计。
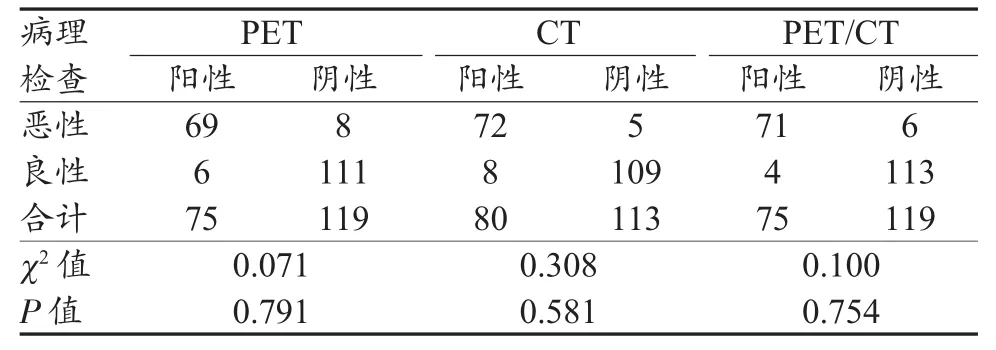
表2 胃充盈后PET、CT及PET/CT三种检查方法与病理检查结果比较(例)

表3 胃癌术后病灶PET/CT不同时相SUV比较
胃在未充盈状态时,CT检查无法准确辨别增厚的黏膜是术后胃黏膜皱襞增厚还是残胃癌胃壁增厚,另外胃癌切除术后,胃黏膜局部解剖层遭到破坏影响了诊断的准确性,但随着重建技术在临床的应用,CT对胃癌术后复发的诊断率大大提高,王勇等[11]研究发现,多层螺旋CT联合多平面重建技术在胃癌术后复发诊断敏感性与特异性为95.2%和100.0%。本研究发现CT诊断的灵敏度98.7%,特异度26.5%,准确度55.2%,阳性预测值46.9%阴性预测值96.9%,本研究CT诊断的特异度较低可能与未多平面重建和增强扫描有关。
肿瘤细胞对于18F-FDG的摄取量与肿瘤细胞增殖速度有关,炎性细胞、正常组织及良性病灶也可摄取FDG,因此会出现假阳性结果[12-13]。研究报道称,PET用于监测胃癌术后复发转移时,其灵敏度和特异度分别可达75%和77%,准确率可达75%[14],本研究PET诊断的灵敏度77.9%,特异度99.1%,准确度90.7%,阳性预测值98.4%,阴性预测值87.2%,灵敏度与文献报道一致,但特异度和准确性较文献高,可能与本研究入选患者印戒细胞和黏液腺癌相对较少,检查前各项准备充分及阅片者诊断经验有关。
18F-FDG PET/CT是一种新型的影像检查方法,实现了功能代谢影像与CT解剖图像同机融合,通过显示某个脏器生物代谢变化反应病灶情况。示踪剂18F-FDG是一种葡萄糖类似物,经静脉注射后,发生一系列生化反应后以FDG-6-磷酸形式存在。恶性肿瘤细胞代谢活跃,需要摄入更多的葡萄糖,因此对于示踪剂18F-FDG的摄取增多,形成浓聚灶,因此,18F-FDG PET/CT对于恶性肿瘤的诊断具有一定优势。目前临床上关于18F-FDG PET/CT双时相显像鉴别良恶性肿瘤的研究较多[15-17],但是关于18F-FDG PET/CT双时相显像在胃癌术后监测的报道甚少,本次研究以胃癌术后患者为研究对象,探讨其在胃癌术后复发中的监测价值。由于不同类型胃癌细胞FDG摄取存在差异,部分手术切除患者术后胃黏膜瘢痕增生也会出现不同程度生理性摄取FDG[18]。另外,研究发现1 8 F-FDG摄取相对较低或病灶呈现为弥漫性浸润者PET与CT图像显示的病灶匹配较差[19],因此,常规PET/CT灵敏度81.8%,特异度98.3%,准确度91.8%,阳性预测值96.9%,阴性预测值89.1%。胃癌术后恶性病灶处的SUVmax与良性病灶处的SUVmax比较,差异具有统计学意义(P<0.05)。既然常规PET/CT显像对胃癌术后部分病灶是否复发诊断难度较大时,需要采取某些技术手段排除前述因素干扰。本研究采用双时相造影剂充盈技术排除可能影响FDG摄取的因素,延迟扫描嘱患者扫描床上坐立后口服复方泛影葡胺混合液(15 mL泛影葡胺/150 mL水)约200~300 mL充盈胃腔,口服完药后行胃局部延迟显像。口服造影剂后,若为复发病灶,示踪剂则局限病固定于胃壁;若为生理性浓聚,受检者口服造影剂后会把示踪剂冲刷至十二指肠,在延迟显像时即可进行鉴别诊断,此方法对于PET的诊断及CT图像的判读均有帮助,因服造影剂后皱褶及粘贴的胃壁可以舒展,泛影葡胺又能使胃腔与胃壁产生良好的对比,有利观察胃壁的厚度及与周围组织的关系。前人研究发现PET/CT诊断残胃复发的灵敏度为91.2%,特异性61.5%,准确性82.3%,阳性预测值84.6%,阴性预测值75%[20]。本研究显示,PET/CT灵敏度92.2%,特异度96.6%,准确度94.8%,阳性预测值94.7%,阴性预测值95.0%,PET/CT对胃癌复发诊断准确度均增高,可能与PET/CT检查的时间、患者的病理类型等有关。特异度低于文献报道,主要原因可能是部分吻合口炎症有轻度18F-FDG高摄取,仔细分析CT无明显管壁增厚,临床无不适及肿瘤标记物正常患者纳入未复发组有关。本研究表明,造影剂充盈胃腔后胃癌术后恶性病灶处的SUVmax与良性病灶处的SUVmax比较,差异具有统计学意义(P<0.05),在对肿瘤病灶显示方面明显优于常规显像。部分印戒细胞癌、黏液腺癌18F-FDG PET显像易出现假阴性,对于这部分病人的诊断应当特别重视CT的作用,本文结果显示,充盈前14例PET假阴性的胃癌患者中,全部为印戒细胞癌,可以充分证明1 8 F-FDG PET/CT显像灵敏度、特异度及准确性与肿瘤细胞的病理类型密切相关。造影剂充盈后,18F-FDG PET/CT假阴性为6例,CT可弥补PET的不足,能显示吻合口的边缘、胃壁的厚度,肿瘤侵犯范围等。通过PET与CT图像进行对比研究发现,18F-FDG明显高摄取的局限性病灶,CT局部有胃壁增厚,PET所见的高代谢病灶与CT显示的病灶匹配良好,两者所显示的病灶侵犯范围基本一致。但对于印戒细胞癌、混合型癌等18F-FDG摄取相对较低或病灶呈现为弥漫性浸润者,PET显像清晰度较差。CT图像因胃的移位及腹水的影像,定位功能较差,PET和CT二者的匹配也较差,诊断的准确性较低。
总之,18F-FDG PET/CT作为胃癌术后监测的最重要手段之一,诊断的灵敏度、特异度及准确度方面存在一定不足,双时相充盈胃后延迟显像可提高胃癌监测的效能,但还需要结合临床症状、肿瘤标记物等,对于代谢较低的吻合口炎性病变和肿瘤复发需胃镜活检鉴别诊断。
