TiO2纳米管表面对成骨细胞与巨噬细胞黏附、形态及迁移的影响
2020-12-07刘婧孙华何奕德宋文张玉梅
刘婧 孙华 何奕德 宋文 张玉梅
钛种植体因其良好的生物相容性和机械性能而广泛应用于口腔种植领域。为了获得更加快速、稳固的骨结合,钛表面改性成为国内外研究的热点[1]。钛表面的纳米管形貌可模拟天然骨组织中的纳米晶体结构,具有促成骨、调节骨免疫等生物学效应[2-3],但其对不同类型细胞的调控机理仍不明确。研究表明,细胞黏附、迁移等行为特征是其增殖、分化并发挥功能的前提和基础。成骨细胞的成骨分化与细胞的黏附和增殖密切相关,而巨噬细胞的黏附及形态则影响其极化的方向和免疫调控功能的发挥[4-5]。因此,本研究通过阳极氧化法在钛表面制备纳米管形貌,分别研究了其对成骨细胞、巨噬细胞的早期黏附、细胞形态和迁移运动的影响,为进一步理解纳米形貌调控细胞的内在机理及种植体表面形貌设计提供理论依据。
1 材料与方法
1.1 主要材料
纯钛片(10 mm×10 mm×1.5 mm,西北有色金属研究院);碳化硅砂纸(STARCKE,德国);无水乙醇、丙酮、氢氟酸(天津富宇精细化工有限公司);戊二醛(北京雷根生物技术有限公司);Hoechst33342(上海碧云天生物技术有限公司);ɑ-MEM培养基、高糖DMEM培养基、胎牛血清(Gibco,美国);青霉素/链霉素、胰蛋白酶(Sigma,美国);磷酸盐缓冲液(北京索莱宝科技有限公司)。
1.2 主要仪器
超声波清洗器(KQ250B,昆山市超声波仪器有限公司);阳极氧化电源(MATSUSADA,日本);磁力加热搅拌器(上海帅登仪器有限公司);超净工作台(苏州净化);细胞培养箱(Thermo,美国);扫描电子显微镜(S-4800,Hitachi,日本);荧光显微镜(IX71)、活细胞工作站(IX81-ZDC)(Olympus,日本)。
1.3 钛试样制备及表征
方形钛片经800~5000 目碳化硅砂纸序列打磨抛光后,得到表面光滑的钛试样(P)并将其作为对照组;在20 V电压下及含0.5%氢氟酸溶液的电解液中,以表面光滑的纯钛试样为阳极,石墨电极为阴极,阳极氧化1 h,得到表面有TiO2纳米管的钛试样(NT)并将其作为实验组。将制备好的钛试样依次经丙酮、无水乙醇、去离子水超声荡洗并真空干燥后,于场发射扫描电子显微镜下观察其表面形貌。所有试样在接种细胞前,均使用75 %乙醇浸泡及紫外线照射消毒。
1.4 细胞培养
小鼠成骨细胞系MC3T3-E1(ATCC,美国)用含10%胎牛血清、100 IU/ml青霉素和100 μg/ml链霉素的ɑ-MEM培养基培养,每48 h换液1 次;小鼠巨噬细胞系RAW264.7(ATCC,美国)用含10%胎牛血清、100 IU/ml青霉素和100 μg/ml链霉素的高糖DMEM培养基培养,每24 h换液1 次。将细胞置于37 ℃、5%CO2饱和湿度条件下培养,待细胞密度为80%左右时传代,取对数生长期细胞用于后续实验。
1.5 细胞形态观察
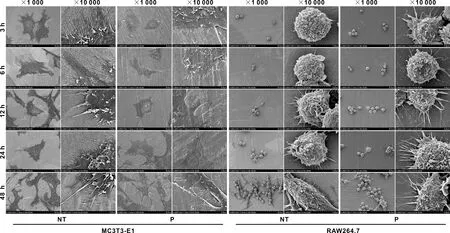
将P组和NT组钛试样置于24 孔板中,将成骨细胞和巨噬细胞按2×104个/孔的密度分别接种于各组钛试样表面,在接种3、6、12、24、48 h后终止培养。PBS漂洗细胞3 次,2.5%戊二醛固定过夜,依次用30%、50%、70%、80%、90%、100%乙醇脱水10 min,六甲基二硅胺烷再脱水30 min,真空干燥后即刻喷金,扫描电镜下观察细胞形态。
1.6 细胞黏附计数
细胞接种方法同1.5,分别在细胞接种3、6、12、24 h时终止培养,PBS漂洗3 次,4%多聚甲醛固定过夜,Hoechst 33342染色后荧光显微镜下拍照,使用Image J软件计数细胞。
1.7 细胞迁移轨迹追踪
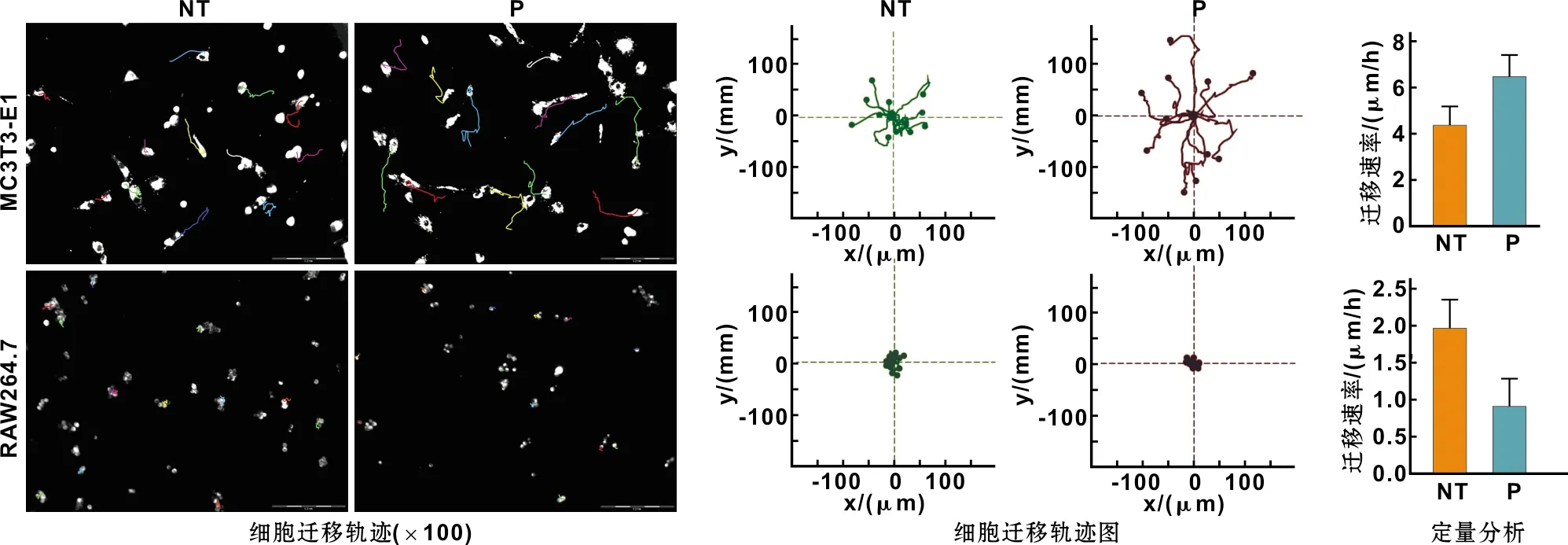
细胞接种方法同1.5,待细胞贴壁后转移至活细胞工作站内继续培养,每30 min拍照1 次,连续拍照24 h,将所得细胞时间序列图像生成视频,并经Image J软件处理得到细胞迁移轨迹。
1.8 统计学分析
采用SPSS 18.0统计软件对实验数据进行统计学分析。每个独立实验重复3 次,采用独立样本t检验分析组间差异,P<0.05为差异有统计学意义。
2 结 果
2.1 钛试样表面形貌观察
扫描电镜放大1 000 倍后可见,P组钛表面较为光滑,仅有少量划痕,NT组钛表面为云雾状形态;放大100 000 倍后可见,P组钛表面光滑无杂质,NT组钛表面为均匀排列的直径约80 nm的纳米管阵列(图 1)。

图 1 钛试样表面形貌
2.2 细胞形态观察
SEM观察显示:成骨细胞在2 组钛试样表面的细胞铺展均为不规则的多边形。NT组表面细胞边缘多为锯齿状且丝状伪足丰富,而P组表面细胞边缘较为光滑,多为板状伪足。巨噬细胞在2 组试样表面形态均近似为球形,细胞伸出丝状伪足。NT组表面细胞伪足较短且稀少,而P组表面细胞伪足较长且丰富(图 3)。
2.3 细胞黏附统计
如图 2所示。成骨细胞和巨噬细胞在钛试样表面的黏附数量均随着时间的延长而增多;在相同时间点,成骨细胞的黏附数量为NT组>P组,巨噬细胞的黏附数量为NT组 图 2 细胞接种试样表面3、6、12、24 h后细胞核荧光染色和定量分析(×40) 图 3 细胞接种试样表面3、6、12、24、48 h后的形态学观察 成骨细胞和巨噬细胞在钛试样表面均为无特定方向的不规则运动,但二者在不同形貌钛试样表面的迁移速率有所差异:成骨细胞在纳米管形貌上较光滑钛表面迁移缓慢,而巨噬细胞在纳米管形貌上较光滑钛表面迁移更为迅速(图 4)。 图 4 细胞在钛试样表面的迁移轨迹 钛种植体表面改性可以加快种植体植入体内后的骨愈合过程,缩短种植周期。常用的方法有喷砂酸蚀、激光处理、阳极氧化、涂层技术等[1]。本研究采用阳极氧化法,通过控制电压及阳极氧化的时间在钛表面制备了管径均一的纳米管形貌。该方法操作简便,可重复性强,为后续的细胞行为学评价提供了稳定可靠的材料模型。之后探讨了成骨细胞和巨噬细胞在不同形貌钛表面的黏附、形态及迁移运动的差异。 种植体的骨愈合过程涉及多种细胞的参与。种植体植入后,其表面迅速吸附纤维蛋白并形成血痂。之后,血液中的中性粒细胞、单核-巨噬细胞迁移至此发挥免疫调节作用。干细胞、成骨细胞黏附在种植体表面并不断分化形成新骨,破骨细胞在骨愈合中后期发挥着骨改建作用。种植体表面形貌的不同会影响细胞的行为;不同的细胞种类由于其所行使功能的不同,对同一种表面形貌的反应也会有所区别。研究表明,成骨细胞能够在纳米管表面快速黏附增殖并伸出大量丝状伪足,该丝状伪足可以帮助其锚定在纳米管上[6-8]。本研究发现,成骨细胞在纳米管表面的黏附能力明显强于光滑钛表面,纳米管表面细胞的丝状伪足更为丰富,光滑表面细胞则有较多的边缘光滑的板状伪足,这与前述研究结果一致[9]。细胞的黏附依赖于黏着斑的形成。由于纳米管的中空结构,培养液中的蛋白质主要吸附于纳米管管壁,为细胞黏着斑提供锚定位点[10]。成骨细胞的细长丝状伪足可能是为了不断伸展以寻找更合适的黏附位点[11]。与成骨细胞不同,发现巨噬细胞在纳米管表面的黏附数量及丝状伪足数量相较于光滑表面显著降低。有研究认为,钛基底经纳米管修饰后表面亲水性和负电性升高[12-13],而带负电的亲水性生物材料表面能够抑制单核-巨噬细胞的黏附且促进成骨细胞的黏附[14-15]。产生该现象可能的原因是亲水性和负电性的材料表面缺乏巨噬细胞黏附和伸展所需的整合素结合位点[16-17]。 本研究比较了细胞在不同形貌的钛表面迁移运动的差异。由于成骨细胞在纳米管表面黏附能力较强,其迁移速率明显较光滑表面的细胞缓慢。相反的,纳米管表面的巨噬细胞迁移运动更为明显。细胞的迁移运动是需要细胞形态高度协调变化,同时与其细胞外基质不断相互作用的过程。该过程可以分为4 个独立的步骤:细胞前缘伸展并黏附于细胞外基质,细胞骨架收缩并产生牵引力,细胞后缘黏附斑的解聚和细胞体的移动[18]。由此可见,细胞的迁移能力是与细胞黏附密切相关的,细胞黏附力越强,细胞迁移运动则越少。另外,细胞的迁移和分化是两个相互竞争的过程[19],成骨细胞的迁移停止以及有效的黏附定植,有利于细胞进行下一步的成骨分化[20]。上述实验结果也在一定程度上也解释了纳米管形貌表面具有更好的促成骨效应的原因[21]。近年来,通过材料表面的纳米形貌控制细胞的黏附和迁移行为,进而调控其功能发挥,成为材料表面修饰的热点[20]。细胞通过黏着斑等黏附相关蛋白与材料直接接触,能够感知基底形貌的差异并作出相应的反应。本研究发现纳米形貌表面的成骨细胞黏附能力更强,迁移速率更低,而巨噬细胞则与之相反,其内在机理仍有待于进一步研究。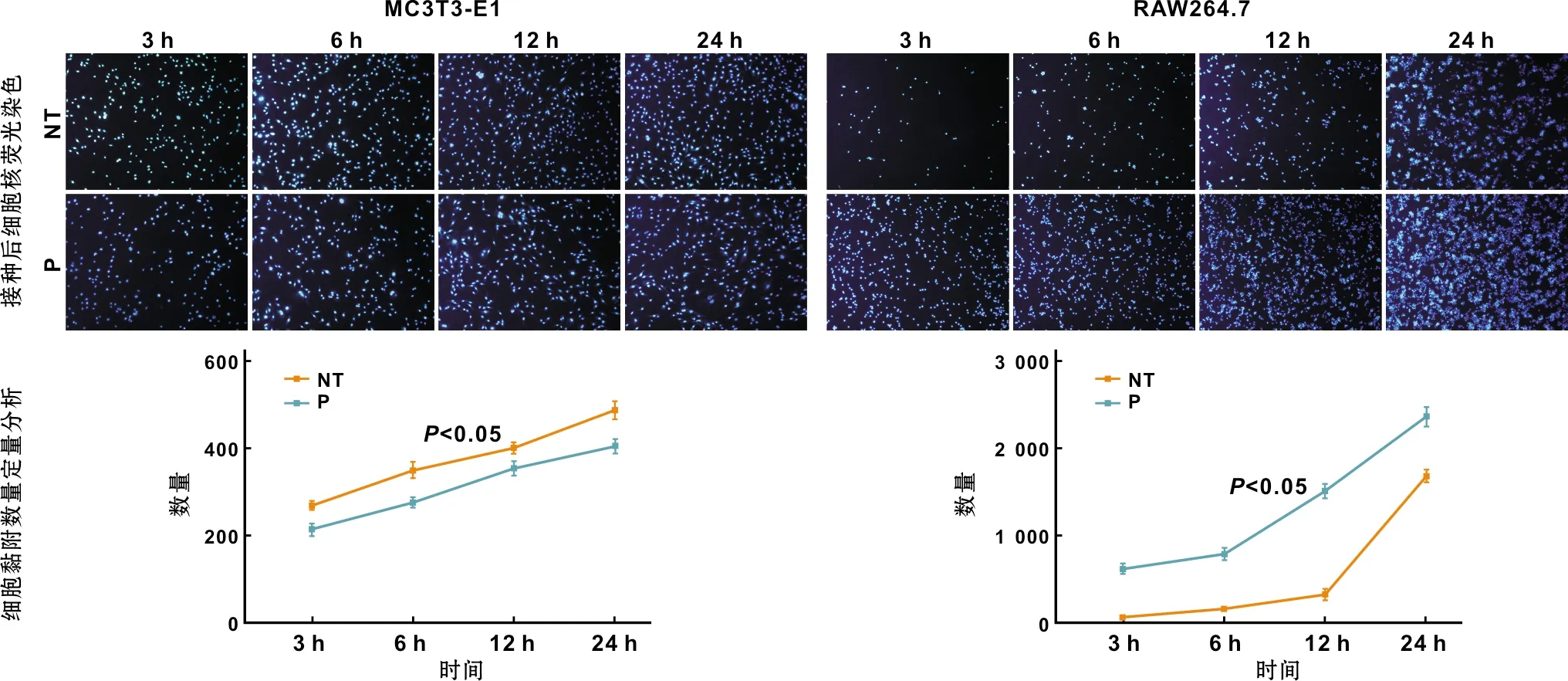
2.4 细胞迁移轨迹及速率统计
3 讨 论
