植入不同皮质骨厚度区域微种植体骨整合的组织形态学和生物力学研究
2020-12-07吴也可赵立星郜然然
吴也可 赵立星 郜然然
微种植体被常规用于支抗加强,尽管微种植体在正畸治疗结束后就去除,但微种植体因植体断裂或松动造成的失败率为0%~30%[1]。微种植体的初期稳定性即植入后的即刻稳定性,主要由微种植体周围皮质骨的质和量决定。二期稳定性,指骨和微种植体接触界面骨的状况,由骨整合(osseointegration,OI)获得。良好的初期稳定性是获得较高二期稳定性和存活率的基础。
近期,学者们关注不同根间区域的皮质骨厚度(cortical bone thickness,CBT),并提出微种植体植入最佳位点的临床指南[2-4]。骨的质和量对于正畸微种植体的初期稳定性乃至长期成功率至关重要[5]。研究者证实CBT值与微种植体成功率呈正相关,提示1 mm为改善微种植体成功率的临床CBT阈值[6]。作者前期研究表明,植入较厚CBT区域比植入较薄者的无应力载荷的微种植体在愈合早期具有更高稳定性[7]。上颌骨比下颌骨具有相对较薄的皮质骨。相关研究亦表明植入下颌骨的微种植体初期稳定性和成功率比上颌骨更高[8]。然而,一些人体和动物实验报道却得出相反结论[9]。作者也发现植入后7 周,上颌骨比下颌骨能获得更高的OI和稳定性[10]。基于临床经验和本课题组前期研究,猜想在不同CBT组微种植体的稳定性和OI值显著不同。
综上,本研究拟运用Micro-CT、拉拔试验和多重荧光序列标记法探讨不同愈合时间CBT对应力加载下正畸微种植体稳定性和OI的影响。
1 材料与方法
1.1 动物分组及微种植体植入
将48枚微种植体(长度6 mm,直径1.6 mm,Medicon公司,德国)植入12 只成熟骨龄Beagle犬(23 月龄,平均体质量11.7 kg)两侧胫骨,每个胫骨2 枚。动物由四川大学实验动物中心提供,均健康。本研究所有动物实验均经过四川大学实验动物伦理委员会批准。所有动物均经过系统和局部麻醉。钝性分离暴露胫骨骨面,切口远离术区,在胫骨近端干骺端植入2 枚微种植体,均在胫骨粗隆下方,分别距离干骺端2 cm和4 cm。CBT从胫骨末端到中心逐渐增加,即每个胫骨上的2 枚微种植体分别植入距干骺端2 cm处(薄CBT组,n=24)和距干骺端4 cm处皮质骨区域(厚CBT组,n=24)(图 1A)。植入术后即刻于干骺端一侧2 枚微种植体间安置镍钛螺旋拉簧,加载2 N的力(图 1B)。微种植体植入后1、3、5、7 周处死动物。
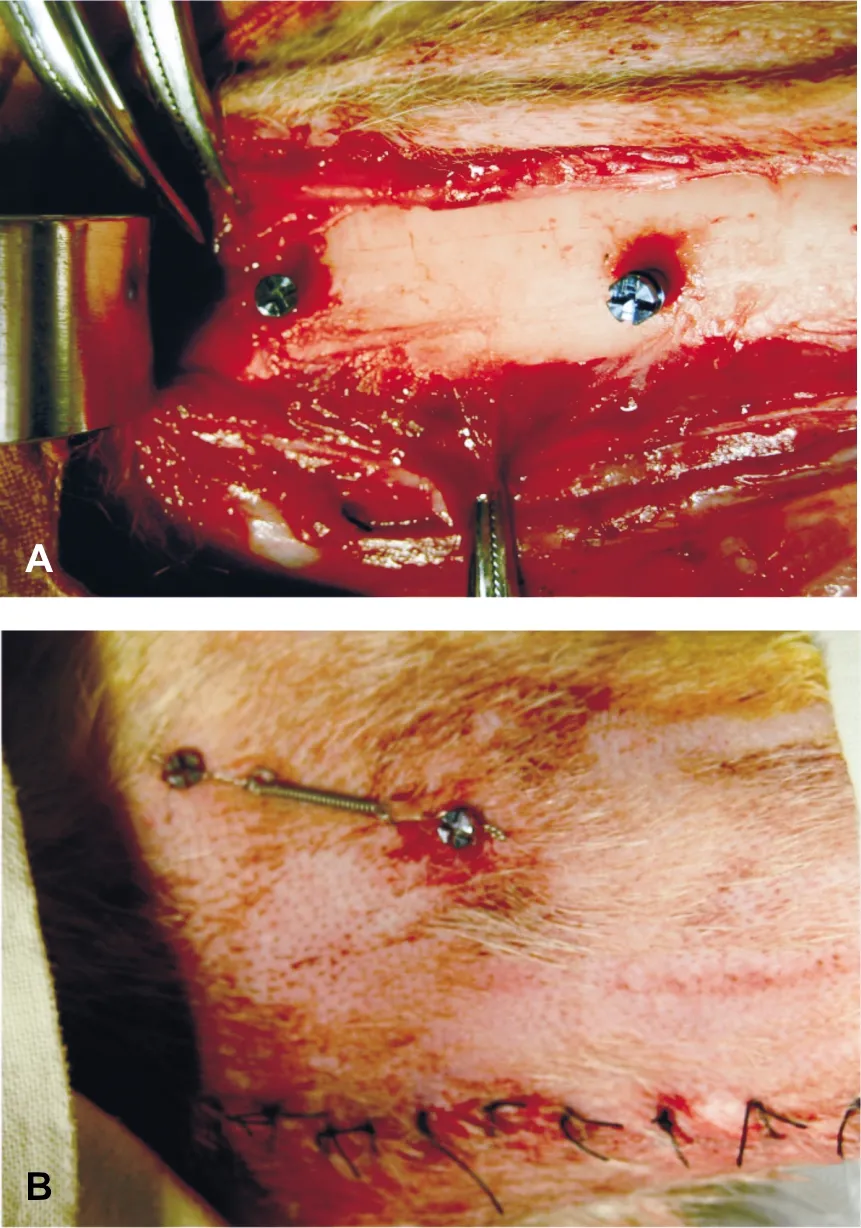
A: 2 枚微种植体植入胫骨近端干骺端的胫骨粗隆侧; B: 植入后,在2 个微种植体间用镍钛螺旋拉簧加载2 N应力
为评估微种植体植入后的骨重塑,用序列染色:植入后1 周,静脉注射四环素(20 mg),3周静注钙黄绿素(8 mg),5 周静注二甲苯橙(120 mg)。
1.2 检测样本制备
用过量戊巴比妥钠处死动物,取下带微种植体的胫骨,用涡轮机将标本修整成组织块,要求每个组织块包含一枚种植钉和其周围至少5 mm不含软组织的骨质。用游标卡尺测量每个骨块上方近中端和远中端的皮质骨厚度。经多重荧光序列染色的标本用5%戊二醛固定1 周,梯度酒精和氯仿轮流脱水,然后用聚甲基丙烯酸甲酯包埋。用显微薄片切片机(SP 1600,Leica公司,德国)低速(0.4 mm/min)将包埋的骨样本沿与微种植体长轴平行方向切片。其他骨/微种植体块用10%福尔马林溶液4 ℃固定。
1.3 Micro-CT检测
样本固定2 周后,按照以前报道方案进行Micro-CT(CT80,Scanco Medical公司,瑞士)检测[11]。计算以下形态学参数:松质骨体积密度(骨体积/总体积)(BV/TV),相交表面(与微种植体接触的骨表面)(IS)。微种植体的骨整合(OI)由IS与骨内微种植体表面积的比值计算而来。
1.4 生物力学拉拔试验
Micro-CT分析以后,在材料测试系统(Instron 5565,Instron公司,美国)上进行拉拔试验(图 2)[11]。监测施加应力及拉拔峰值载荷(Fmax)。
1.5 荧光显微观察和组织形态学分析
对多重荧光序列染色的样本,沿微种植体长轴切制200 μm厚硬组织切片。选取最接近长轴中点的3 张切片(共144 张),在荧光显微镜(IX71;Olypus公司,日本)下观察骨。用装有图形分析系统(Image-Pro Plus,Media Cybernetics公司,美国)的荧光显微镜拍摄显微图片,对愈合期间沉积于微种植体两侧的四环素、钙黄绿素和二甲苯橙进行定量分析。
1.6 统计学分析
采用SPSS 20.0软件对数据进行统计分析。用方差分析比较组间组织形态学和生物力学参数差异,不同时间点薄CBT和厚CBT组的均值用SNK-t检验进行比较。P<0.05具有统计学意义。
2 结 果
2.1 种植体植入成功率及相关影像
各组微种植体植入成功率为100%,所有微种植体在整个实验过程中均保持稳定,未见松动脱落。在各时间点,2 种植入位点的CBT差异均具有统计学意义(P<0.05,表 1)。显微CT的高分辨率断层图像清晰显示了骨-种植体界面,确定了与种植体相接触的骨组织并量化了OI,并且观察到微种植体周围皮质骨和松质骨内骨小梁有不同程度的吸收(图 3~4)。
2.2 生物力学相关指标

图 2 测试仪器 图 3 显微CT分析仪三维重建
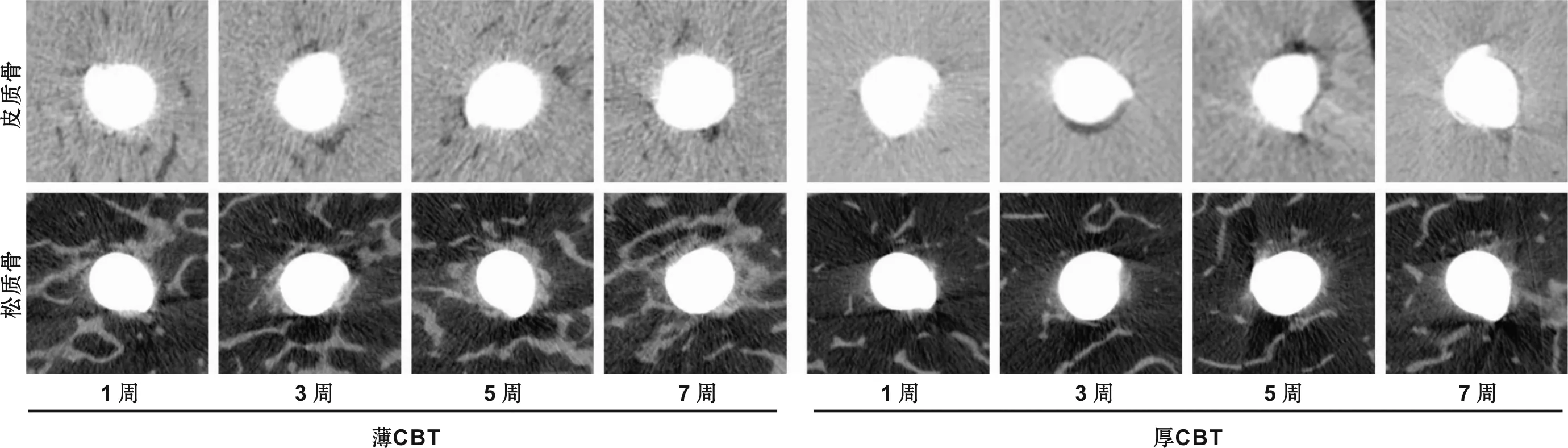
图 4 微种植体周围松质骨:含有中等松质骨体积密度值的代表性样本

表 1 微种植体植入位点的皮质骨厚度
植入后1 周,薄CBT组OI、BV/TV、IS和Fmax4 个指标均较厚CBT组低(P<0.05)。薄CBT组OI值为22.64%,厚CBT组为38.73%。拉拔试验结果显示,薄CBT组Fmax为261.27 N,厚CBT组为373.35 N(P<0.05)。植入后1~3 周,薄CBT组3个形态学指标显著增加(P<0.05),Fmax略有增加(P>0.05)。而在厚CBT组,上述4个指标均显著降低(P<0.05)。植入后3周,厚CBT组所有指标仍显著高于薄CBT组(P<0.05);植入后5 周,随愈合时间延长,薄CBT组形态学指标持续上升,开始显著高于厚CBT组(P<0.05)。厚CBT组Fmax开始略有增加,但第5周和第3周相比差异无统计学意义(P>0.05)。薄CBT组生物力学指标仍低于厚CBT组(P<0.05)。植入后7 周,厚和薄CBT组4个指标均较第5周有所提升。其中薄CBT组差异具有统计学意义,厚CBT组差异无统计学意义(P>0.05)。2 组间相比,厚CBT组的值仍高于薄CBT组,但差异无统计学意义(P>0.05)。这些检测指标总体变化趋势呈时间依赖性(图 5)。
2.3 骨重塑及骨整合
荧光显微镜分析结果表明在所有骨/微种植体切片均有明显骨重塑和骨整合。新形成的骨被多重荧光序列染色标记,钙黄绿素为较窄绿线,二甲苯橙为红色条带,四环素为弥散黄染形式。松质骨较皮质骨能更明显观察到多重荧光序列染色。在松质骨的部分区域,二级骨单位表现为松质骨周围同心圆状沉积的标记物(图 6)。在薄CBT组微种植体两侧能见到比厚CBT组更多的骨重塑。
表 2显示3 条最好的种植体螺纹内不同位点3 种荧光标记的沉积面积测量结果。薄CBT组压力侧值最大,而厚CBT组张力侧值最小。方差分析表明薄CBT组显著高于厚CBT组(P<0.05)。薄CBT组2 个表面的钙黄绿素沉积量均显著高于二甲苯橙和四环素(P<0.05)。在厚CBT组,四环素沉积面积显著低于其余2 种标记(P<0.05),但钙黄绿素和四环素间差异无统计学意义(P>0.05)。
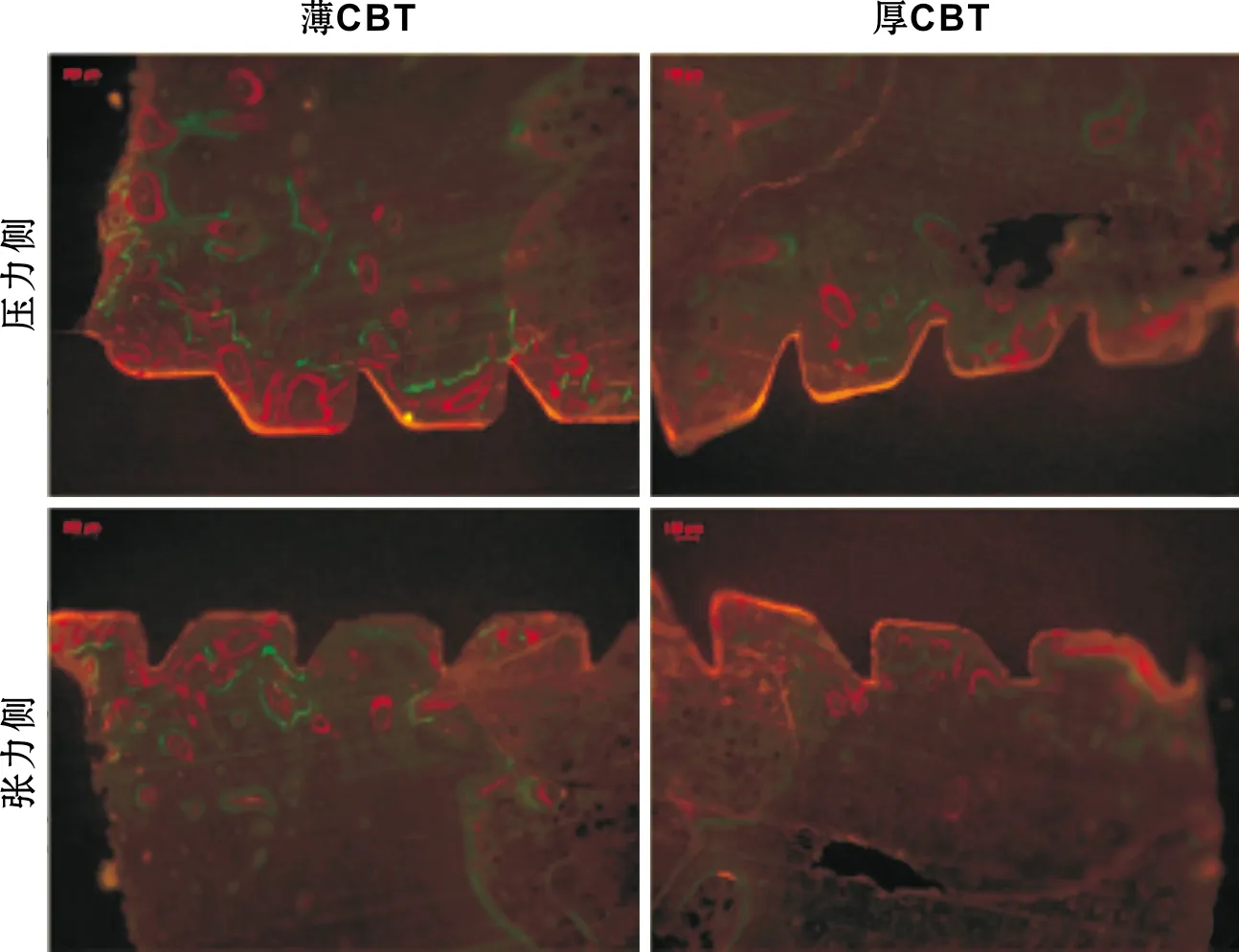
图 6 骨重塑和骨整合(荧光显微镜,×100)
表 2 多重荧光序列标记的沉积面积
Tab 2 Deposition area of the polyfluorochrome sequential labeling (mm2,

表 2 多重荧光序列标记的沉积面积
标记沉积面积压力侧张力侧四环素钙黄绿素二甲苯橙四环素钙黄绿素二甲苯橙薄CBT组29.71±0.92188.23±12.79104.96±7.722.47±0.2282.56±4.1290.31±6.04厚CBT组10.55±1.16113.15±9.5276.21±4.541.68±0.1455.70±4.6364.47±5.91
3 讨 论
由于微种植体解剖学限制较小,可根据正畸治疗的需要选择上颌骨或下颌骨很多位点植入,比如颧牙槽嵴、下颌骨外斜线、牙间/根间区以及前后牙槽突[12]。这些植入位点的CBT随解剖结构不同而异。胫骨具备规则的外形、皮/松质骨分界清楚、从干骺端到骨中段皮质骨厚度逐渐增加等典型长骨的解剖学特点,分别选择邻近胫骨干骺端和毗邻胫骨中段的区域作为薄和厚CBT组植入位点,并在不同CBT位点2个微种植体之间即刻加载2 N的应力。这样排除了复杂口腔环境等干扰因素的影响,以便精准探讨不同CBT对应力加载下微种植体稳定性的作用。
本研究综合运用了显微CT、拉拔试验和多重荧光序列标记实验来衡量植入2 个不同CBT位点微种植体的稳定性。其中,显微CT扫描显示了骨和种植体界面的三维高分辨形态学信息,比传统组织形态学分析提供了更精确的数据。然而,当界面有新的骨和软骨形成时,显微CT难以显示类骨质,计算所得OI值可能比实际偏低。因此,尚需生物力学拉拔试验检测微种植体的固位力以验证显微CT参数。另外,为了更好理解微种植体周围的骨重塑情况,本研究还参考Lopes等[13]报道的方案进行了多重荧光序列标记实验。综合以上实验结果,总结出以下几点:①植入后3周是骨重塑的关键阶段;②在不同阶段皮质骨形成显著少于松质骨,提示皮质骨骨重塑活性相对较低;③薄CBT组松质骨形成显著多于厚CBT组,其机制可能是较薄皮质骨相对更有利于机械应力传导进入其下松质骨,且薄CBT组密集分布呈编织状结构的松质骨可能也有利于更多新骨形成;④微种植体压力侧骨形成显著多于张力侧,更提示机械应力正性调控骨重塑。
本研究发现植入较厚皮质骨的微种植体获得了更高的初期稳定性,与很多研究结果一致[6-8]。推测原因如下:①薄CBT区域松质骨分布越密集,荧光标记显示骨矿化越好,越有利于获得高的二期稳定性;②微种植体植入皮质骨造成的损伤,因较差的血供和较低的再生能力,导致厚CBT组植入后OI%和Fmax有所降低;③厚CBT区域的形变能力较薄CBT更弱,导致对骨重塑很重要的机械应力难以传导进入其下的松质骨。研究结果提示正畸微种植体对初期稳定性的要求并不高,与之前牙科种植体的观点相悖。原因可能是牙科种植体承受各方向较大应力,而正畸微种植体仅负荷单一方向较小的力,过高的初期稳定性并非必要。鉴于正畸牙移动的适宜力值为0.3~4 N,远低于本研究采用的拉拔力,建议微种植体在任何治疗阶段均可负载正畸施力强度(0.3~4 N)[14]。正畸临床使用临时性支抗装置,最主要考虑的是植入部位应选择有充足松质骨量、血供丰富的解剖安全区域[15]。
4 结 论
厚皮质骨区域植入的微种植体具有更高的初期稳定性,薄皮质骨区域的微种植体随时间延长稳定性显著增加,后期二者差异无统计学意义。考量植入局部的骨条件,采用适宜的加载方式对成功治疗至关重要。
