富钠反钙钛矿型固态电解质的简易合成与电化学性能*
2020-12-05彭林峰曾子琪孙玉龙贾欢欢3谢佳
彭林峰 曾子琪 孙玉龙 贾欢欢3) 谢佳†
1) (华中科技大学电气与电子工程学院, 强电磁工程与新技术国家重点实验室, 电力安全与高效湖北省重点实验室, 武汉 430074)
2) (华中科技大学物理学院, 武汉 430074)
3) (华中科技大学材料科学与工程学院, 武汉 430074)
全固态钠电池兼具高安全和低成本的潜在优势, 是储能领域的热点发展技术之一. 高性能固态电解质是实现全固态钠电池的关键因素. 近年来, 反钙钛矿型锂/钠离子导体因高离子电导率和灵活的结构设计, 已经受到广泛关注. 然而, 富钠反钙钛矿型Na3OBrxI1—x(0 < x < 1)的合成复杂、室温离子电导率偏低、且电化学性能研究较少. 本文通过简单合成路径得到纯相反钙钛矿型Na3OBrxI1—x, 经过100 ℃热处理之后, 其离子电导率在100 ℃可达10—3 S·cm—1 以上. 然而, 随着温度降低, 离子电导率会发生跳变. 通过固态核磁共振(NMR)分析, 表明该现象可能与材料复杂的结构对称性和钠位变化有关. 同时, 对Na3OBrxI1—x 在全固态钠电池中的可行性进行了评估. 研究表明, Na3OBrxI1—x 材料不具有“亲钠性”, 通过离子液体对界面进行修饰后, Na3OBrxI1—x展现出良好的钠金属相容性, 组装的TiS2/Na3OBr0.5I0.5/Na-Sn 全电池首次放电比容量为190 mAh·g—1. 本文促进了对反钙钛矿型Na3OBrxI1—x 结构和性质的理解, 并初步探究了其作为钠离子固态电解质的应用前景.
1 引 言
锂离子电池因高能量密度、高功率密度、长循环寿命等优势, 在近几十年得到迅速发展[1]. 尤其是2019 年诺贝尔化学奖授予三位在锂电行业具有杰出贡献的科学家, 更体现了锂离子电池对现代社会发展的深远影响[2]. 但由于锂资源的限制, 导致其成本较高, 促使电池行业积极寻找新的技术以替代锂离子电池. 考虑到钠资源丰富, 且钠与锂具有相似的化学性质, 钠离子电池作为替代锂离子电池的技术之一已经吸引了越来越多的关注[3-6]. 另一方面, 传统液态电池的安全性问题使人们更青睐基于固态电解质的全固态电池[7,8]. 固态电解质拥有不可燃性, 赋予全固态电池更高的安全性; 另外,固态电解质具有高电化学稳定性和适当的机械强度, 有利于与金属锂(或钠)匹配, 从而进一步提升电池能量密度[9,10]. 全固态钠电池结合钠离子电池低成本和全固态电池高安全优势, 在大规模储能系统拥有广泛的应用前景[11].
在全固态电池中, 固态电解质作为重要组成部分, 是影响全固态电池性能的关键因素. 近几年,关于锂/钠固态电解质的报道层出不穷, 经典的固态电解质体系主要集中在氧化物和硫化物[11-23].其中, 高离子电导率的固态电解质以硫化物为主[12,13,15,18,20], 氧化物通常需要1000 ℃以上热处理来提升离子电导率[16,24]. 反钙钛矿型Li3OCl 和Li3OCl1—xBrx是一类具有超离子电导率的固态电解质, 室温离子电导率在10—3S·cm—1以上[25]. 除此之外, Li3OCl1—xBrx也展现出良好的电化学稳定性和低熔点(约280 ℃), 使其在较低温度下处理即可减小晶界阻抗[25].Li3OCl1—xBrx的优异特性激起了研究者对富钠反钙钛矿材料的研究兴趣, 一系列富钠反钙钛矿Na3—2xMxOA(M= Ca, Sr;A= Cl,Br, I), Na3SO4F 等已经被成功合成[26,27]. 化学调控和放电等离子体烧结(spark plasma sintering,SPS)等可用于提升材料离子电导率[26-29]. 尽管优化后, Na3OBrxI1—x的离子电导率在200 ℃可达1.89 × 10—3S·cm—1, 但是室温下仍然低至10—7—10—6S·cm—1[26]. Braga 等[30,31]通过在前驱体中引入少量去离子水, 制备玻璃态电解质A2.99M0.005OCl1—x(OH)x(A= Li 或Na,M= Ba 或Ca), 离子电导率在室温下超过10—2S·cm—1, 但是该材料属于完全不定形态, 结构信息难以确定. 近期, 基于团簇阴离子的富钠反钙钛矿结构Na3OBH4被成功合成, 材料拥有典型的立方相晶体结构, 且由于离子的旋转特性, 可促进Na+离子迁移, 使其室温离子电导率提升至4.4 × 10—3S·cm—1[32]. 这些结果证明化学调控及热处理工艺对反钙钛矿晶体材料离子电导率的重要性, 表明进一步提升Na3OBrxI1—x离子电导率的可能性. 更重要的是, 目前关于富钠反钙钛矿的大多数工作集中在理论计算和提升离子电导率上[26,29,33-40], 很少有关于电化学稳定性和钠金属相容性等其他性质的报道, 而这些性质对评价电解质在全固态电池中应用的可行性具有重要意义.
本文在较低合成温度(250 ℃)成功制备富钠反钙钛矿Na3OBrxI1—x(0 <x< 1), 且材料离子电导率与文献相比有较大提升, 经热处理之后,Na3OBr0.3I0.7在100 ℃的离子电导率为1.47 ×10—3S·cm—1. 然而, 随着温度降低, Na3OBr0.3I0.7的离子电导率出现跳变, 固态核磁(NMR)分析表明,该现象可能与材料复杂的结构对称性和钠位变化有关. 进一步对Na3OBr0.5I0.5进行电化学性能研究, 结果显示, Na3OBr0.5I0.5材料具有良好的钠金属相容性, 且能保证固态电池稳定运行. 通过离子液体进行界面修饰后, Na-Na 对称电池在0.5 A·cm—2电流密度下稳定循环, 过电位在80 mV 以下; TiS2/Na3OBr0.5I0.5/Na-Sn 全电池在50 ℃, 0.1 C(1 C =240 mA/g)条件下, 首次放电比容量为190 mAh·g—1,循环10 圈后, 比容量保持在127 mAh·g—1左右. 稳定的电化学性能表明富钠反钙钛矿材料在固态钠电池方面拥有较好的应用前景, 对固态钠电池的发展具有重要意义.
2 实 验
2.1 材料合成
富钠反钙钛矿固态电解质Na3OBrxI1—x以Na2O(Alfa Aesar; AR, 80% Na2O, 20%Na2O2), NaBr(General-Reagent; AR, >99% purity)和 NaI(General-Reagent; AR, >99% purity)为前驱体合成, 制备过程参照Hipplern 等[41]的报道, 但合成温度大幅降低, 更利于实际生产. 具体过程如下:在手套箱内(H2O, O2< 0.1 ppm)将Na2O, NaBr,NaI 按照一定摩尔比称量后用研钵研磨均匀, 然后将混合粉末转移至氧化锆内衬的球磨罐中, 在350 rpm 转速下混合10 h, 将混合好的粉末压成片后密封在石英管中, 在250 ℃下煅烧12 h, 自然冷却后即得到所需样品. 按计量比不同将材料标记为Na3OBr0.7I0.3, Na3OBr0.5I0.5, Na3OBr0.3I0.7.
2.2 表征
X 射线衍射(X-ray diffraction, XRD)用于材料晶体结构分析, 2θ范围为25°—70°, 样品制备过程中用有机薄膜覆盖, 用于隔绝空气; 扫描电子显微镜(scanning electron microscope, SEM)用于观察电解质片冷压和热压之后的微观形貌; 固态核磁共振(nuclear magnetic resonance, NMR)用于分析不同温度下材料结构变化.
2.3 电化学测试
离子电导率测试过程中, 电解质片的制备如下: 每个样品取70 mg 左右置于直径10 mm 的聚醚醚酮(poly-ether-ether-ketone, PEEK)圆柱模具中, 在300 MPa 压力下冷压成片, 将成型的样品与不锈钢杆集流体接触, 密封在金属模具中, 并在100 ℃真空烘箱中保持12 h, 然后用输力强1260 A 测试样品在不同温度下的交流(AC)阻抗谱, 测试频率范围为0.1 Hz—10 MHz. 组装Na/Na3OBr0.5I0.5/Na对称电池用于评估电解质与钠金属之间的电化学稳定性, 电解质与钠金属之间引入6 µL/cm2离子液体(ionic liquid, IL)润湿界面, 其中离子液体成分为0.8 M NaTFSI 溶于PP13FSI. 对称电池分别在0.05 和0.5 mA/cm2电流密度下进行钠沉积测试.
2.4 固态钠电池的组装
以TiS2、科琴黑、聚(偏二氟乙烯)(poly(vinylidene fluoride), PVDF)分别为活性物质、导电剂、粘结剂, 质量比为8∶1∶1, 以N-甲基吡咯烷酮(NMethyl pyrrolidone, NMP)为溶剂混合均匀后形成复合正极浆料, 将浆料涂覆在涂碳铝箔上, 70 ℃干燥12 h 得到TiS2复合正极片, 其中活性物质含量约为1 mg·cm—2. Na-Sn 合金负极通过将Na 箔和Sn 箔热压后制得, 具体为: 将Na 箔和Sn 箔堆叠之后置于热压机上, 在80 ℃, 15 MPa 条件下保持15 min 即得到Na-Sn 合金. 固态电池组装过程在手套箱中进行, 首先, 将Na3OBr0.5I0.5以2.3 节中的方式冷压成片, 然后将正负极分别置于电解质片的两侧, 并提供38 MPa 左右压力以确保材料接触, 最后在正负极两侧分别添加6.4 µL·cm—2离子液体. 电池恒流充放电测试在0.1 C 倍率, 50 ℃条件下进行, 测试设备为新威尔充放电测试通道(CT4008), 所有电池测试过程均在手套箱中进行.
3 结果与讨论
3.1 XRD 表征
如图1 所示, 合成的Na3OBrxI1—x(x= 0.3,0.5, 0.7)样品的XRD 图谱与文献报道的反钙钛矿结构一致[26], 通过简单的合成方法得到的样品为纯相Na3OBrxI1—x, 不含其他杂质. 随着结构中I 含量增加, 衍射峰位置向左偏移, 根据布拉格方程2dsinθ=nλ(d为晶面间距;θ为入射线、反射线与反射晶面之间的夹角;λ为波长;n为反射级数),衍射峰左移, 说明θ减小, 即可判断d增大, 得出晶格尺寸增大的结论, 而晶格尺寸增大是因为I—的半径比Br—大, 说明I 成功掺杂. 另一方面, 本文中材料XRD 图谱没有观察到衍射峰劈裂, 而23Na NMR 谱却显示有两个Na 信号(图3(a)), 因此很难将合成的Na3OBrxI1—x归结为立方相或文献报道的P2/m单斜相空间群[26]. Na3OBrxI1—x材料结构将在之后结合23Na NMR 结果进一步讨论.
3.2 钠离子电导率
研究表明样品的处理方式对离子电导率的测试至关重要, 本文中Na3OBrxI1—x的离子电导率通过对材料在100 ℃热压之后, 利用交流阻抗法测得. Na3OBr0.5I0.5冷压和热压片的致密度对比如表1 所列, 通过计算电解质片的实际质量和体积,得出冷压和热压电解质片的密度分别为2.11 和2.55 g/cm3, 致密度分别为69%和83%, 这表明热压能促进样品的致密化. 如图2(a)和图2(b)所示,通过SEM 对Na3OBr0.5I0.5电解质冷压和热压片进行微观结构观察, 可以看出, 热压之后的电解质片具有更平整致密的表面结构.

表1 Na3OBr0.5I0.5 在冷压和热压下的密度Table 1. Density of hot- and cold-pressed Na3OBr0.5I0.5.
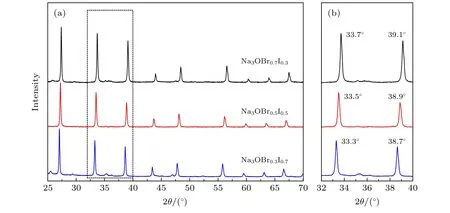
图1 (a)合成的反钙钛矿Na3OBrxI1—x (x = 0.3, 0.5, 0.7)样品的XRD 图谱; (b)图(a)的局部放大图Fig. 1. (a) The X-ray diffraction (XRD) patterns of synthezied anti-perovskites Na3OBrxI1—x (x = 0.3, 0.5, 0.7); (b) local zoom of Fig. (a).
交流阻抗用于测试热压电解质片在不同温度下的离子电导率, 计算公式如下:

σ-离子电导率, 单位: S·cm—1;
L-电解质片厚度, 单位: cm;
S-电解质片面积, 单位: cm2;
R-Nyquist 曲线中阻抗值, 单位: Ω.
图2(c)为Na3OBr0.5I0.5在不同温度下的Nyquist 曲线, 样品阻抗随着温度升高逐渐减小, 各材料离子电导率具体数值如表2 所列. 图2(d)反应了各材料的logσ与1000/T对应关系曲线, 并计算各电解质活化能. 可以看出, 随着I 含量增加, 材料离子电导率呈上升趋势, 活化能也逐渐减小, 这可能归因于I 的引入使材料晶格尺寸增加, 更利于Na+离子传输; 但是, 当I 含量增加至0.7 时, 材料的离子电导率在温度变化过程中更容易发生跳变. 下面将进一步探讨不同温度下材料的结构变化规律.

表2 Na3OBrxI1—x (x = 0.3, 0.5, 0.7)离子电导率Table 2. Ionic conductivity of Na3OBrxI1—x (x =0.3, 0.5, 0.7).
3.3 不同温度相表征
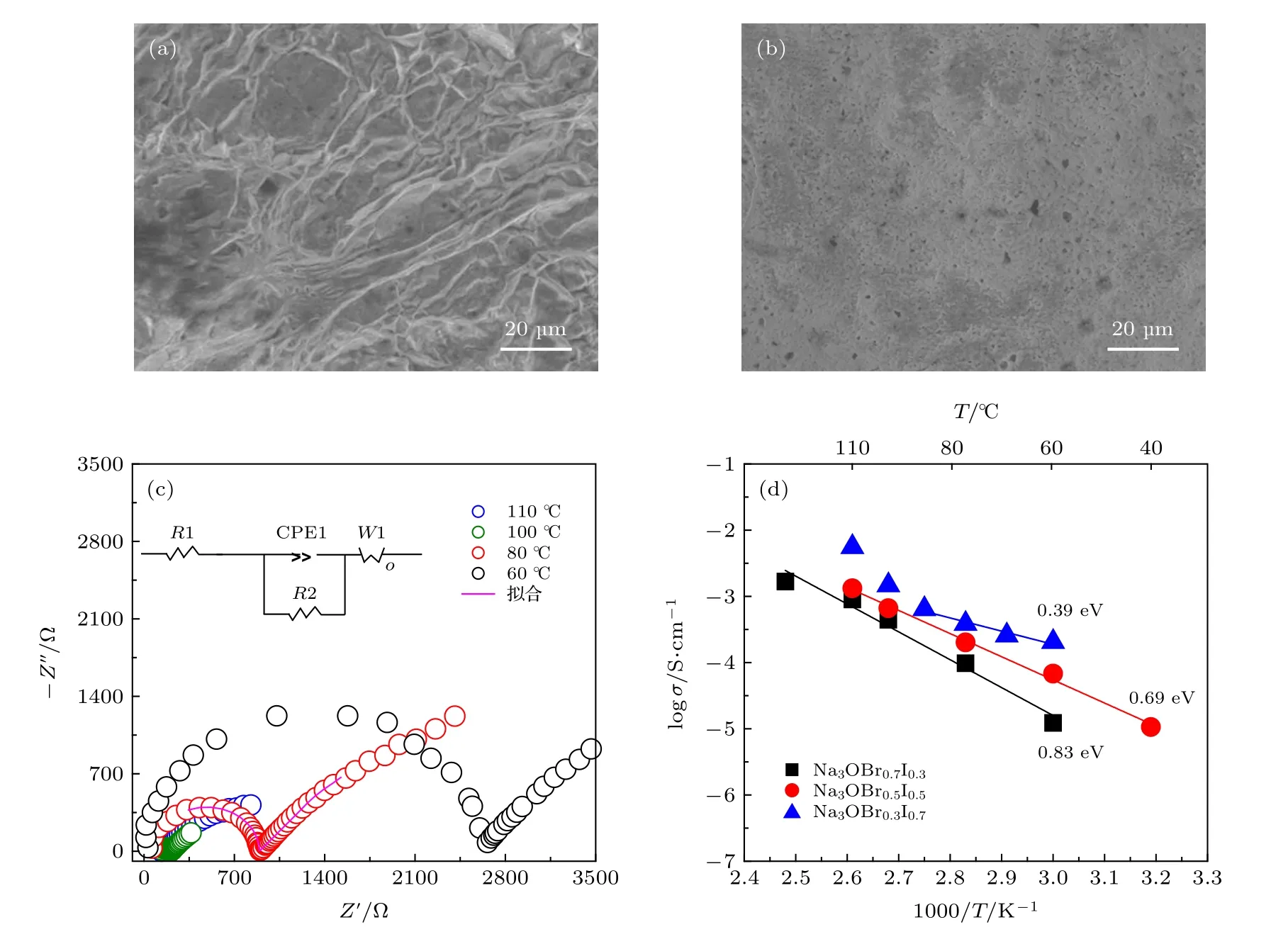
图2 通过(a)冷压和(b)热压方法制备得到的Na3OBr0.5I0.5 电解质片的SEM 图; (c)不同温度下测得的热压Na3OBr0.5I0.5 片的Nyquist 曲线; (d) Na3OBrxI1—x (x = 0.3, 0.5, 0.7)的logσ 与1000/T 对应曲线Fig. 2. SEM images of (a) cold-pressed and (b) hot-pressed Na3OBr0.5I0.5 solid electrolyte pellets; (c) Nyquist plots of hot-pressed Na3OBr0.5I0.5 measured at different temperatures; (d) logσ versus 1000/T plots for Na3OBrxI1—x (x = 0.3, 0.5, 0.7).
固态NMR 和原位高温XRD 用于研究材料变温过程中离子电导率的跳变现象. 由于离子电导率测试过程中, Na3OBr0.3I0.7样品的跳变现象最为明显, 因此选择该样品作为研究对象. 如图3(b)所示, 温度从25 ℃上升至100 ℃的过程中, 材料的XRD 图谱保持一致, 没有观察到与相转变有关的变化. 同时, 尽管Na3OBr0.5I0.5被归结为单斜相(P2/m空间群)[26], 但是Na3OBr0.3I0.7样品的XRD图谱中没有观察到立方相对称性破坏引起的衍射峰劈裂, 因此推测Na3OBr0.3I0.7为立方相反钙钛矿结构. 与XRD 结果相反, 图3(a)NMR 谱中23Na 信号显示, 在Na3OBr0.3I0.7中至少有两个不同的Na 位, 与Na3OBr 的一致[32], 表明Na3OBr和Na3OBr0.3I0.7的低对称结构. 当温度升高时, 10 —12 ppm 处信号的相对强度减弱, 并向低δ方向偏移, 这暗示了与Na 扩散对应的Na 位变化. 另外,基于XRD 精修, Na3OBr 和Na3OBr0.5I0.5分别归属为只有一个Na 位的立方相反钙钛矿结构和含有三个Na 位的单斜相空间群[26]. 这些结果显示Na3OBrxI1—x材料结构和对称性的复杂性, 需要更多实验和研究去确认Na3OBrxI1—x材料精确的晶体结构, 这将对深入理解离子电导率随温度变化的机理, 以及提升离子电导率, 尤其是室温离子电导率方面具有重要意义.

图3 Na3OBr0.3I0.7 在不同温度下的 (a)固态核磁图谱;(b)XRD 图谱Fig. 3. (a) Solid state 23Na NMR spectra and (b) XRD patterns of Na3OBr0.3I0.7 at different temperature.
3.4 电化学性能
固态电解质的最终目的是应用到固态电池中,目前, 将富钠反钙钛矿钠离子固态电解质应用到固态电池中的报道较少. Na3OBr1—xIx的离子电导率显示其具有在中温固态钠电池中应用的潜能(40—80 ℃离子电导率接近或高于10—4S·cm—1),因此, 通过组装Na-Na 对称电池和TiS2全电池,在50 ℃条件下进行测试, 评估其对钠金属相容性以及在固态钠电池中的性能.x= 0.3 时, 样品离子电导率偏低;x= 0.7 时, 材料离子电导率随温度变化更易发生跳变. 综合考虑, 选择Na3OBr0.5I0.5作为固态电解质组装固态电池. 由于Na3OBr0.5I0.5亲钠性较差, Na/Na3OBr0.5I0.5/Na 对称电池的阻抗非常大, 如图4(a)所示. 这为电化学性能测试和钠金属负极的使用带来了挑战, 而界面工程是解决这一问题的有效方法. 本工作的主要目的是评估Na3OBr0.5I0.5作为固态电解质的电化学性能, 因此引入少量离子液体修饰电解质/电极界面, 减小电池阻抗. 如图4(b)所示, 添加少量离子液体后, 对称电池阻抗显著降低. 如图4(c)所示, 在Na 沉积/剥离过程中, 对称电池展现出稳定的过电位曲线,且当电流密度从0.05 mA·cm—2增加到0.5 mA·cm—2时, 电池仍然能稳定运行, 不发生短路现象, 表明电解质对钠金属的电化学稳定性较好. 将Na3OBr0.5I0.5作为固态电解质组装在分别以TiS2和Na-Sn合金作为正负极的固态电池中, 同样引入少量离子液体润湿电解质/电极界面, 电池在50 ℃, 0.1 C倍率下运行. 添加离子液体[42]及在50 ℃条件运行是为了减小界面和电解质层阻抗. 如图4(d)所示, 固态钠电池初始放电比容量为190 mAh·g—1,非常接近TiS2的理论比容量, 循环10 圈后, 放电比容量保持在127 mAh·g—1. 上述结果显示, Na3OBr0.5I0.5拥有良好的电化学性能, 证明其具有在固态钠电池中应用的潜力. 电池容量衰减可能源于固态电解质与电极材料间较差的界面接触, 在该电池系统中, 电极材料在电池运行过程中会产生较大的体积变化, 且氧化物电解质硬度较大的特点不利于构建稳定的接触界面. 尽管低熔点能使固态电解质离子电导率提升变得更简单, 但是氧化物特性使其难以构筑较低阻抗的固态电解质/活性材料界面, 关于这方面的研究仍将继续.

图4 (a) Na/Na3OBr0.5I0.5/Na 对称电池的电化学阻抗谱; (b) 添加了离子液体的Na/IL/Na3OBr0.5I0.5/IL/Na 对称电池的电化学阻抗谱; (c) Na/IL/Na3OBr0.5I0.5/IL/Na 对称电池在不同电流密度下的充放电曲线; (d) TiS2/IL/Na3OBr0.5I0.5/IL/Na-Sn 在50 ℃,0.1 C 条件下充放电曲线Fig. 4. (a) Electrochemical impedance plot of Na/Na3OBr0.5I0.5/Na symmetrical cell; (b) electrochemical impedance plot of Na/IL/Na3OBr0.5I0.5/IL/Na symmetrical cell with ionic liquid; (c) charge-discharge curves of Na/IL/Na3OBr0.5I0.5/IL/Na symmetrical cell at different current density; (d) charge-discharge curves of TiS2/IL/Na3OBr0.5I0.5/IL/Na-Sn operated at 50°C, 0.1 C.
4 结 论
总的来说, 本文通过简单合成路径成功制备纯相富钠反钙钛矿型固态电解质Na3OBrxI1—x(x=0.3, 0.5, 0.7), 100 ℃热处理提升电解质片致密度,电解质离子电导率在100 ℃下提升至10—3S·cm—1.固态23Na NMR 解释了材料在变温过程中离子电导率跳变可能与复杂的结构对称性及Na 位变化有关. 更重要的是, 通过将Na3OBr0.5I0.5作为固态电解质组装到对称电池和TiS2全电池中, 成功验证了富钠反钙钛矿钠离子固态电解质在固态钠电池中应用的可行性. 通过界面修饰, 固态对称电池在循环过程中展现出稳定的过电位曲线, 以TiS2和Na-Sn 合金分别作为正负极的固态电池表现出良好的充放电性能, 首圈放电比容量190 mAh·g—1,循环10 圈后, 比容量维持在127 mAh·g—1. 该工作有利于促进对反钙钛矿Na3OBrxI1—x结构和性质的理解, 对Na3OBrxI1—x作为固态电解质的实际应用具有重要意义. 然而, 对材料的精细结构分析、室温离子电导率的进一步提升, 以及固态电池中的界面性能优化, 仍需要开展进一步的研究.
