蓝刺头多糖提取物对小鼠抗氧化性能、免疫机能的影响及其急性毒性作用研究
2020-12-05萨茹丽格根哈斯钱琳娜
萨茹丽 杨 斌 格根哈斯 钱琳娜
(1.内蒙古农业大学动物科学学院 内蒙古自治区高校动物营养与饲料科学重点实验室,内蒙古呼和浩特010018;2.内蒙古自治区农牧业科学院兽医所,内蒙古呼和浩特010031;3.内蒙古自治区锡林郭勒盟正蓝旗旗委办公室,内蒙古上都镇027200)
2020 年起我国开始全面禁止在饲料中添加抗生素。在此背景下,为保证家畜机体健康、生产性能提高、畜产品安全,寻找绿色、环保、安全、高效的抗生素替代品的研究刻不容缓。蓝刺头(Echinops latifolius Tausch,ELT)又名禹州漏芦、蓝星球,为菊科蓝刺头属植物。主要分布于南欧、东欧、北非和亚洲,在我国主要分布在东北和西北地区。中医记载蓝刺头根、花序、果实和种子皆可入药,其味苦、性寒、归胃经具有清热解毒、理气、止痛、排脓止血、消痈下乳等功效。蒙医药典中记载蓝刺头具有固骨质、接骨愈伤、清热止痛等功效、用于治疗骨折、骨热、刺痛症、疮疡、感冒、心热、痢疾、血热及传染性热等症状具有良好的功效[1-2]。近年国外对于蓝刺头的研究报道主要集中在用蓝刺头属植物治疗偏头痛、肺结核病、麻风病、血吸虫病、梅毒、肝病、胃病等方面[3-4]。经分析,蓝刺头中富含有噻吩类、黄酮类、生物碱类等诸多生物活性物质,这些天然活性提取物分别发挥着其各自独有的抗氧化、抗炎等生物活性功能[5-6]。研究报道指出,蓝刺头多糖(ETP)作为蓝刺头所含有的天然植物多糖具有体外抗氧化、抗菌和降血糖作用[7-8]。本文在前期研究的基础上欲对蓝刺头多糖(ETP)对机体免疫机能、抗氧化机能的影响作用进行试验研究的同时,通过急性经口毒性试验、骨髓细胞微核试验和精子畸形试验确定蓝刺头多糖(ELP)对昆明小鼠的毒性作用,为蓝刺头提取物相关生物活性的研究与开发提供依据。
1 材料与方法
1.1 试验材料
蓝刺头花絮采摘自内蒙古呼和浩特市大青山南麓,由内蒙古农业大学兽医学院临床兽医系中兽医教研室杨英教授鉴定。新鲜蓝刺头采摘之后流水冲洗表面灰尘,自然风干,收集花絮后备用。使用时称取75 ℃烘干至恒重的蓝刺头500 g,加10倍水浸泡12 h,煮沸提取2 h,过滤收集滤液,滤渣再同法煎煮1次后过滤收集滤液,将2 次提取所得滤液合并,使用旋转蒸发仪浓缩至1 000 ml。边搅拌边缓慢加入无水乙醇至乙醇终浓度为80%,4 ℃沉淀24 h,3 000 r/min离心30 min后收集沉淀。沉淀挥去乙醇后用热水复溶,置于冷冻干燥机中冻干,得蓝刺头粗多糖[2],经检测其中多糖含量可达到(298.32±2.73) mg/g。
1.2 主要仪器与试剂
环磷酰胺(CP,北京酷来搏科技有限公司)、Giem⁃sa(G1010,北京索莱宝科技有限公司)、精子活体染色液(G2582,北京索莱宝科技有限公司)、全自动酶标仪(Synergy-HT 型,美国BIOTEK 公司)、旋转蒸发仪(上海亚荣生化仪器厂)、电子天平(天津天马衡基仪器有限公司)、显微镜(H600L,尼康)、灌胃针、解剖刀、眼科镊、眼科剪、固定针与固定板、恒温箱(上海亚荣生化仪器厂)、分析天平(上海方瑞仪器有限公司)、离心机(KLO4A,湖南凯达科学仪器有限公司)等,抗氧化指标的试剂盒购买自南京建成生物技术有限公司,血清免疫指标的检测由北京华英生物技术有限公司完成。
1.3 试验动物
清洁级昆明种小鼠,由内蒙古大学生命科学学院实验动物中心提供,实验动物生产许可证号为SCXX(蒙)2015-0001,实验动物使用许可证号为SYXK(蒙)2014-0001。小鼠生长繁殖饲料由北京科澳协力饲料有限公司提供,批号为18123111,饲养过程中各试验组小鼠全天自由采食、自由饮水,试验期间动物房环境温度为22~24 ℃,湿度45%~50%。
1.4 测定指标及方法
1.4.1 蓝刺头多糖提取物对小鼠肝脏抗氧化指标的影响
试验选取50只胎次相近、体重为(20.00±1.20) g左右的清洁级昆明种小鼠,随机分为五组,每组10 只,分别为空白对照组(灌喂蒸馏水)、阳性对照组(灌喂黄芪多糖1 g/ml)、蓝刺头多糖高剂量组(灌喂1 g/ml的蓝刺头多糖)、蓝刺头多糖中剂量组(灌喂0.5 g/ml的蓝刺头多糖)和蓝刺头多糖低剂量组(灌喂0.25 g/ml的蓝刺头多糖),每只每次灌胃剂量为0.2 ml。试验进行21 d后,眼球采血,脱颈处死后分离肝脏,生理盐水冲洗干净后装入冻存管中迅速放入液氮内用于抗氧化指标的测定。超氧化物歧化酶(SOD)活性采用黄嘌呤氧化酶法测定,丙二醛(MDA)含量采用硫代巴比妥酸法测定,总抗氧化能力(T-AOC)采用Fe3+还原法测定,过氧化氢酶(CAT)和谷胱甘肽过氧化物酶(GSHPx)活性采用比色法测定。指标测定所用试剂盒均购自南京建成生物工程研究所,测定仪器为全自动酶标仪(Synergy-HT 型,美国BIOTEK 公司),具体操作步骤按试剂盒说明书进行。
1.4.2 蓝刺头多糖提取物对小鼠免疫相关指标的影响
试验选取50只胎次相近、体重为(20.00±1.20) g左右的清洁级昆明种小鼠,随机分为五组,每组10只,分别为空白对照组(灌喂蒸馏水)、阳性对照组(灌喂黄芪多糖1 g/ml)、蓝刺头多糖高剂量组(灌喂1 g/ml的蓝刺头多糖)、蓝刺头多糖中剂量组(灌喂0.5 g/ml的蓝刺头多糖)和蓝刺头多糖低剂量组(灌喂0.25 g/ml的蓝刺头多糖),每只每次灌胃剂量为0.2 ml。试验进行21 d后,眼球采血,脱颈处死后解剖,分离并称量小鼠脾脏、肝脏和胸腺等器官重量,分离血清后分装并-20 ℃冻存,用于血清IgG、LZM、IL-2、IL-6以及TNF-α含量的测定,测定方法依据北京华英公司相关试剂盒操作说明书进行。
1.4.3 蓝刺头多糖提取物对小鼠急性经口毒性试验
选取20 只、体重(22.82±3.90) g,体况良好的试验昆明种小鼠,雌雄各半,将试验小鼠称重后随机分两组。通过最大耐受剂量以10 g/(kg·bw)体重的剂量将蓝刺头多糖提取物灌胃给予试验小鼠,灌胃容量为0.4 ml/20 g 体重,24 h 内灌胃给药2 次,灌胃间隔为8 h。在测试之前,小鼠禁食不禁水8 h,每个测试组根据体重计算每只小鼠的灌胃剂量。在灌药后观察动物的一般状态、体重变化、中毒和死亡等情况,并对死亡动物和到期处死动物进行病理解剖,观察组织病理变化,观察期为两周。
1.4.4 蓝刺头多糖提取物对小鼠骨髓细胞微核试验
选取70只、体重(23.34±6.40) g,体况良好的小鼠,雌雄各35只,采用完全随机设计分为5组,每组14只小鼠,分成阳性对照组[环磷酰胺40 mg/(kg·bw)]、阴性对照组[蒸馏水20 g/(kg·bw)]和蓝刺头多糖低[2.5 g/(kg·bw)]、中[5 g/(kg·bw)]、高[10 g/(kg·bw)]剂量组。各测试组的剂量按照0.4 ml/20 g 小鼠体重计算灌胃量,在24 h内,两次经口灌胃。第二次灌胃6 h后,脱颈处死小鼠并取两侧股骨,剪取骨骺的每个端部,用镊子挤出骨髓溶液,将其点在载玻片上预先滴好的小牛血清中,混合后推片。将推好的片子放到染色缸中晒干,用甲醇固定3 min,用Giemsa染液染色20 min后冲洗片子上的染色液,晒干,油镜下观察。每只动物计数1 000个嗜多染红细胞(PCE),微核发生率根据含微核的PCE计算千分率。计数200个嗜多染红细胞,并计算出嗜多染红细胞与成熟红细胞的比例(PCE/NCE),正常的PCE/NCE范围在0.6~1.0之间。
1.4.5 蓝刺头多糖提取物对小鼠精子畸形试验
选取50 只、体重(22.34±6.40) g,体况良好的雄性小鼠,采用完全随机设计分为5组,每组10只,分别为阳性对照组[环磷酰胺40 mg/(kg·bw)]、阴性对照组(蒸馏水[20 g/(kg·bw)]和蓝刺头多糖低[2.5 g/(kg·bw)]、中[5 g/(kg·bw)]、高[10 g/(kg·bw)]剂量组。各测试组的剂量根据每只小鼠的体重来计算灌胃量,每日1 次,连续5 d。将不同浓度的试验药品根据0.4 ml/20 g体重给药。于第一次给药后第35 d,脱颈处死小鼠,取下两侧附睾,放入1 ml生理盐水中,剪碎后静置3~5 min,慢慢摇晃后用纱布将组织碎片除去,吸取精子滤液和精子活体染色液各1滴,滴在载玻片上,混匀,加盖盖玻片,放置30~60 s,立即在高倍镜下观察。每只动物计数各类型的畸形精子数共1 000 个,并计算出精子畸形发生率。
1.5 数据统计分析
试验数据均使用EXCEL 初步整理后,采用SAS9.0 软件进行方差分析,perdiff 法进行多重比较,P<0.05视为差异显著,P>0.05视为差异不显著。
2 结果
2.1 蓝刺头多糖提取物对小鼠肝脏抗氧化指标的影响(见表1)
由表1可知,蓝刺头各试验剂量组之间SOD酶活性无显著差异(P>0.05),阳性对照组SOD活性显著高于蓝刺头中剂量组(P<0.05);蓝刺头多糖各个试验剂量组之间T-AOC含量无显著差异(P>0.05),阳性对照组T-AOC含量显著高于空白对照组和蓝刺头多糖处理组(P<0.05);CAT 含量检测结果显示,随着蓝刺头多糖添加剂量的增加,肝脏CAT 含量有增加趋势,且蓝刺头中剂量组CAT 含量显著高于空白对照组(P<0.05);各试验组GSH-Px含量与空白对照组相比无显著差异(P>0.05),均显著低于阳性对照组(P<0.05);各试验处理组之间MDA含量差异不显著(P>0.05)。

表1 蓝刺头多糖对小鼠肝脏抗氧化指标的影响
2.2 蓝刺头多糖提取物对小鼠免疫器官指数的影响(见表2)

表2 蓝刺头多糖对小鼠免疫器官指数的影响
由表2可知,蓝刺头多糖中剂量组小鼠脾脏指数显著高于其他试验组(P<0.05);蓝刺头多糖高剂量组和阳性对照组小鼠肝脏指数显著高于其他试验组(P<0.05),但蓝刺头多糖高剂量组与阳性对照组间肝脏指数差异不显著(P>0.05);蓝刺头高剂量组小鼠胸腺指数显著高于其他试验组,高于阳性对照组,且差异显著(P<0.05)。
2.3 蓝刺头多糖提取物对小鼠血清免疫指标的影响(见表3)
由表3 可知,与空白对照组相比,蓝刺头多糖高中低剂量组血清IgG 含量均显著提高(P<0.05),与阳性对照组相比差异不显著(P>0.05),高中低添加剂量三组之间差异不显著(P>0.05);血清TNF-α含量仅蓝刺头高剂量组显著高于空白对照组、中剂量组与低剂量组(P<0.05),与阳性对照组间差异不显著(P>0.05);空白对照组与阳性对照组的IL-6 含量显著高于蓝刺头试验组(P<0.05),蓝刺头高中低剂量组之间的差异不显著(P>0.05);各试验组间血清IL-2含量无显著差异(P>0.05);蓝刺头低剂量组LZM含量显著低于其他各组(P<0.05),蓝刺头高剂量组与阳性对照组LZM含量显著高于其他各组(P<0.05),蓝刺头中剂量组与空白对照组间差异不显著(P>0.05);由此得知与空白对照组相比,高剂量的蓝刺头多糖提取物可显著提高血清IgG、TNF-α、LZM 含量,对血清IL-2 无显著影响,会使血清IL-6含量显著降低。

表3 蓝刺头多糖提取物对小鼠血清免疫指标的影响
2.4 蓝刺头多糖急性经口毒性作用(见表4)

表4 蓝刺头多糖对小鼠的急性毒性
由表4 可知,根据10 000 mg/(kg·bw)剂量的蓝刺头多糖对雌、雄昆明种小鼠灌胃后未见明显的中毒症状,观察14 d 后无死亡;蓝刺头多糖对雌、雄昆明种小鼠急性经口毒性试验的最大耐受剂量(MTD)大于10 000 mg/(kg·bw),属实际无毒级。
2.5 骨髓细胞微核试验(见表5)
由表5可知,雄性小鼠骨髓嗜多染红细胞微核发生率在受试动物各剂量组间无差异(P>0.05),且与阴性对照组相比差异不显著(P>0.05),各试验剂量组雄性小鼠骨髓嗜多染红细胞的微核发生率显著低于环磷酰胺阳性对照组(P<0.05)。各试验剂量组试验结果为阴性。雌性小鼠骨髓嗜多染红细胞的微核发生率在受试物各剂量组之间无显著差异(P>0.05),且与阴性对照组相比差异不显著(P>0.05),阳性对照组雌性小鼠骨髓嗜多染红细胞微核发生率显著高于其他试验组(P<0.05),试验结果为阴性。由此可知蓝刺头多糖在本试验条件下对受试小鼠骨髓细胞无抑制作用。

表5 蓝刺头多糖对小鼠骨髓微核发生率的影响
2.6 精子畸形试验(见表6)
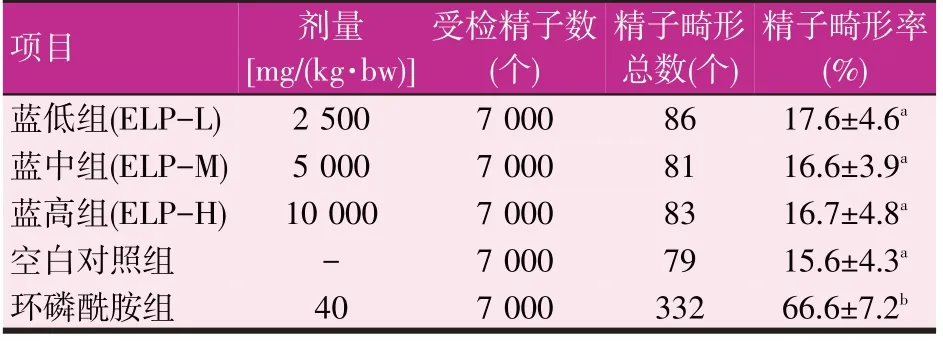
表6 蓝刺头多糖对小鼠精子畸形发生率的影响
由表6可知,蓝刺头多糖各剂量组与阴性对照组相比小鼠精子畸形发生率无显著差异(P>0.05),蓝刺头各剂量组小鼠精子畸形发生率显著低于环磷酰胺组(P<0.05),表明蓝刺头多糖在本试验条件下对小鼠精子无致畸作用。
3 讨论
植物提取物不同于化学合成药物,它是一类从天然植物中获取的,具有一种或多种生物活性功能的物质。随着研究的不断深入,人们发现植物提取物所富有的生物活性物质如多糖类、黄酮类、酚类、萜类、挥发油类等物质不仅具有抗菌、抗氧化、提高机体免疫力等功能,其抗病毒、抗癌、抗病、抗炎等生物活性也不断地被发现、被证实。但诸多天然植物提取物具有诸多受人瞩目的生物活性的同时也具有一定的毒性,尤其是其提取过程中的如溶剂萃取等诸多工艺操作使其安全性问题不容忽视。蓝刺头多糖作为天然植物提取物,前期研究证明其具有较好的体外抗氧化活性与抗菌活性[2]。且蓝刺头多糖(ELP)作为蓝刺头所含有的天然植物多糖具有良好的降血糖作用[7-8],具有广泛的应用前景。因此对其急性毒性作用的研究不可缺少。本研究依据《保健食品检验与评价技术规范》2003版中规定的保健食品安全性毒理学评价的四个阶段内容,以及保健食品选择毒性试验的原则,对蓝刺头多糖进行第一阶段和第二阶段毒理学的安全性评价。第一阶段的小鼠最大耐受剂量(maximum tolerated dose,MTD)为10 000 mg/(kg·bw),大于500 mg/(kg·bw),小于15 000 mg/(kg·bw)根据急性毒性剂量分级标准判断,蓝刺头多糖属于实际无毒级。本研究选择小鼠骨髓细胞微核试验与小鼠精子畸形发生率试验作为蓝刺头多糖遗传毒性检测,检测结果证明蓝刺头多糖无遗传毒性,这也为后续的相关动物试验研究奠定了试验安全基础。
众所周知,机体的免疫力是可以识别和消灭各种外来侵入的异物,形成机体特定的防御机制。健全的免疫系统通过处理衰老、损伤、死亡、自身变性细胞以及识别处理体内突变细胞和病毒感染细胞等来维持机体健康。在机体免疫机能的研究中,研究者们通常使用免疫器官指数大小来反映机体的健康程度及免疫机能的情况。本试验结果显示灌胃中剂量蓝刺头多糖提取物的小鼠脾脏指数显著高于其他试验组,灌胃高剂量蓝刺头多糖提取物试验组的肝脏指数和胸腺指数显著高于其他几组,证明蓝刺头多糖可提高机体免疫器官指数,促进免疫器官的发育。通过进一步对机体血清免疫指标的测定,可以发现,灌胃高剂量蓝刺头多糖提取物后试验小鼠机体的血清IgG、TNFα和LZM 含量显著提高,对血清IL-2 无显著影响,血清IL-6含量显著降低。研究表明血清IL-2、TNF-α含量的升高证明机体免疫功能的加强[9-10]。韦晓晨等[11]研究指出人参叶多糖可显著提高粤黄鸡的免疫器官指数和血清中IL-2、IL-12、TNF-α等因子的含量,从而起到提升粤黄鸡的免疫性能的作用。孙守坤等[12]研究报道刺五加酸性多糖能增加环磷酰胺致免疫功能低下小鼠的免疫器官脏器指数、提高TNF-α和IFN-γ水平从而能够明显增强免疫抑制小鼠的免疫功能。马吉锋等[13]研究报道饲喂枸杞多糖免疫增效剂7 d后,肉牛免疫球蛋白IgG含量明显提高、IL-2、IL-13、IL-17、IL-19等细胞因子的分泌得到促进,从而提高肉牛机体免疫能力。这也证实,蓝刺头多糖也可以通过提高血清IgG、TNF-α和LZM含量起到一定的免疫增强效果。
随着生命科学研究的逐步深入,人们逐渐认识到,除了免疫系统,生物在其长期的进化演变过程中,形成了一套完整抗氧化防御系统。在生命活动的过程中,机体内代谢反应所产生大量的氧化自由基(ROS),如果不能及时清除这些代谢产物,过量自由基蓄积会导致机体DNA氧化损伤、蛋白质变性,不仅损伤细胞组织功能,还会引起组织器官一系列的病变,目前研究认为这也是诸多疾病的发病原因之一。机体内抗氧化系统的强弱直接受多种抗氧化酶活性的直接影响,体内诸多的抗氧化酶中超氧化物歧化酶(SOD)是体内唯一的一种以氧自由基为底物的抗氧化酶,其作用机理是歧化氧自由基生成H2O2,这样不仅能有效地清除氧自由基,又能够阻断毒性更强的羟基自由基的生成,减少MDA等过氧化物的产生,从而起到保护细胞避免氧化损伤的作用。GSH-Px特异性催化GSH 对H2O2的还原反应,从而保护细胞膜结构和功能的完整性;CAT 在一定条件下可直接分解H2O2,保护机体细胞稳定的内环境及细胞的正常生物活性;T-AOC则可以反映机体的健康程度以及机体抗氧化作用的强弱[14-16]。研究证实,植物多糖类提取物可通过提高机体抗氧化酶活性使机体抗氧化机能提高。如付昊等[17]研究报道指出实验小鼠连续服用不同剂量(150、300、550 mg/kg)的熟地黄多糖对小鼠肝脏和血清中SOD、GSH-Px的活性具有一定增强作用,对肝脏和血清中的MDA具有明显降低效果。许女等[18]研究发现鸡腿菇实体多糖可显著升高实验小鼠心、肝、肾、血中GSH-Px、SOD、CAT、T-AOC的活性,显著降低MDA 含量,具有较好的抗氧化作用。本试验结果显示,灌胃蓝刺头多糖后,试验小鼠肝脏CAT 酶活性有一定的增高趋势,SOD、GSH-Px、T-AOC 活性和MDA 含量等无显著变化,但随着蓝刺头多糖提取物添加剂量的增加MDA 含量有下降趋势。研究报道显示蓝刺头多糖提取物对氧化损伤所致的I 型糖尿病小鼠胰岛细胞具有一定的修复和保护作用,而对正常小鼠无此作用[19],结合蓝刺头多糖体外抗氧化结果,认为蓝刺头多糖提取物对正常的机体内处于平衡状态的氧化还原系统无明显调节作用,因此其对于疾病或应激状态下机体内的氧化还原系统的作用有必要进行更深入的研究。
4 结论
蓝刺头多糖对小鼠急性经口毒性试验的最大耐受剂量超过10 000 mg/(kg·bw),属实际无毒级、对受试小鼠无致畸作用,同时还具有提高机体免疫功能的作用与抗氧化功能的潜力,可作为饲料添加剂、食品保健剂继续深入研究与开发。
