HPLC-DAD 法测定饲料中5 种硝基咪唑类药物
2020-12-05罗成江张晓丽陈晓琳林仙军
罗成江 张晓丽 陈晓琳 林仙军 王 彬 阮 鑫
(浙江省动物疫病预防控制中心,浙江杭州311101)
硝基咪唑(nitroimidazoles)类药物是带有硝基的咪唑化合物,其性状为白色或淡黄色结晶,弱碱性,能和酸结合成盐,遇光易分解,易溶于甲醇,微溶于水,主要用于预防和治疗家禽的滴虫病、猪的出血性下痢及厌氧菌感染,并具有促生长作用,但是该类药物对哺乳动物具有致癌、致畸、致突变作用和遗传毒性。常见硝基咪唑类药物包括甲硝唑(metronidazole,MNZ)、地美硝唑(dimetridazole,DMZ)、替硝唑(tini⁃dazole,TNZ)、奥硝唑(ornidazole,ONZ)和异丙硝唑(ipronidazole,IPZ)等。这些药物在动物体内通过C2侧链的氧化而被快速代谢,代谢物与原药具有相似的潜在毒性[1]。因此,欧盟、北美和我国等都禁止了硝基咪唑在食品动物中的使用[2]。
有关硝基咪唑类药物检测方法,目前国内外已有很多文献报道,检测手段主要包括液相色谱法、液相色谱-质谱或串联质谱法、气相色谱法、气相色谱-质谱法、免疫检测法和薄层色谱法等[3-8]。目前有关饲料中常见5 种硝基咪唑类药物同步测定的HPLC-DAD方法还未见报道。本方法在农业部2483 号公告-7-2016 的基础上进行改进[9],建立了饲料中5 种硝基咪唑类药物的HPLC-DAD 测定方法。
1 材料与方法
1.1 仪器与设备
Agilent 1260 高效液相色谱仪(安捷伦公司);配二极管阵列检测器(安捷伦公司);AG-285 电子天平(Mettler 公司);DELTA320 pH 计(Mettler 公司);KQ-500E型超声波清洗器(昆山市超声仪器有限公司);高速冷冻离心机(3-30K,Sigma公司);氮吹浓缩仪(北京康林科技有限公司);MS2 minishaker涡旋混匀器(IKA公司);混合型阳离子固相萃取柱(MCX,60 mg/3 cc,Waters公司);固相萃取装置(Supelco公司)。
1.2 药品与试剂
1.2.1 对照品
地美硝唑对照品来自中国兽医药品监察所,含量100%,批号H0391308;甲硝唑、替硝唑、奥硝唑对照品均来自中国食品药品研究院,含量大于99.0%;异丙硝唑对照品来自中国兽医药品监察所,含量98.0%,批号H0391308。
1.2.2 试剂
乙酸乙酯、正己烷、磷酸,分析纯,购于杭州高晶精细化工有限公司;氨水、分析纯,购于江苏强盛功能化学股份有限公司;乙腈、色谱纯,购于Merck KGaA公司;甲醇、色谱纯,购于Merck KGaA 公司;甲酸、色谱纯,购于Merck KGaA 公司;水为超纯水。
磷酸溶液:取6.4 g 磷酸于1 L 容量瓶中,用水定容至刻度并混匀;淋洗液为水:氨水:甲醇=50:1:1;洗脱液为水:氨水:甲醇=20:5:80;初始流动相溶液为水:甲醇=70:30。
标准溶液的配制:分别准确称取甲硝唑、替硝唑、地美硝唑、奥硝唑和异丙硝唑10.0 mg,置于100 ml 容量瓶,用甲醇溶解,并定容至刻度,混匀,即为100 μg/ml的混合标准储备液。使用时按照需要用初始流动相将上述标准储备液稀释成不同浓度的标准工作液。
1.3 样品前处理
1.3.1 提取
称取饲料样品2 g(精确至0.01 g)于50 ml 离心管中,加15 ml 乙酸乙酯,涡旋1 min,以300 r/min 振摇提取30 min,8 000 r/min 离心10 min,上清液倒入另一50 ml离心管中,残渣再用15 ml乙酸乙酯重复提取一次,合并两次上清液,为样品提取液。
1.3.2 净化
将样品提取液于35 ℃水浴中用氮气吹干,加入300 μl乙酸乙酯,涡动10 s,再加入4 ml正己烷,涡动30 s,全部转移至10 ml离心管中,再向50 ml离心管中加入2 ml磷酸溶液,涡动1 min,全部转移至同一10 ml离心管中,盖紧,振摇萃取后,在4 ℃下8 000 r/min离心10 min,将下层水相转移至5 ml 离心管中,上层有机相用2 ml磷酸溶液重复萃取1次,合并水相作为固相萃取上样液。
MCX 柱依次用3 ml 乙腈和3 ml 磷酸溶液活化。取固相萃取上样液过柱,控制流速在1 ml/min内。然后依次用3 ml 磷酸溶液,2 ml 淋洗液淋洗,抽真空至近干,用3 ml 洗脱液洗脱。往洗脱液中加入20 μl 甲酸,混匀后于35 ℃水浴中用氮气吹干,然后用1 ml初始流动相溶解,过0.45 μm 滤膜后,供高效液相色谱仪测定。
1.4 色谱条件与系统适用性试验
色谱柱为Agilent Eclipse Plus C18(4.6 mm×250 mm,5.0 μm),以甲醇为流动相A,以超纯水为流动相B,按表1程序进行梯度洗脱;采用二极管阵列检测器,采集波长范围为200~400 nm,分辨率为1.2 nm,进样量为20 μl,柱温30 ℃;记录光谱图和320 nm波长处的色谱图。

表1 流动相梯度洗脱程序
2 结果与讨论
2.1 线性关系考察
移取适量100 μg/ml 甲硝唑、替硝唑、地美硝唑、奥硝唑及异丙硝唑的标准储备液,用初始流动相稀释定容,配制成浓度为0.1、0.2、0.5、5、10、25 μg/ml系列混合标准溶液,从低浓度到高浓度依次进样,按上述色谱条件分析,以峰面积为纵坐标、标准溶液浓度为横坐标,进行线性回归,求得回归方程,结果见表2。

表2 5种药物的线性结果
2.2 检测限
取1.2.2 项下的混合标准储备液,进行梯度稀释后添加到阴性饲料中,按1.3 项下的方法进行检测,光谱未失真的最低添加含量作为检测限,此时色谱图和光谱图分别见图1、图2。本方法的检测限为0.1 mg/kg。
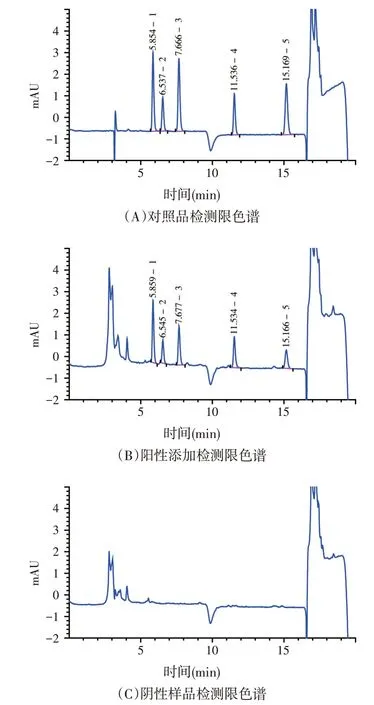
图1 5种硝基咪唑类的检测限色谱(浓度为0.2 μg/ml)
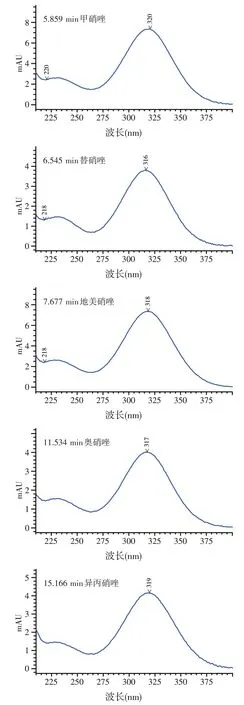
图2 5种硝基咪唑类药物的检测限光谱
2.3 峰纯度及光谱匹配检查
对供试品溶液及对照品溶液色谱图中硝基咪唑类药物(甲硝唑)色谱峰进行峰纯度检查,结果见图3。结果表明,供试品溶液及对照品溶液色谱图中硝基咪唑类药物(甲硝唑)峰的纯度因子大于阈值,为单一物质峰。对供试品溶液及对照品溶液色谱图中硝基咪唑类药物(甲硝唑)色谱峰光谱图进行匹配,匹配因子为998.771,可认为是同一物质。
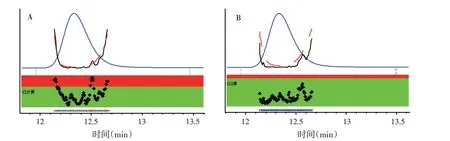
图3 峰纯度检查
2.4 回收率和精密度
通过在空白饲料样品中添加混合标准溶液的方式,对5种药物进行0.1、0.5、10 mg/kg三个浓度水平的添加回收试验,每个浓度设5个平行,按1.3中的试验方法处理后检测,计算出方法的平均回收率为70.8%~92.1%,相对标准偏差(RSD)为5.6%~10.8%(见表3)
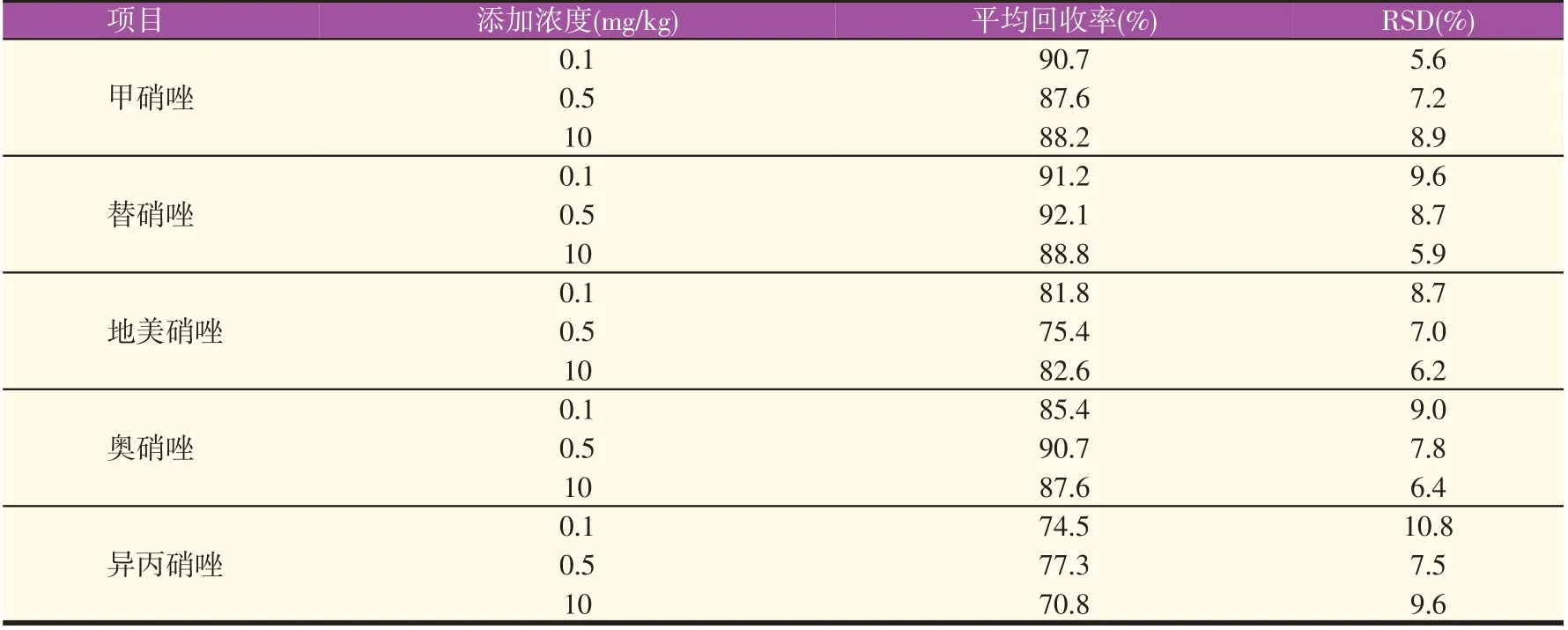
表3 回收率试验结果(n=5)
2.5 固相萃取净化洗脱条件的选择
根据文献[7-9]报道,用MCX 柱进行样品基质中硝基咪唑类药物的净化时,淋洗液1 采用磷酸溶液,淋洗液2 采用甲醇或[水+氨水+甲醇(50+1+1)]溶液,洗脱液为[水+氨水+甲醇(10+1+40)]溶液或[水+氨水+甲醇(4+1+16)]溶液。本试验对淋洗液2及洗脱液分别进行组合试验。当采用甲醇作为淋洗液2时,地美硝唑与异丙硝唑回收率非常低,提高洗脱液中氨水浓度和加大洗脱液体积,地美硝唑与异丙硝唑回收率会有所提高,但同时氮吹所需时间加长;当采用[水+氨水+甲醇(50+1+1)]溶液作为淋洗液2,[水+氨水+甲醇(10+1+40)]溶液作为洗脱液时,5 种硝基咪唑类药物的回收率较好,氮吹所需时间较短,因此,本试验采用磷酸溶液作为淋洗液1,[水+氨水+甲醇(50+1+1)]溶液作为淋洗液2,[水+氨水+甲醇(10+1+40)]溶液作为洗脱液。
3 结论
本文建立的饲料中5 种硝基咪唑类药物的HPLC-DAD 测定方法,准确度和精密度较好,同时通过保留时间及光谱相似度检查与对照品进行比对佐证,实现饲料中5种硝基咪唑类药物的高效、快速、准确识别,该方法具有操作简便、快速、准确等特点,适用于饲料中硝基咪唑类药物的检测。
