NVG患者房水和血清中VEGF-A和PDGF及PEDF的临床意义
2020-12-04李钰洁
李钰洁,侯 旭,张 茜
0引言
新生血管性青光眼(neovascular glaucoma,NVG)是一种常见的继发性青光眼,其虹膜表面和房角新生血管的形成导致小梁网与周边的虹膜组织相粘连,进而导致进行性眼压升高,是一种临床治疗较为棘手的严重致盲性眼病[1]。NVG多继发于视网膜缺血、炎症及手术外伤等疾病,其中糖尿病性视网膜疾病(diabetic retinopathy, DR)及视网膜中央静脉阻塞(central retinal vein occlusion, CRVO)占到其病因的近70%[2]。
目前,NVG具体的发病机制尚未明确,但普遍认为视网膜缺氧、炎症导致多种细胞因子的过量表达是NVG形成的主要原因,其中血管内皮生长因子-A(vascular endothelial growth factor-A, VEGF-A)被认为是最为关键的血管生成因子,抗VEGF制剂也广泛应用于眼部新生血管性疾病的治疗[3-4]。但单独抗VEGF治疗并不能完全抑制NVG新生血管的形成,有研究发现血小板源性生长因子(platelet-derived growth factor,PDGF)也参与了眼内病理性新生血管的形成[5]。而色素上皮衍生因子(pigment epithelium derived factor,PEDF)是一种重要的血管生成抑制剂,可抑制多种新生血管的形成[6-7]。本研究通过定量测定NVG及年龄相关性白内障患者房水和血清中VEGF-A、PDGF及PEDF的含量并分析其意义,探索治疗NVG的新方法。
1对象和方法
1.1对象本研究为前瞻性临床试验,通过空军军医大学西京医院伦理委员会的批准,并遵守《赫尔辛基宣言》关于人体受试者研究的规定。所有受试者均书面签写知情同意书。收集2015-12/2016-12在西京医院眼科住院的NVG患者23例23眼。所有患者均为汉族,其中男13例,女10例,年龄32~76(平均56.1±15.7)岁,病程2~18(平均6.5±2.8)mo,术前眼压35~50(平均40.5±5.7)mmHg。其中原发病为DR 13例,CRVO 9例,Eales 1例。纳入标准:(1)裂隙灯及房角镜检查虹膜表面、房角有新生血管,非接触眼压计测量眼压≥21mmHg;(2)患者因角膜水肿或玻璃体混浊无法行视网膜激光光凝治疗;(3)常规抗青光眼药物治疗无效、患者及家属同意接受抗VEGF联合抗青光眼手术治疗。排除标准:(1)3mo内曾行抗VEGF药物治疗的患者;(2)曾行眼科手术治疗的患者(包括白内障手术);(3)既往或目前患有眼部炎症、年龄相关性黄斑变性等与VEGF相关疾病的患者;(4)全身合并其他疾病的患者:包括高血压、脑栓塞、充血性心衰、肾功能异常、全身肿瘤;(5)孕期及哺乳期患者。年龄相关性白内障患者组的纳入标准:选择同时期在空军军医大学西京医院眼科住院的年龄相关性白内障汉族患者23例23眼作为对照组,其中男12例,女11例,年龄57~73(平均62.4±3.5)岁,病程3~36(平均12.5±9.8)mo,术前眼压12~18(平均13.8±2.4)mmHg。排除眼部其他疾病、全身性疾病、孕期及哺乳期患者。NVG组和年龄相关性白内障患者组的性别、年龄基本一致(χ2=0.09,P>0.05;t=-13.57,P>0.05),具有可比性,而年龄相关性白内障患者组的病程高于NVG组,差异有统计学意义(t=10.42,P<0.01)。
1.2方法NVG患者行玻璃体内注射雷珠单抗注射液0.5mg,年龄相关性白内障患者行白内障超声乳化联合人工晶状体植入术。房水标本于手术操作前25G针头行前房穿刺抽取房水100L、放置于无菌离心管并于-80℃冷冻保存。血清标本于患者手术前抽取空腹静脉血5mL,1000r/min转离心15min提取血清,并于-80℃冷冻保存。酶联免疫吸附实验(enzyme linked immunosorbent assay,ELISA)分析:人VEGF-A、PDGF、PEDF的ELISA试剂盒均由上海朗顿科技生物有限公司提供,ELISA检测均严格按照说明书操作。

2结果
2.1两组患者房水和血清中VEGF-A和PDGF及PEDF的含量分析NVG患者房水中VEGF-A、PDGF的含量显著高于年龄相关性白内障患者组,PEDF的含量显著低于年龄相关性白内障患者组,差异具有统计学意义(均P<0.01)。NVG、年龄相关性白内障患者血清中VEGF-A、PDGF及PEDF的含量均无明显变化,差异无统计学意义(均P>0.05),见表1。
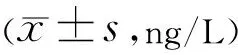
表1 两组患者房水及血清中VEGF-A、PDGF及PEDF含量的比较
2.2 NVG患者房水和血清中VEGF-A、PDGF及PEDF含量之间的相关性分析NVG患者房水中VEGF-A与PDGF含量呈正相关(r=0.502,P=0.015),VEGF-A与PEDF含量呈负相关(r=-0.480,P=0.020),见图1、2。而NVG患者房水中PDGF与PEDF含量无明显相关性(P>0.05);NVG患者房水中VEGF-A、PDGF及PEDF的含量与血清中的含量均无明显相关性(P>0.05)。

图1 NVG患者房水中PDGF与VEGF-A浓度的相关性分析。
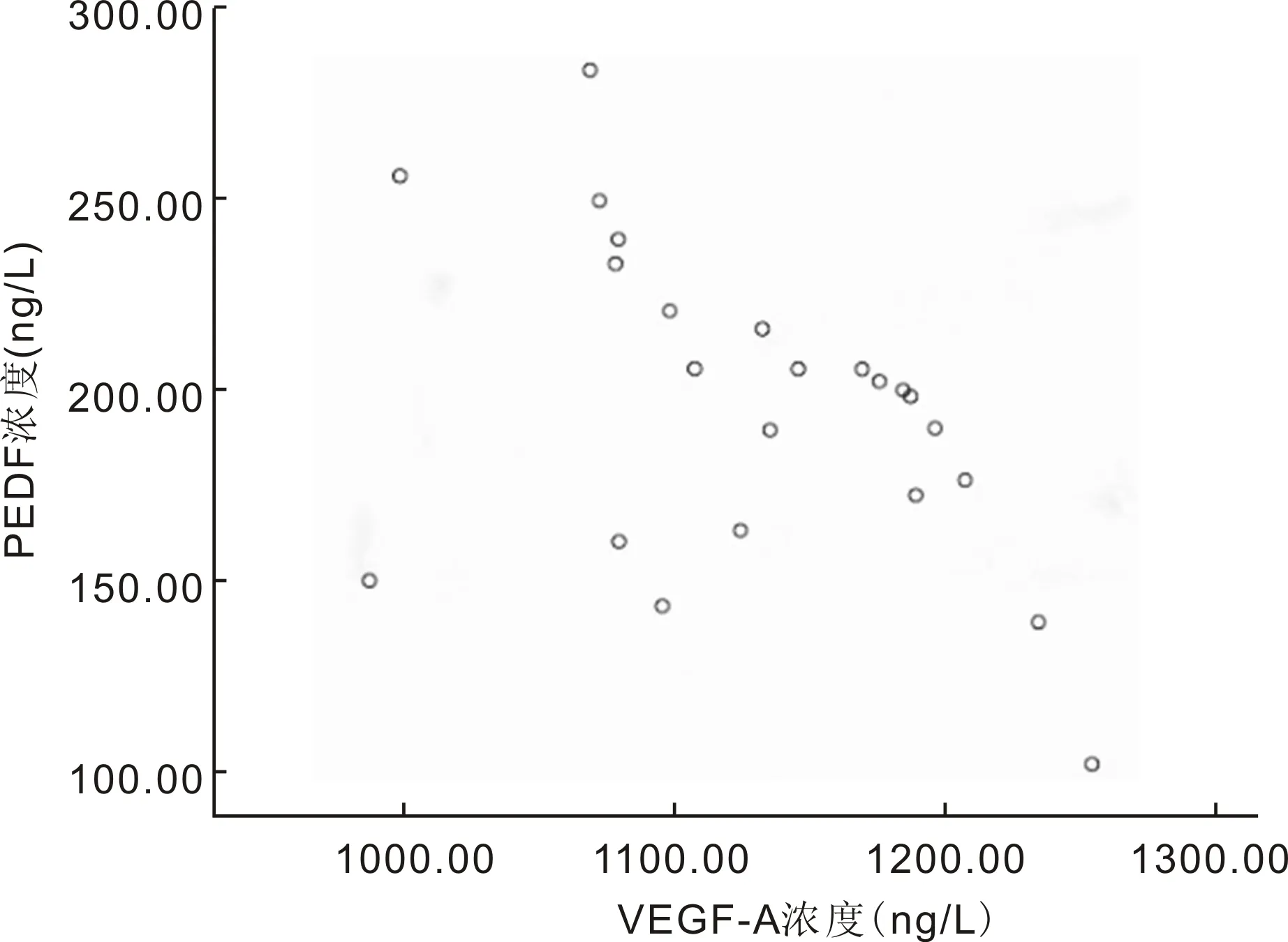
图2 NVG患者房水中PEDF与VEGF-A浓度的相关性分析。
3讨论
VEGF是一种多功能的细胞因子,在血管生成及淋巴管的生成中有着直接和间接的调控作用,VEGF家族包括VEGF-A、VEGF-B、胎盘生长因子(placental growth factor, PIGF)、VEGF-C、VEGF-D、VEGF-E、VEGF-F,其中VEGF-A、PIGF主要参与血管的生成,VEGF-A被公认为是最关键的血管生成因子,且VEGF-A具有多种亚型,其中VEGF-A165是最主要的亚型。研究已证实VEGF通过与VEGFR结合激活多种信号级联进而聚集血管前体细胞和单核细胞,促进血管内皮细胞的增殖、迁移和存活,同时还可以增加血管通透性、扩张血管[8-9]。本研究中NVG患者房水中VEGF-A的含量显著高于对照组,与Chen等[10]及Zhou等[11]的研究相一致,再次证实了VEGF-A在NVG发病机制中起着至关重要的作用。有研究发现NVG患者玻璃体内注射抗VEGF制剂,注射后1d即可出现虹膜荧光素血管造影渗漏减少、并可持续1mo余[12]。也有研究证实抗VEGF制剂通过显著降低NVG患者房水中VEGF的含量进而减少虹膜和房角的新生血管生成[11]。目前,已知的抗VEGF制剂包括哌加他尼钠—特异性结合VEGF-A165,贝伐单抗、雷珠单抗—结合所有的VEGF-A,阿柏西普、康柏西普—结合VEGF-A、VEGF-B和PIGF。抗VEGF制剂已应用于NVG患者的临床治疗中,然而,单独抗VEGF治疗并不能完全消除虹膜新生血管,推测其他细胞因子也可能参与了眼内病理性新生血管的生成。
PDGF家族包括PDGF-A、B、C、D四种亚基,分别组合成PDGF-A、PDGF-B、PDGF-AB、PDGF-C及PDGF-D五种类型,其中PDGF-C及PDGF-D是近年来发现的新成员。PDGF通过与PDFGFα受体或β受体结合进而促进多种细胞的增殖、迁移和分化,是一种促进细胞增殖、血管修复新生的生长因子,在血管的生成中起着十分重要的作用[13-14]。大量研究已经证实,PDGF与VEGF具有显著的同源性,亦在眼内病理性新生血管的形成中发挥着举足轻重的作用[15]。Simpso等[16]在视网膜缺氧的动物模型中发现,PDGF-A、PDGF-B及VEGF的表达水平显著升高。Jo等[17]也研究发现联合抑制PDGF-B及VEGF-A的信号通路比单纯抑制VEGF-A更能显著促进眼内病理性新生血管的回归。我们前期从分子机制学方面研究提示,PDGF-C也参与了眼内病理性新生血管的生成,并通过动物模型进一步证实,阻断PDGF-C的表达可以显著减少眼内病理性新生血管的生成[5]。同时也发现NVG患者房水中PDGF-C的含量显著高于白内障对照组[18]。本研究中NVG患者房水中PDGF的含量显著高于对照组,且PDGF的含量与VEGF呈正相关,再次证实了PDGF与NVG新生血管的形成密切相关,若能抑制PDGF/PDGFR的作用,可能为眼内新生血管性疾病的治疗提供一种新的途径,未来若能联合抑制VEGF治疗,可能效果更佳。
在健康人正常眼内,促血管生成因子与抑制血管生成因子处于平衡状态,当组织出现缺氧、炎症、外伤等情况时,这种平衡将被破坏,进而出现眼部病理性新生血管。PEDF是目前发现的最有效的血管生成抑制剂,其不仅能抑制细胞外基质VEGF等促血管因子的表达、还能激活细胞内的凋亡通路进而促进内皮细胞的凋亡,从而抑制新生血管的生成[6-7]。更重要的是,PEDF抑制新生血管具有选择性,只抑制新生血管的形成,而对已成熟的血管无抑制作用。这一优势大大降低了临床应用的毒副作用,具有很大的应用前景[19]。本研究中NVG患者房水中PEDF的含量显著低于年龄相关性白内障组,且PEDF与VEGF含量呈负相关,这一结果与Sun等[20]的研究相一致。我们还发现NVG患者血清中VEGF-A、PDGF及PEDF的含量与对照组均无明显变化,且NVG患者房水中VEGF-A、PDGF及PEDF的含量与血清中的含量均无明显相关性。有报道,VEGF-A与糖尿病微血管病变密切相关,糖尿病肾病及糖尿病视网膜病变患者血清中VEGF-A的含量显著高于对照组,这一结果与本研究数据不一致,可能由于NVG患者的原发疾病除了DR外还包括了CRVO等疾病,且本研究样本量有限,还有待于后续进一步研究探讨。
众所周知,年龄相关性白内障为老年性生理性疾病,为眼科需要手术的疾病中最接近健康人的一种疾病,且目前尚未发现其与VEGF、PDGF及PEDF的相关性报道,故本研究中我们选取年龄相关性白内障患者作为对照组。本文通过定量分析NVG患者房水中促血管生成因子与抑制血管生成因子的浓度水平,并与国内外相关数据报道相对比,进而探索治疗NVG的新方法;尤其是PDGF的水平浓度,我们课题组前期从动物试验分子机制方面证实PDGF参与了眼内病理性新生血管的生成,本实验客观证实了NVG患者房水中PDGF的水平亦升高,为后期NVG抗新生血管的联合靶向制剂研究提供了新思路。
综上所述我们推测,房水中VEGF-A、PDGF与PEDF的比例失调在NVG新生血管的形成中发挥着重要作用,联合使用VEGF-A、PDGF抑制剂及PEDF可能为NVG治疗提供新的方法,其使用效果还有待于进一步探索。
