剥脱性青光眼与原发性开角型青光眼行青白联合手术疗效观察
2020-12-04马丽华唐广贤张恒丽闫晓伟耿玉磊
马丽华,李 凡,唐广贤,张恒丽,闫晓伟,耿玉磊
0引言
剥脱性青光眼(pseudoexfoliation glaucoma,PXG)是一种由剥脱综合征(pseudoexfoliation syndrome, PEX)引起的一种常见类型的继发性青光眼,由PEX所引起的继发性开角型青光眼占全球开角型青光眼的20%~25%[1-2],房角镜检查可见小梁网呈不均匀的灰白色碎屑分布,伴中等量色素沉着带。PXG的发病机制包括小梁细胞功能紊乱及邻管组织和Schlemm管结构破坏,小梁网被剥脱物质或(和)脱落的色素堵塞等[3-4]。已证实,世界范围内有PEX患者近6000~7000万人,其中500~600万人为PXG患者,与原发性开角型青光眼(primary open angle glaucoma,POAG)相比,PXG患者平均眼压、峰值眼压均偏高,眼压波动范围大、视野损害程度重、进展更为迅速[3],对抗青光眼药物反应较差,药物常不能控制其进展,多需手术治疗[5];PXG还可以引起眼前节缺氧、慢性血-房水屏障破坏、眼部血流异常和白内障等改变,由于晶状体的混浊程度较重,且剥脱物的堆积导致晶状体悬韧带损害,后期白内障手术的难度及并发症发生率[6]均增大,需尽早行白内障手术,可以考虑青光眼白内障联合手术治疗,既可以提高视力、控制眼压,又可以避免分次手术给患者带来的手术创伤及经济负担[7],超声乳化白内障摘除联合小梁切除术是公认的安全、有效、经济、便捷、可重复的手术方式[8-9]。尽管目前的术前评估、手术技术、术后护理等都取得了极大进步,但青光眼白内障联合手术后结膜组织成纤维细胞增殖、细胞外基质沉积增多、术后内源性炎症反应等导致的过度瘢痕化和组织纤维化、手术引起的血-房水屏障改变均是影响术后滤过泡形成和眼压控制的主要障碍。本研究旨在评价青光眼白内障联合手术治疗PXG及POAG患者的临床手术效果,观察两者术后眼压控制效果及手术成功率,现将结果报告如下。
1对象和方法
1.1对象采用回顾性病例对照研究方法,连续性选择于2015-01/2018-01在我院青光眼科住院行青光眼白内障联合手术治疗的PXG患者38例40眼作为PXG组,另选取与PXG组性别、年龄、视力、眼轴长度及视野平均缺损相匹配的POAG患者36例46眼作为POAG组,所有患者均行小梁切除+白内障超声乳化摘除+人工晶状体植入手术进行降眼压治疗。两组患者年龄、性别、眼轴及术前视野平均缺损(mean defect,MD)值、视力、眼压(IOP)、抗青光眼药物使用数量比较差异均无统计学意义(P>0.05),见表1。本研究遵循《赫尔辛基宣言》,并经石家庄市第一医院伦理委员会审核批准,所有患者均已签署并提交知情同意书。
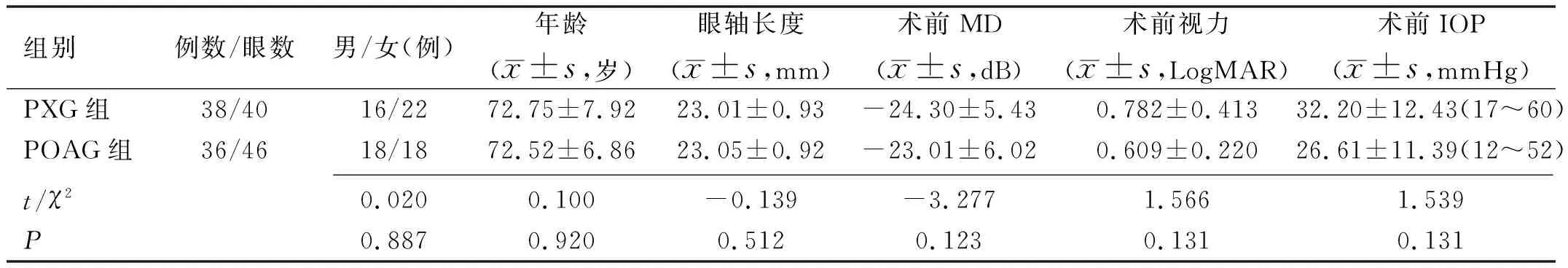
表1 两组患者一般资料比较
1.1.1纳入标准(1)PXG组符合PXG诊断标准[10]:瞳孔缘、虹膜表面、晶状体前囊膜及房角可见灰白色剥脱物沉着,瞳孔缘色素部分或全部缺失,散瞳后晶状体前囊膜表面剥脱物沉积呈典型的三个分区,即瞳孔区呈圆盘状、周边区呈环形颗粒状、中间为透明区,眼压>21mmHg并具有青光眼性视神经损害及视野改变;(2)POAG组符合依据中华医学会眼科学分会青光眼学组制定的《我国原发性青光眼诊断和治疗专家共识(2014年)》[11]中关于POAG的诊断标准。
1.1.2排除标准(1)曾做过青光眼滤过手术或其他内眼手术者;(2)明确患有其他眼科疾病影响本次研究结果者,如眼外伤、角膜病变、色素膜炎、视网膜相关病变等眼部疾病;(3)屈光度:球镜度≥±6.0D,柱镜度≥±3.0D;(4)其他类型青光眼;(5)不能配合检查或定期随访者。
1.2方法
1.2.1手术指征依据目标眼压、杯盘比及晶状体核硬度分级标准评估:(1)诊断明确、具有明确视野缺损或视野进展,存在视神经损害且最大药物耐受量(3种)仍不能控制眼压者;(2)对抗青光眼药物反应差,不接受药物治疗或出现药物副作用者;(3)参照Emery及Little晶状体核硬度分级标准:晶状体核硬度Ⅲ级及以上者;(4)无全身禁忌证者。
1.2.2手术方法5g/L盐酸丙美卡因滴眼液表面麻醉3次,20g/L利多卡因注射液0.3mL球结膜下浸润麻醉,制作以穹窿为基底的结膜瓣,巩膜面电凝止血,做以角膜缘为基底4mm×3mm大小、1/3~1/2厚巩膜瓣,将浸有丝裂霉素C(MMC)溶液的棉片置于巩膜瓣及结膜瓣下2~5min,平衡盐溶液冲洗,2∶00位透明角膜缘辅助切口,10∶00位透明角膜缘做3.0mm隧道切口,连续环形撕囊,充分水分离,超声乳化吸除晶状体核及皮质,植入后房型人工晶状体入囊袋内,卡巴胆碱缩瞳,于巩膜瓣下、基底处切除3mm×1.5mm大小的角巩膜小梁组织,行宽基底的周边虹膜切除,10/0尼龙线适度张力缝合巩膜瓣的两个后角,使巩膜瓣暂时性相对牢固缝合,注入平衡盐溶液重建前房,10/0尼龙线间断缝合球结膜组织,术毕结膜囊内涂妥布霉素地塞米松眼膏。术后局部应用糖皮质激素滴眼液及抗生素滴眼液4wk,2wk内依据眼压及滤过泡形态适时激光断线。手术均由同一名资深熟练医生完成。本研究中PXG组和POAG组患者术中使用MMC溶液浓度(0.330±0.0687mg/mLvs0.326±0.0713mg/mL)及应用时间(3.13±0.85minvs3.20±0.86min)比较差异无统计学意义(t=0.259、-0.382,P=0.796、0.704)。
1.2.3观察指标记录两组患者术前和术后1、3、6mo,1、2a视力(LogMAR)、眼压(Goldmann眼压计)、抗青光眼药物使用数量及手术成功率,观察术中及术后并发症发生情况。
手术疗效评定标准:设定两个眼压控制标准(标准A:IOP≤21mmHg;标准B:IOP≤18mmHg)评定手术疗效。手术完全成功:术后达到上述两个眼压控制标准,且均未使用局部抗青光眼药物。手术条件成功:术后局部应用抗青光眼药物(≤3种)后达到上述两个眼压控制标准。手术失败:术后眼压高于上述眼压标准上限,或药物难以控制眼压行二次抗青光眼手术及其他降眼压治疗,或眼压<6mmHg。

2结果
2.1手术前后两组患者视力比较手术前后各观察时间点两组患者视力比较,具有组间差异性和时间差异性(F组间=17.273,P组间<0.001;F时间=33.167,P时间<0.001;F组间×时间=2.125,P组间×时间=0.096),见表2。PXG组平均视力由术前0.782±0.413改善至术后2a 0.368±0.127,术后1、3、6mo,1、2a较术前差异均有统计学意义(P<0.01)。POAG组平均视力由术前0.609±0.220改善至术后2a 0.309±0.134,术后1、3、6mo,1、2a较术前差异均有统计学意义(P<0.01)。术后1、3、6mo,1a,POAG组平均视力均优于PXG组,差异均有统计学意义(P<0.01),术后2a两组间视力差异无统计学意义(P>0.05)。
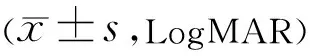
表2 两组患者手术前后视力比较
2.2手术前后两组患者眼压比较手术前后各观察时间点两组患者眼压比较,具有组间差异性和时间差异性(F组间=15.394,P组间<0.001;F时间=23.400,P时间<0.001;F组间×时间=4.438,P组间×时间=0.004),见表3。PXG组平均眼压由术前32.20±12.43mmHg降至术后2a 17.88±2.20mmHg,术后1、3、6mo,1、2a较术前差异均有统计学意义(P<0.01)。POAG组平均眼压由术前26.61±11.39mmHg降至术后2a 16.18±1.80mmHg,术后1、3、6mo,1、2a较术前差异均有统计学意义(P<0.01)。术后1mo两组患者平均眼压差异无统计学意义(P>0.05);术后3、6mo,1、2a,PXG组平均眼压较POAG组偏高,差异均有统计学意义(P<0.05)。

表3 两组患者手术前后眼压比较
2.3手术前后两组患者抗青光眼药物使用数量比较PXG组抗青光眼药物使用数量由术前2(1.25,3)种降至术后1a 1(0,2)种,差异有统计学意义(P<0.01),术后2a 2(1.75,3)种,差异无统计学意义(P=0.248)。POAG组抗青光眼药物使用数量由术前2(1,2)种降至术后2a 0(0,1)种,差异有统计学意义(P<0.01)。术后1、3mo,PXG组抗青光眼药物使用数量与POAG组比较,差异无统计学意义(P>0.05);术后6mo,1、2a,PXG组抗青光眼药物使用数量较POAG组多,差异均有统计学意义(P<0.001),见表4。

表4 两组患者手术前后抗青光眼药物使用数量比较 [M(P25,P75),种]
2.4两组患者手术成功率PXG组术后平均随访时间(22.20±4.40mo)与POAG组(23.22±3.71mo)差异无统计学意义(t=-1.159,P=0.250)。根据手术疗效评定标准,两组术后不同时间点手术完全成功及条件成功率对比结果见表5。采用Kaplan-Meier生存分析评估手术完全成功率和累积成功率,生存曲线见图1,其中图1A为按照A标准完全成功率Kaplan-Meier生存曲线,两组间差异有统计学意义(Mantel-Cox log-rank检验χ2=17.452,P<0.001);
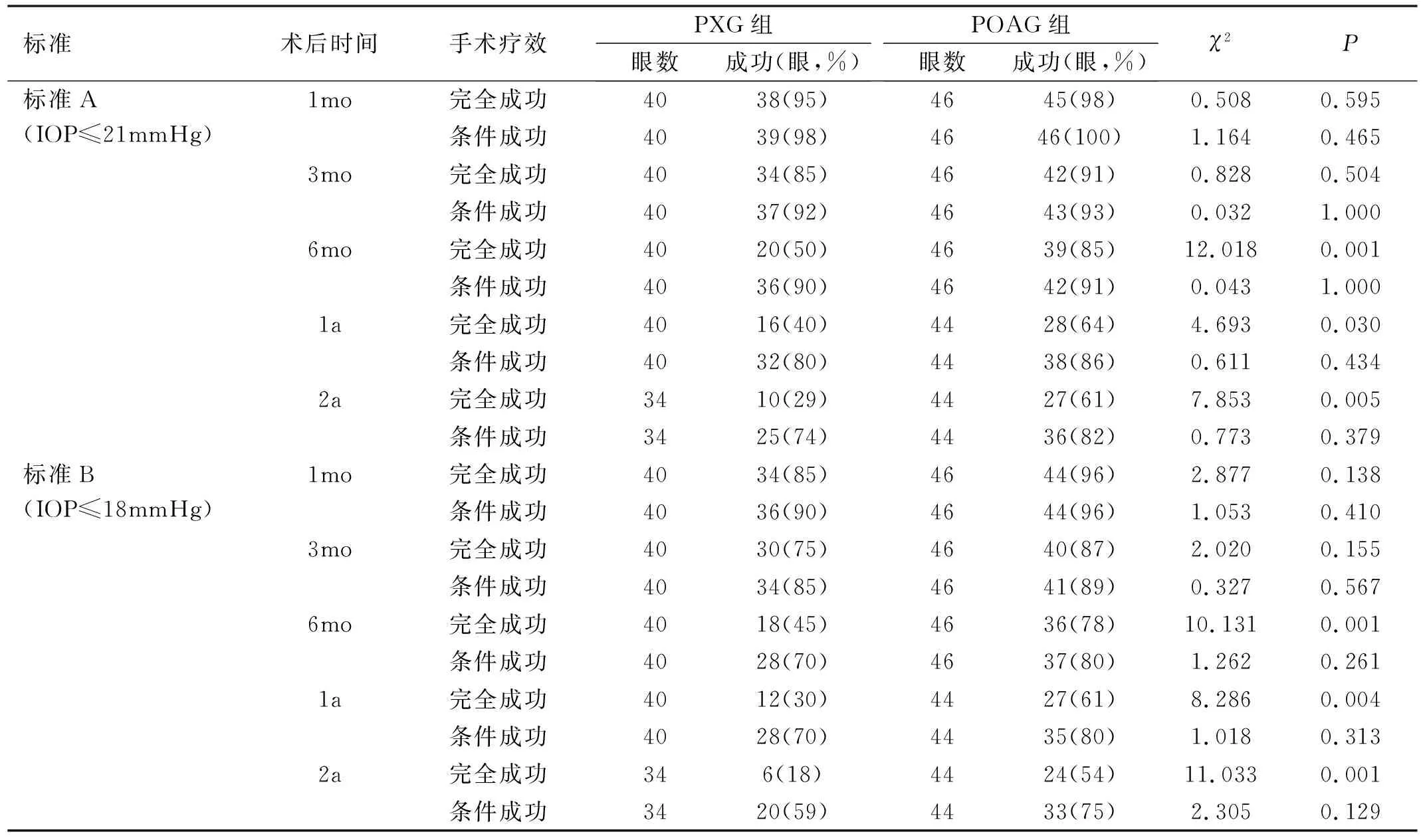
表5 术后两组患者手术成功率比较
图1B为按照A标准累积成功率Kaplan-Meier生存曲线,两组间差异无统计学意义(Mantel-Cox log-rank检验χ2=1.261,P=0.262);图1C为按照B标准完全成功率Kaplan-Meier生存曲线,两组间差异有统计学意义(Mantel-Cox log-rank检验χ2=23.089,P<0.001);图1D为按照B标准累积成功率Kaplan-Meier生存曲线,两组间差异有统计学差异(Mantel-Cox log-rank检验χ2=4.424,P=0.035)。

图1 Kaplan-Meier生存分析曲线 A:A标准完全成功率生存曲线;B:A标准累积成功率生存曲线;C:B标准完全成功率生存曲线;D:B标准累积成功率生存曲线。
2.5并发症情况PXG组10眼(25%)出现术中并发症,其中晶状体后囊膜破裂6眼,人工晶状体悬吊手术4眼;POAG组未见术中并发症;两组术中并发症发生率差异有统计学意义(P=0.008、0.043)。PXG组术后出现前房积血3眼(8%),其中2眼未予处理、自行吸收,1眼经前房冲洗后恢复;POAG组4眼(9%)出现术后并发症,其中前房积血2眼,均未予处理、自行吸收,脉络膜脱离2眼,经药物治疗后均恢复;两组术后并发症发生率差异无统计学意义(P>0.05)。随访过程中未见其他并发症。
3讨论
PXG是由PEX引起的一种常见继发性青光眼,剥脱物沉积于眼前节引起一系列的眼前节结构改变,课题组前期研究[12-13]已对PXG眼前节参数及眼底视神经损害进行研究,对于PEX及PXG患眼,细胞外基质异常所产生的剥脱物是眼前节及眼底视神经损害的始动因素,而高眼压是这个过程中的附加因素。随着PXG病情的进展,视神经纤维层厚度逐渐变薄,这一改变会使视野对眼压变化更加敏感,需要更低的目标眼压[5],因此,针对不同患者制定个体化目标眼压是评价手术成功的可靠方法,这也是本研究根据两个不同的眼压标准来评估手术成功率的原因。本研究旨在针对亚洲人群中PXG和POAG患者行青光眼白内障联合手术临床疗效进行分析。
既往研究多是PXG与POAG患者行小梁切除术的手术成功率比较,多数研究结果显示,术后1a甚至更长时间的随访中,PXG组的手术成功率明显低于POAG组,而且随着随访时间的延长,成功率也逐渐降低[14-15],也有研究认为两者之间并无差异[16]。不同研究手术成功率都不尽相同,这可能与样本量、患者平均年龄、种族差异、手术方式、手术技巧、成功标准、是否应用抗代谢药物及患者依从性有关[17]。小梁切除术联合白内障超声乳化摘除术能明显降低PXG患者的眼压[18-19],对于PXG及POAG患者行小梁切除术联合白内障超声乳化摘除术的相关研究表明,联合手术后眼压可降低、视力可提高[20],这与本研究结果相似。
本研究表明,PXG组与POAG组患者术后视力均提高,手术前后差异有统计学意义,且POAG组术后1、3、6mo,1a平均视力均优于PXG组,差异均有统计学意义,说明手术提高了患者的视觉质量及生活质量。根据标准A、B,PXG组与POAG组术后1、3mo手术完全成功率与条件成功率均无统计学差异,说明两者短期手术成功率相似。根据标准A,PXG组术后6mo,1、2a手术完全成功率均低于POAG组,两组间差异均有统计学意义,Kaplan-Meier生存曲线分析显示两组间亦有统计学差异,这说明在眼压≤21mmHg标准中,PXG患者术后未用药情况下远期手术成功率低于POAG患者,在药物控制(≤3种)情况下两者手术成功率没有明显差异。但对于PXG患者来说,目标眼压标准21mmHg是偏高的[21],因此我们采用了更为严格的标准B。根据标准B,PXG组术后6mo,1、2a手术完全成功率均低于POAG组,两组间差异有统计学意义,这说明在眼压≤18mmHg标准中,PXG患者术后未用药情况下远期手术成功率明显低于POAG患者,在药物控制(≤3种)情况下两者远期手术成功率没有明显差异,但Kaplan-Meier生存曲线分析显示两组间手术成功率有统计学差异,也就是说,按照标准B,两组患者手术完全及条件成功率均有差异,PXG组的手术成功率偏低,即使应用了抗青光眼药物治疗后,PXG患者手术成功率仍较POAG患者偏低。本研究结果与Wojcik-Niklewska等[20]研究术后1a的随访结果基本一致。而对于更高要求的眼压标准,本研究未进行深入研究,主要是由于纳入的PXG及POAG患者的年龄较高,老年人术后用药及局部眼球按摩依从性较差,考虑到老年患者的视力年及生活质量问题,因此未做更严格的要求及进一步的比较,这也是本研究的不足之处。
青光眼白内障联合术后PXG与POAG患者手术完全成功率随着随访时间的延长逐步降低,这与单纯小梁切除术后的眼压变化趋势一致[22],但是两组患者的条件成功率也在逐步降低,且PXG组条件成功率更低,这又是为什么呢?PXG的病理生理机制尚未完全明确,有研究显示PXG患者的眼内本就存在房水闪辉等炎症反应[23],推测PXG患者手术进一步破坏血-房水屏障,导致术后长期、显著的炎症反应[24],纤维蛋白渗出,虹膜粘连形成,术后炎症反应加速滤过泡瘢痕化及滤过功能失败,但也有研究显示白内障手术能降低PEX发展为PXG的风险[9]。其次,PXG患者在小梁切除术后血-房水屏障的破坏较POAG患者更为严重,房水中转化生长因子-β(TGF-β)、内皮素-1(ET-1)及autotaxin(ATX)水平升高[25-27]均会刺激瘢痕形成,虹膜血管病变及系统性血管病变也参与其中,上述因素均会对手术成功率产生一定影响。再次,剥脱物可能对滤过区瘢痕化形成具有促进作用,剥脱物也可能堵塞滤过通道。这也解释了为何本研究中PXG患者术后1a应用抗青光眼药物数量较术前明显减少,而术后2a时较术前无统计学差异。此外,遗传连锁研究、修饰基因、表观遗传影响、体液中的蛋白表达、环境、饮食及氧化作用等也可能是导致PXG进一步发展的因素[28-29]。因此,PXG患者并发症明显多于POAG患者,尤其是术中并发症。尽管有如此之多的因素影响PXG患者青光眼白内障联合术后的眼压控制,导致远期手术成功率偏低,但是对于高龄患者而言,眼压控制是一方面,考虑到人文关怀,提高其视力亦是提高生活质量很重要的一个方面。因此,对于高龄PXG患者而言,青光眼白内障联合手术仍是其理想的手术方式之一。
综上所述,PXG及POAG患者行小梁切除联合白内障超声乳化摘除术后均能在一定程度改善视力,提高患者的视觉质量和生活质量。青光眼白内障联合术后PXG及POAG患者眼压显著降低,两者短期手术成功率相似,但PXG患者远期手术成功率明显偏低,且无法达到理想的低水平眼压控制标准,为了提高PXG患者青光眼白内障联合手术成功率,需及时手术及在术中延长抗代谢药物使用时间,术后及时行激光断线,并配合眼球按摩,积极使用糖皮质激素类药物减轻炎症反应,并需长期、定期随访。
