非生物胁迫下植物DNA甲基化研究进展
2020-12-04刘治民杨芷怡冀凤丹梅志超于佳慧解莉楠
刘治民 杨芷怡 冀凤丹 梅志超 于佳慧 解莉楠
(东北林业大学生命科学学院,哈尔滨 150040)
植物生活在不断变化的环境中,这些环境通常不利于植物的生长和发育。一般来说,环境胁迫可以大致分为生物胁迫和非生物胁迫,其中生物胁迫包括各种病原体感染和食草动物侵袭等;非生物胁迫主要包括干旱胁迫、高盐胁迫、极端温度胁迫和重金属胁迫等[1]。这些胁迫在一定程度上打破植物细胞内已建立的稳态,从而使细胞代谢紊乱,生理功能失调,阻碍植物的生长发育,最终降低农作物的产量。气候变化导致极端天气发生的频率增加,并且加剧了这些非生物胁迫对植物的不利影响[2]。作为固着生长的植物,不能主动躲避自然界中不良的环境刺激,但在漫长的进化和适应过程中,植物发展出适应某些环境因素的能力,演化出能自我保护和适应不良环境的机制[3-4]。通常,植物可以采取3种策略来降低甚至避免这些不利影响,即耐受、抵抗和逃逸。生物适应性应答是由多基因控制的,在很大程度依赖基因表达的动态变化,需要逆境相关基因表达的激活或抑制来协调,植物可以通过在整个基因组转录和转录后水平上的快速而协调地变化来完成这些防御行为[5-6]。
生存在各种不利条件下,植物可以通过多种基因调节机制来恢复和重建细胞稳态。在过去几十年里,科学家们开展了大量对环境胁迫相关基因的研究,包括环境胁迫下基因表达模式,转录后修饰模式,以及基因编码的蛋白质的功能及其作用模式。这些研究丰富了对植物在干旱、高盐、冷和热等非生物胁迫下如何提高适应性的理解,并且逐渐应用于提升植物抗性,以便于扩宽耕地,提高农作物的产量[7-11]。近年来,科学家们发现表观遗传修饰广泛参与植物胁迫应答中。
表观遗传学是一门快速发展的学科,它指在基因的核苷酸序列没有发生改变的情况下,研究生物体可以遗传的表型变化。表观遗传机制在动植物的生命周期中起着十分重要的作用。表观遗传修饰,主要包括DNA甲基化、组蛋白修饰、染色质重塑和非编码RNA(Non-coding RNA,ncRNA),会影响染色质的结构和可及性,从而动态调节基因的表达[12]。DNA甲基化是目前研究最为广泛的表观遗传修饰类型,科学家对DNA甲基化机理和功能的研究也最为清楚。研究表明,DNA甲基化在植物非生物胁迫反应中起着至关重要的作用,使植物能够在恶劣的环境中生存。例如,RNA介导的DNA甲基化(RNAdirected DNA methylation,RdDM)途径介导的DNA甲基化可动态调节大量热胁迫响应基因的表达[13];受盐诱导的AtMYB74转录因子的表达在正常条件下被RdDM沉默,但在盐处理后被激活[13-14]。本文主要综述了近年来DNA甲基化的基本概况,以及非生物胁迫下的DNA甲基化调控,旨在为利用表观遗传机制提高植物的抗胁迫能力提供指导。
1 DNA甲基化概述
在植物中,DNA甲基化是在DNA甲基转移酶(DNA methyltransferase,DNMT)的催化下,将S-腺苷-L-甲硫氨酸(S-adenosyl-L-methionine,SAM)的甲基转移给DNA胞嘧啶,形成5-甲基胞嘧啶(5-mC)的过程。一种特定的DNA甲基化状态是DNA甲基化建立、维持和主动清除的动态调节的结果,这些活动由不同的酶催化,并通过不同途径靶向特定的基因组区域。在植物中,DNA甲基化发生在含有各种胞嘧啶的序列中,包括CG、CHG和CHH(其中H表示A、T或C),它们分别被甲基转移酶1(Methyl-transferase 1,MET1)、染色质甲基化酶3(Chromomethylase3,CMT3)和结构域重排甲基化酶2(Domain Rearranged Methylase 2,DRM2)催化。CG和CHG对称性位点上的甲基化是通过甲基化维持机制实现的,而非对称CHH位点甲基化必须通过在DNA复制后进行从头甲基化来维持,RdDM途径对CHH甲基化的维持起着至关重要的作用。DNA去甲基化有有两种形式,一种是在复制过程中由于DNA甲基转移酶活性不足或甲基供体不足导致无法维持甲基,即被动去甲基化;另一种是通过DNA去甲基化酶介导的主动去甲基化[12,15-17]。
1.1 DNA甲基化的建立
在植物中,DNA从头甲基化是通过RdDM途径介导的,除了蛋白质外,小干扰RNA(Small interfering RNA,siRNA)和 支 架RNA(Scaffold RNA)也参与了该途径[15]。在经典的RdDM途径中(图1),植物特有的DNA依赖性RNA聚合酶POL Ⅳ催化产生长为30-40个核苷酸(Nucleotide,nt)的转录本,随后RNA依赖性RNA聚合酶RDR2(RNAdependent RNA polymerase 2,RDR2)以之为模板合成双链RNA(Double-stranded RNA,dsRNA),并通过切割样酶DCL3(Dicer-like protein 3,DCL3)将dsRNA裂解为24 nt siRNA。siRNA被装载到AGO(Argonaute,AGO)蛋白上,主要是AGO4和AGO6,并与由DNA依赖的RNA聚合酶POL Ⅴ催化产生的互补支架RNA配对,AGO4招募DNA甲基转移酶DRM2到靶位点,催化DNA从头甲基化[16,18-20]。RDM1(RNA-directed DNA methylation 1,RDM1)可以与DRM2和AGO4缔合,并结合单链甲基化DNA,从而辅助该反应进行[21]。已存在的染色质修饰可以介导POL IV和POL V被特异性招募到RdDM靶向位点。SHH1招募POL IV,并通过它的Tudor结构域与H3K9me2的H3结合,同时与CLSY1相互作用,介导Pol IV定位到靶向位点[22-24]。SUVH2和SUVH9可以和DDR(DRD1/ DMS3/ RDM1)复合体相互作用,并通过其SRA结构域识别甲基化的胞嘧啶,介导POL V定位到适当的位置[25]。POL V转录的ncRNA通过RRP6L1被保留在染色质附近[26]。IDP复合体可以稳定支架RNA,并与SWI/SNF染色质重塑复合体相互作用,通过SWI/SNF复合体改变核小体位置[27-28]。
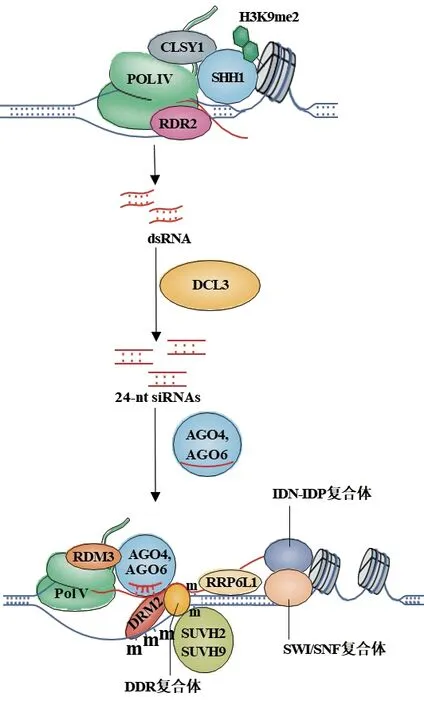
图1 拟南芥中经典的RdDM途径介导DNA甲基化[15]
除了经典的RdDM途径外,DNA依赖性RNA聚合酶II(POL II)和RDR6参与非经典的RdDM途径产生siRNA。POL II和RDR6产生的前体RNA可以被DCL2和DCL4切割产生21 nt或22 nt siRNA,21 nt或22 nt siRNA结合AGO6蛋白,从而激发24 nt siRNA依赖的甲基化途径,也可以被DCL3切割生成24 nt siRNA,起始DNA甲基化[29-31]。已有研究发现,一些不依赖于DCL蛋白产生的siRNA也有可能参与 DNA 甲基化的起始过程[32]。
1.2 维持DNA甲基化
植物中DNA甲基化的维持取决于特定的胞嘧啶序列,并受DNA甲基转移酶的催化。MET1可以识别复制后半甲基化的CG序列,并介导子链中未甲基化的胞嘧啶甲基化,以维持CG甲基化[33]。在拟南芥(Arabidopsis thaliana)中,CHG甲基化的维持主要受CMT3催化,少量由CMT2催化[34-35]。Du等[36]发现玉米(Zea mays)中CMT3同源蛋白MET2A可以和H3K9me2结合,阻断CMT3和H3K9me2相互作用,会破坏CMT3与核小体的结合,并导致CMT3失去活性,DNA甲基化水平显著下降。SUVH4通过其SRA结构与甲基化的CHG结合,并促使H3K9甲基化[37]。CHH甲基化由DRM2或CMT2维持,DRM2可以在RdDM靶向区域维持CHH甲基化[38],而CMT2 则催化含有组蛋白H1的异染色质的CHH甲基化[39]。
1.3 DNA去甲基化
DNA甲基化可以被动失去或主动清除,这两者分别称为被动DNA去甲基化和主动DNA去甲基化。被动DNA去甲基化取决于DNA复制。在DNA复制过程中(图2-A),如果新合成的DNA链没有被DNA甲基转移酶正确靶向或者甲基供体不足,则会导致新的DNA链没有发生甲基化,DNA甲基化水平就会随着DNA复制被稀释[40]。主动DNA去甲基化由DNA去甲基化酶催化。在植物中,DNA去甲基化酶有双功能酶活性功能域,即DNA糖基化酶活性和无嘌呤/无嘧啶裂解酶活性,DNA去甲基化酶通过参与碱基切除修复途径启动DNA去甲基化[41-43]。在植物中,DNA糖基化酶可以直接识别并切除5-mC碱基。在拟南芥中,DNA去甲基化酶家族主要含有4种蛋白质:沉默抑制因子(Repressor of silencing 1,ROS1)、5-mC糖基化酶Demeter(DME)、DML2(Demeter-like proteins 2)和DML3[41,43]。在去甲基化过程中(图2-B),IDM复合体识别高度甲基化区域,介导H3K18Ac,为其招募的ROS1行使功能提供相对松散的染色质环境,但目前尚不清楚ROS1被招募的具体机制[44]。DNA去甲基化酶被招募后首先发挥DNA糖基化酶活性,水解碱基和脱氧核糖之间的糖苷键,然后作为无嘌呤/无嘧啶裂解酶切割DNA骨架,产生无碱基位点。在切口处3'末端进行β-消除产生3'-磷酸-α,β-不饱和醛(3'-PUA)或进行β,δ-消除产生3'-磷酸。随后APE1L将β-消除产生的3'-PUA转化为3'-OH,ZDP将β,δ-消除产生的3'-磷酸转化为3'-OH,然后DNA聚合酶和连接酶来连接切口[45-46]。目前尚不清楚哪种聚合酶参与这一过程,但在拟南芥中发现DNA连接酶LIG1与ROS1、ZDP和APE1L共定位,介导去甲基化后DNA链切口的连接[47]。
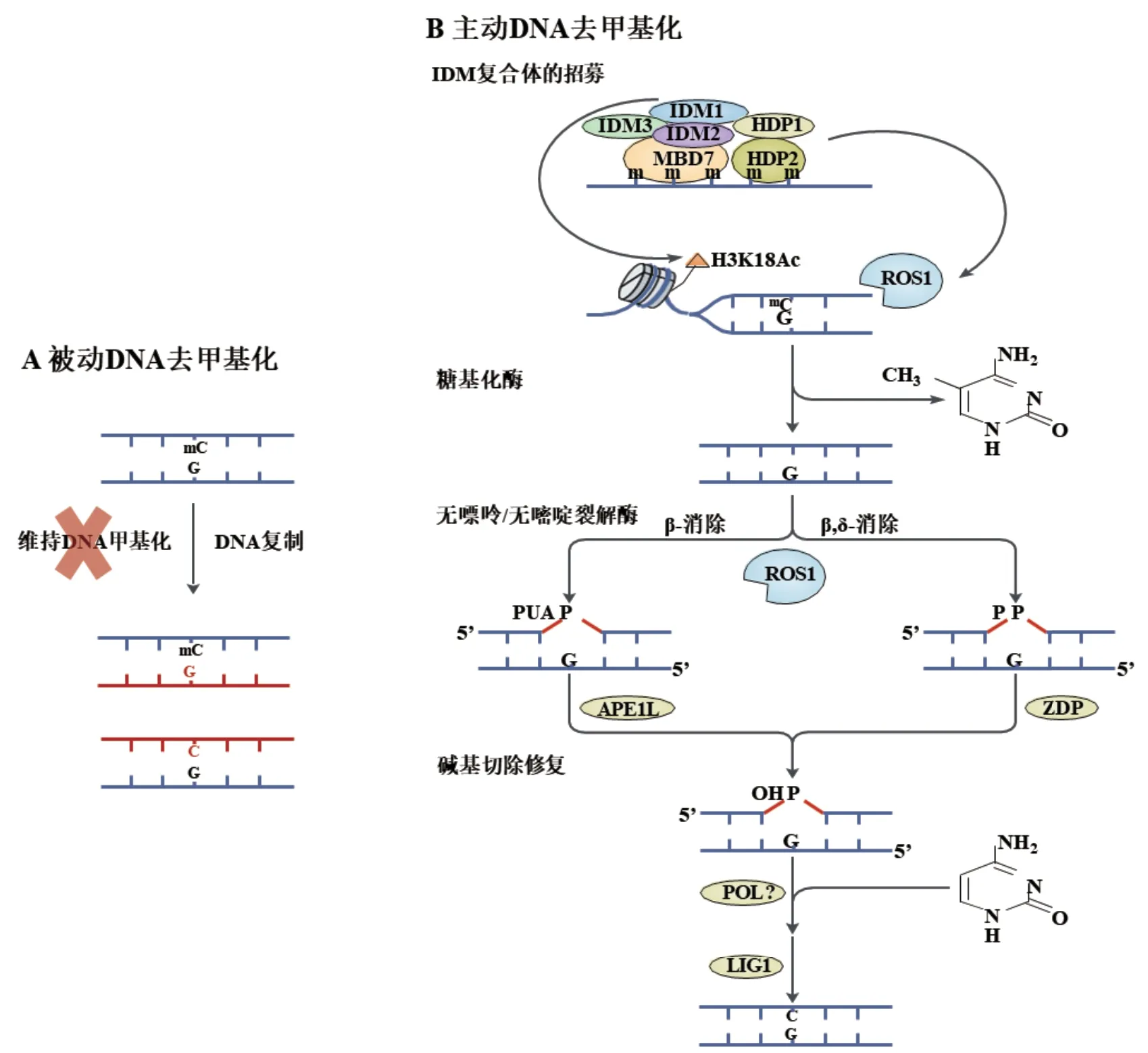
图2 拟南芥DNA去甲基[15]
2 非生物胁迫下的DNA甲基化调控
2.1 盐胁迫
土壤中盐(主要是Na+)含量过高会使植物遭到渗透胁迫、离子胁迫以及氧化胁迫等次生胁迫,这将阻碍植物的生长发育,进而降低农作物的产量。研究员对植物适应盐胁迫的机理研究较为透彻。在植物中,细胞离子稳态是由Ca2+-钙调素B样蛋白(CBL)-CBL相互作用蛋白激酶(CIPK)模块调控。高Na+、低K+、过量的Mg2+和高/低PH会使Ca2+快速转移,分别激活SOS3-SOS2-SOS1(Salt overly sensitive,SOS)、CBL1/9-CIPK23-AKT1(Arabidopsis K+Transporter,AKT1)、CBL2/3-CIPK3/9/23/26- Mg2+转运蛋白和CBL2-CIPK11/14-H+ATPase信号通路[1]。HKT1(High-affinity K+channel 1,HKT1)是 参 与SOS途径中重要的转运体,介导植物中Na+内流。植物中,HKT1基因的突变可以抑制sos3对NaCl的超敏表型[48]。从ATG起始密码起HKT1基因启动子的2.6 kb串联重复序列区域被高度甲基化[49]。在RdDM途径中,RDR2是24-nt siRNA的生物合成所必需的。Baek等[49]揭示RDR2的突变导致AtHKT1基因的高转录,并且耗尽AtHKT1的RdDM靶向区域和串联重复序列,从而产生NaCl敏感表型,这说明AtHKT1是RdDM介导的DNA甲基化的靶基因。Kumar等[50]在小麦(Triticum aestivum)中也发现类似的调节行为。AtMYB74是R2R3-MYB基因家族的成员,其表达受盐诱导,徐瑞等[14]发现在盐胁迫下24-nt siRNA可以通过RdDM途径调节AtMYB74的表达。Song等[51]发现盐胁迫下大豆(Glycine max)约有49个转录因子出现表达差异,对这些基因的表达水平和DNA甲基化水平进行检测,发现MYB、b-ZIP和AP2/DREB转录因子家族的表达图谱与其序列的甲基化显著相关。Huang等[52]在转基因番茄(Solanum lycopersicum)中发现,SlAGO4A基因表达下调会改变一些活性氧(Reactive oxygen species,ROS)清除系统和植物防御相关基因的表达水平,以增强对盐和干旱胁迫的耐受性,并且与野生型和SlAGO4A过表达植株相比,一些DNA甲基转移酶和RNAi途径基因表达水平显著偏低。这说明SlAGO4A通过DNA甲基化和RNAi途径的调节发挥负作用。
2.2 干旱胁迫
干旱胁迫会严重影响正常植物的生理生化过程,产生渗透胁迫、氧化损伤以及光合作用下降等不良危害。为了减轻干旱对自身的影响,在长期进化过程中,植物演化出能抵御和适应不良环境的调节系统。已经证明DNA甲基化是植物参与适应干旱胁迫的调节系统中重要的一环。Liang等[53]发现在毛果杨(Populus trichocarpa)中干旱胁迫可以诱导DNA甲基化水平的改变,进而改变许多干旱胁迫基因的表达模式。Komivi等[54]将甲基化敏感扩增多态性和转录组分析结合,分析芝麻(Sesamum indicum)中胞嘧啶甲基化模式、转录组的积累以及其在耐旱基因型中的相互作用。与对照组相比,干旱胁迫显著增加DNA甲基化水平,而当胁迫条件去除时,甲基化水平倾向于恢复到对照组水平。差异积累的转录 本(Differentially accumulated transcripts,DATs)分析显示77%的DATs水平在干旱胁迫时下降,在恢复阶段,超过80%的DATs水平升高,转录水平变化的模式与DNA甲基化改变密切相关。这说明在干旱胁迫下高的从头甲基化水平可能导致大量干旱应答基因转录本水平的降低,而在恢复阶段高去甲基化水平允许恢复干旱应答基因转录本的积累。Sharma等[55]研究严重干旱对芥菜(Brassica juncea(L.)Czern.)变种RH30各种胁迫响应基因甲基化水平的变化发现,在所有基因中基因体甲基化均增加,而启动子甲基化取决于基因的功能,负责延迟凋亡的基因启动子被低甲基化,而负责正常活动的许多基因在启动子区域被高甲基化。在响应干旱胁迫时,胁迫相关基因通常表现出不同的甲基化和去甲基化事件,通过甲基化和去甲基化使胁迫响应基因沉默或激活,以适应极端的环境。胁迫因子可能也会直接影响甲基化酶和去甲基化酶来介导调节甲基化水平。Moglia等[56]发现在干旱和盐胁迫下,茄子(Solanum melongena L.)某些C5-MTases(Cytosine-5 DNA methyltransferase)和去甲基酶基因表达存在明显的上调和下调,其他C5-MTase和脱甲基酶基因的表达谱无变化。
2.3 极端温度胁迫
2.3.1 低温胁迫 低温胁迫被认为是制约丘陵地区农业发展和作物产量的主要环境因素之一[57]。非冷冻低温胁迫会引起冷害,如造成光合作用相关的损害,细胞凋亡失调,膜流动性丧失以及最终萎缩,从而破坏植物的生长生理。ICE-CBF-COR途径在植物对抗低温胁迫中起着重要作用。已有研究发现DNA甲基化调控与植物的耐寒性显著相关。Guo[58]通过对筛选出的耐寒水稻(Oryza sativa L.cv.)P427低温处理下生理特性、转录组和甲基化的统计分析发现,冷胁迫下ICE-CBF-COR途径相关的基因包括WRKY基因表达量增加;OST1同源基因Os03g0610900启动子区域甲基化降低,而其表达水平升高。这表明低温胁迫下,甲基化与基因表达水平存在差异。Kumar等[59]检测到低温和甲基化变化之间存在显著的相关性,苹果(Malus domestica)休眠期间的低温处理很可能通过DNA甲基化来影响表观遗传调控。Song等[60]发现组蛋白去乙酰化抑制剂(Trichostatin A)和DNA甲基化抑制剂(5-Aza-2'-Deoxy cytidine)处理可以提高拟南芥在低温胁迫下的耐寒性并影响低温诱导基因的表达。产祝龙等[61]发现在rdm4突变体中,拟南芥耐寒性降低,CBFs和CBF调节基因表达量下降;但过表达RDM4时CBFs和CBF调节基因表达量增加,并且低温诱导产生的膜损伤减少,表明RDM4在调节低温下的基因表达中具有重要作用,可能是通过CBF途径介导的。Zhu等[62]检测到茶树(Camellia sinensis)在低温和干旱胁迫下,除CsCMT1和CsCMT2外,大多数CsC5-MTases基因表达显著下调,而4种CsdMTase(DNA demethylase)基因的转录丰度显著增加。综上所述,胁迫因子可以改变DNA甲基化相关基因的表达水平,进而改变胁迫响应基因甲基化水平,介导植物对逆境的适应。植物的低温反应是一个复杂的过程,涉及多个基因和多个信号通路。甲基化调控只是植物低温反应信号网络的一个方面。
2.3.2 热胁迫 与低温胁迫一样,热胁迫使植物发生一系列的形态、生理和生化变化,严重威胁植物的生长发育。植物中热胁迫响应相关的转录调节网络已经得到了全面的阐述[63]。HsfA1(Heat shock transcription factor A1s)是参与热胁迫响应的核心转录因子,其活性受到如磷酸化/去磷酸化和蛋白-蛋白相互作用等翻译后修饰的调节,并且HsfA1可以直接诱导下游热胁迫相关转录因子的表达,介导热胁迫应答[63]。已有研究表明表观遗传修饰调控了热响应基因的表达,并起到了预防热相关损伤的作用。Qian等[64]通过热胁迫下玉米叶片的DNA构建了6个MethylRAD文库,在对照组和热胁迫处理条件下分别获得14 187 048和16 985 118个净读数,其中有25 470个基因甲基化,并获得325个差异甲基化基因(Differentially methylated genes,DMGs)(200个CCGG位点,125个在CCWGG位点),并发现在CCGG位点的101个DMGs和在CCWGG位点的57个 DMGs甲基化水平上调,在CCGG位点的99个DMGs和 在CCWGG位 点 的68个DMGs甲基化水平下调。这说明热胁迫会诱导胁迫抗性基因的甲基化水平发生变化。拟南芥中,DRM1、DRM2和CMT3抑制蛋白SDC(Suppressor of DRM1 DRM2 CMT3,SDC)是一种介导蛋白质降解的F-BOX家族蛋白,可以在转录水平上调节一些长期热胁迫响应基因的表达[65]。SDC基因是RdDM途径的靶基因,在正常情况下被表观沉默,但在热胁迫下被激活。因此,该基因的活性有助于植物从胁迫中恢复[13],表明热胁迫的转录反应至少部分依赖于RdDM通路。Naydenov等[66]发现野生型DNA甲基化相关基因对高温有特异性反应,一方面DRM2、NRPD1和NRPE1的表达稳定上调,且上调幅度低于ROS1;另一方面,高温处理6 h后,MET1和CMT3的转录水平升高,但与对照组相比,随着处理时间延长,MET1和CMT3转录水平下降;而在nrpd1a-1和nrpd1b-1的双突变体中,高温处理产生与野生型不同的表达谱图:DRM2和MET1表达被强烈抑制,且ROS1的表达几乎完全消失。此外,Fan等[67]在油菜(Brassica napus)中鉴定了22 个DNA甲基化酶和去甲基化酶基因,在热胁迫下,这些基因的表达量发生显著变化。这说明,热胁迫可能通过直接或间接影响参与DNA甲基化的基因的表达,来调节热胁迫相关基因的表达,以达到对高温环境的适应。
2.4 其他胁迫
适宜的营养吸收方式对植物的生长发育至关重要,植物已经进化出复杂的机制来适应土壤中养分的变化。迄今为止,关于植物对营养胁迫反应的表观遗传调控的研究主要集中在组蛋白甲基化、组蛋白变异和DNA甲基化等方面[68]。拟南芥在低磷胁迫下全基因组DNA甲基化发生广泛重塑,一般情况下这些影响与基因的表达有关[69]。MSAP研究证实缺氮情况下,受胁迫植物的叶片组织中发生了基因座特异性甲基化改变[70]。Chen等[71]鉴定了长期缺锌时拟南芥全基因组范围内DNA甲基化的变化,并证明CG和CHG中的差异DNA甲基化与一些锌缺乏基因的上调有关,而CHH没有差异DNA甲基化。进一步研究发现,在缺乏非CG甲基化的ddc(drm1、drm2和cmt3)三突变体中,缺锌时表现出更为严重的发育缺陷。这说明DNA甲基化动态性与锌缺乏引起的反应有特殊的联系。此外也有研究表明,一些关键的硫酸盐反应基因在响应硫酸盐胁迫时也依赖于DNA甲基化的调控[72]。脱落酸(Abscisic acid,ABA)是重要的植物逆境激素,多种环境胁迫会诱导ABA的生成。越来越多的研究表明ABA广泛参与调控DNA甲基化与去甲基化依赖性基因的表达。例如,Kim等[73]发现一些受ABA诱导基因的表达也会受ROS1依赖的DNA去甲基化的调节。在黑藻(Hydrilla verticillate)中,过量的铜可以显著诱导DRM、CMT和SUVH6等DNA甲基化相关蛋白的表达,这与暴露在过量的铜下黑藻DNA甲基化水平发生显著变化一致,进一步研究发现,ROS的产生参与全基因组DNA甲基化水平的改变[74]。与敏感型和没有胁迫处理的抗性小麦相比,在重金属铅、镉和锌胁迫下,抗性小麦金属解毒转运体基因TaHMA2和TaABCC2/3/4启动子区域DNA甲基化水平偏低,转运体基因表达上调[75]。这说明DNA甲基化参与小麦抵抗金属毒性。
3 DNA甲基化介导的非生物胁迫记忆
在自然条件下,植物通常不可避免地经历重复的胁迫。如图3所示,植物响应胁迫刺激而产生的应答可以是短期的,也可以是长期的[76]。短期的应答不可遗传,只能给予植物当代抗性和适应性。越来越多的证据表明,胁迫条件下生长的植物DNA甲基化模式可以跨代遗传,给予植物当代及其后代稳定的抗性。例如,Feng等[77]发现在盐和碱胁迫下,水稻不同基因型的自交后代中DNA甲基化水平持续存在。植物的这种胁迫诱导的跨代记忆有助于快速适应多变的环境,在生存和繁殖之间达到更好的平衡[78]。Cong等[79]发现DNA甲基化参与水稻对重金属胁迫反应的跨代记忆,在响应重金属胁迫时重金属转运P型ATP酶基因HMA表达上调,而且在去除重金属后观察到基因表达出现跨代记忆。进一步研究发现逆转录转座子Tos17的DNA甲基化状态在重金属胁迫下发生改变,并在三代内表现为跨代遗传。Verhoeven等[80]对蒲公英(Taraxacum officinale)无性系DNA甲基化的研究揭示与对照组相比,胁迫处理中甲基化位点改变的比例相对较高,且DNA甲基化的改变可以遗传给后代。
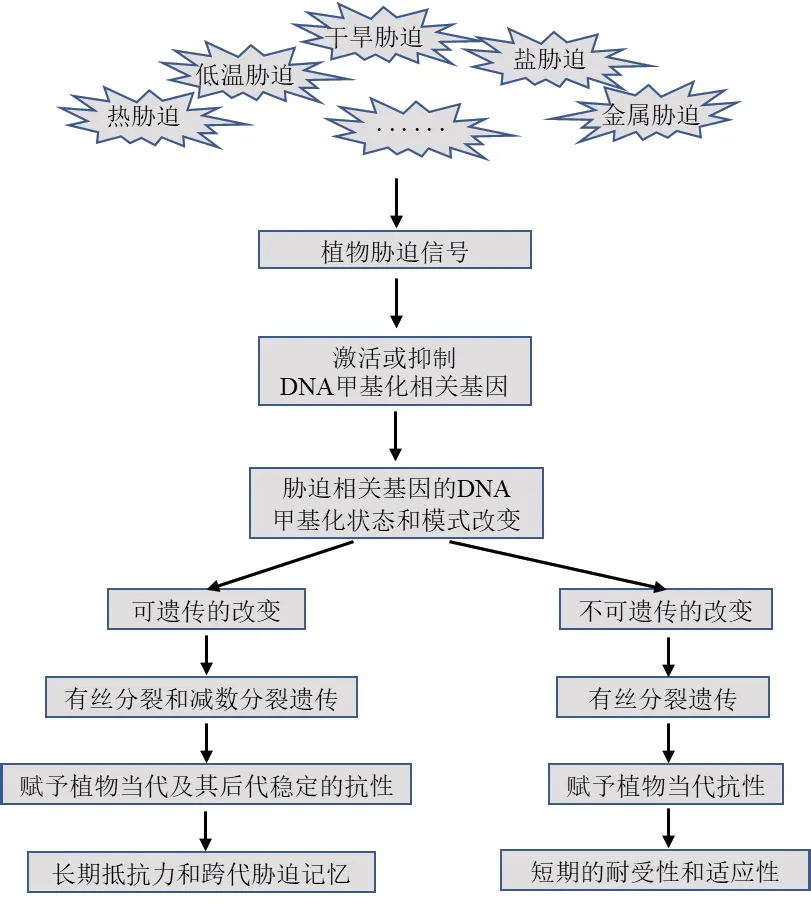
图3 DNA甲基化介导的逆境应答和胁迫记忆过程示意图
4 展望
DNA甲基化作为一种重要的表观遗传修饰,在调节基因表达、介导植物对逆境的响应以及控制植物的生长发育方面起着重要的作用。通过对模式植物拟南芥以及其他生物的研究,人们对DNA甲基化建立、维持和主动去除的动态性机制有了更深的了解,并逐渐挖掘出DNA甲基化的功能。但是对一些介导DNA甲基化动态性的关键酶的了解还不够全面,甚至仍有一些关键酶是未知的。虽然已经证明环境胁迫会导致DNA甲基化相关基因的表达发生变化,但是这些胁迫信号是如何作用于这些基因还有待去发现。此外,在有丝分裂和减数分裂中,胁迫相关基因的甲基化模式有多大程度可以遗传给后代,以及在后代中,这些胁迫记忆如何调控基因表达控,控制植物发育和抗逆性,还需要研究。作为一个完整的系统的有机体,胁迫处理会导致植物发生一系列包括DNA甲基化但又不局限于DNA甲基化的反应,来适应周围的环境刺激。经典的遗传机制和包括组蛋白修饰、染色质重塑和非编码RNA等在内的表观遗传修饰共同参与植物对外在胁迫的应答。随着DNA测序技术、表达芯片以及高通量DNA甲基化分析技术的发展,研究人员得以深入研究逆境胁迫下植物基因组、转录组和表观遗传组的变化,使得系统研究植物响应胁迫因子的反应机理成为可能。同时,对DNA甲基化调控的胁迫应答的深入研究,为改良作物抗性和提高产量提供新的途径。
