非洲猪瘟病毒K196R和A240L蛋白的可溶性表达及酶活力分析
2020-12-04李鹏昊梁严予王彦伟关洋逄文强田克恭
李鹏昊 梁严予 王彦伟 关洋 逄文强 田克恭
(国家兽用药品工程技术研究中心,洛阳 471003)
非洲猪瘟(African Swine Fever,ASF)是由非洲猪瘟病毒(African Swine Fever virus,ASFV)引起的一种高致死性传染病,危害巨大,目前在我国已被列为一类动物疫病[1]。安全、有效疫苗的研制对于ASF的防控具有非常重要的意义,但ASFV基因组较大,约为170-190 kb,共编码了150多个开放阅读框[2];不同ASFV毒株基因组之间存在有一定的差异,病毒自身也有着非常复杂的免疫逃避机制[3],这些都为ASFV疫苗的研发带来了较大的挑战和困难。
ASFV主要感染宿主的单核巨噬细胞,可引起严重的组织坏死、出血,最终导致宿主死亡[4]。ASFV对宿主巨噬细胞的特异性吸附及内化,主要依赖自身编码的p54和p30等蛋白介导的内吞作用来实现[5]。而ASFV感染后在宿主细胞中的复制,需在多个由其自身编码的DNA复制相关蛋白酶的催化作用下完成,如A240L、B962L、EP1242L、NP1450L和E165R等[6]。其中,部分参与DNA复制的酶与ASFV的毒力密切相关。已有研究表明,ASFV缺失DP69R、DP71L、A240L、B119L和DP148R能够针对亲本毒株提供较好的攻毒保护[7]。在ASFV临床诊断方面,参与其DNA复制的一些酶类如K196R通常在感染早期表达,多作为ASFV相关诊断试剂研究的靶蛋白[8]。因此,对ASFV相关蛋白酶进行表达和功能研究,对其临床诊断及免疫预防研究都具有十分重要的意义。
大肠杆菌原核表达系统可以快速实现异源蛋白的高效表达,然而也存在目的蛋白易形成包涵体等问题。研究表明,密码子优化[9]、载体表达元件优化[10]及添加促溶标签[11]等,是提高目的蛋白可溶性的有效方法。目前,已有较多ASFV的结构蛋白和非结构蛋白利用大肠杆菌原核表达系统实现了可溶性表达;为了探究K196R和A240L蛋白的特性及其在ASFV感染宿主过程中的潜在功能作用,本研究通过添加促溶标签的方式,将其在大肠杆菌中进行了可溶性表达,并对其反应性及体外酶催化活力进行了初步考察,旨在为ASFV相关诊断试剂的研究提供候选抗原蛋白,并为相关蛋白的功能研究提供一定的依据。
1 材料与方法
1.1 材料
大肠杆菌DH5α和BL21(DE3)感受态细胞、质粒小提试剂盒和琼脂糖凝胶回收试剂盒购自天根生化科技(北京)有限公司;激酶通用酶活检测试剂盒购自西格玛奥德里奇(上海)贸易有限公司;pET28a、pET28a-SUMO和pET28a-MBP载体(SUMO和MBP标签C端带有TEV酶切位点,N端带有His标签)由本实验室构建保藏;引物及基因序列合成与测序均由苏州金唯智生物科技有限公司完成;2×TransStart FastPfu PCR SuperMix(-dye) 高保真DNA聚合酶购自北京全式金生物技术有限公司;T4 DNA连接酶和限制性内切酶购自赛默飞世尔科技公司;TEV酶由本实验室制备保藏;ASF阳性参考血清购自欧洲非洲猪瘟参考实验室(Centro de Investigación en Sanidad Animal(CISA-INIA),Madrid,Spain);HRP标记的羊抗猪IgG购自西格玛奥德里奇(上海)贸易有限公司。
1.2 方法
1.2.1 表达载体的构建 根据ASFV SY18株K196R和A240L密码子优化后的基因序列设计PCR引物,A240L-F(5'-3'):CGCGGATCCATGCGTGGAATACTCATTGC(包含BamH I酶切位点),A240L-R(5'-3'):CCCAAGCTTTTAAACGATGAAGTCGTATT(包 含HindIII酶切位点);K196R-F(5'-3'):CGCGGATCCATGAACATCATCCGTAAACT(包含BamHI酶切位点),K196R-R(5'-3'):CCCAAGCTTTTAGTATTTGATCGGCTGCA(包含HindIII酶切位点)。以合成的目的基因序列为模板,扩增出目的基因片段,PCR反应程序为95℃变性20 s、56℃退火20 s、72℃延伸35 s,共35个循环;PCR产物经琼脂糖凝胶回收后与表达载体一同用BamHI和HindIII限制性内切酶37℃酶切1 h,并进行纯化回收,回收产物由T4 DNA连接酶室温连接1 h,然后转化DH5α感受态细胞;提取转化子质粒,酶切验证正确后,进行测序鉴定。
1.2.2 目的蛋白的表达 表达载体验证正确后分别转化BL21(DE3)感受态细胞,并进行摇瓶发酵考察。摇瓶发酵条件如下:种子液按1%接种量接种至LB液体培养基(添加终浓度为50 μg/mL的卡那霉素),37℃、220 r/min培养至OD600为0.6左右,添加终浓度为0.5 mmol/L的IPTG诱导目的蛋白表达,诱导时长为12 h。收集菌体沉淀,使用缓冲液A(500 mmol/L NaCl,20 mmol/L Tris,pH 7.0)按1∶20的体积比进行重悬破碎,4℃、13 500 r/min离心10 min分离上清、沉淀(用原倍体积的上述缓冲液重悬),用于SDS-PAGE检测。
1.2.3 目的蛋白的纯化和鉴定 摇瓶发酵所得菌体破碎上清,经0.45 μm过滤后用装有Ni Sepharose 6 Fast Flow填料的Tricon柱进行纯化,利用咪唑进行梯度洗杂、洗脱,所得产物进行SDS-PAGE检测。蛋白洗脱样品用PBS缓冲液透析后,添加1/50(V/V)的TEV酶室温酶切处理1 h,经过Ni亲和层析进行标签去除,收集流穿液用于SDS-PAGE检测。蛋白纯化后进行Western blot鉴定,条件如下:电压25 V,电流2.5 mA,转膜时间7 min;以稀释1 000倍的ASF阳性参考血清和阴性血清分别作为一抗,以稀释2 000倍的HRP标记的兔抗猪IgG作为二抗。1.2.4 体外酶活力测定 使用激酶通用酶活检测试剂盒对目的蛋白的体外酶反应活力进行检测。依次向96孔反应板中加入20 μL的激酶反应溶液(溶液I)、20 μL的ADP反应缓冲液(溶液II)和10 μL的ADP反应液(溶液III),共50 μL的反应体系;室温反应30 min左右后,检测其荧光强度(λex=540 nm/λem=590 nm),并根据荧光强度标准曲线计算酶活;标准曲线制作:将ADP标准存储液用激酶反应缓冲液梯度稀释至0.05、1、2、5、10、20和30 μmol/L,并作为激酶反应溶液添加至反应体系。
2 结果
2.1 表达载体的构建
以ASFV SY18株来源密码子优化后的K196R和A240L基因序列为模板,分别使用引物组K196RF/R和A240L-F/R对目的基因进行PCR扩增,得到大小分别为600 bp和750 bp左右的基因片段(图1)。使用BamH I和Hind III酶同时对目的片段pET28a、pET28a-SUMO和pET28a-MBP载体进行双酶切,酶切产物连接后转化大肠杆菌DH5ɑ感受态细胞。提取转化子质粒,进行测序验证(测序结果未显示)。
2.2 目的蛋白的表达
重组载体验证正确后分别转化大肠杆菌BL21(DE3)感受态细胞,并进行摇瓶发酵考察。结果,K196R和A240L蛋白单独表达时均大部分以包涵体形式存在于沉淀中,上清中无明显表达(图2)。通过表达条件筛选,K196R蛋白在添加SUMO标签条件下可实现较好的可溶性表达,蛋白大小为40 kD左右(图2);而A240L蛋白添加MBP标签表达上清中目的蛋白表达水平较高,蛋白大小为67 kD左右(图2)。
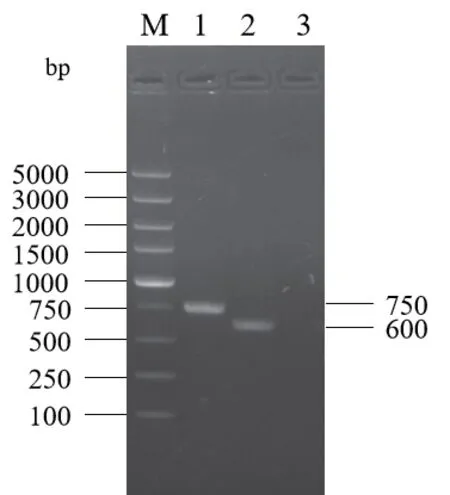
图1 K196R和A240L编码基因的PCR扩增
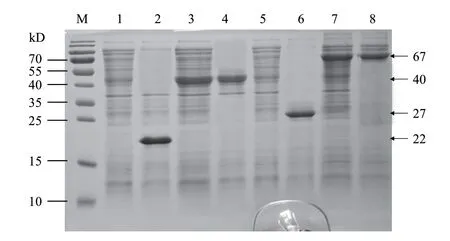
图2 目的蛋白表达的SDS-PAGE检测
2.3 目的蛋白的纯化
表达的SUMO-K196R和MBP-A240L蛋白,利用亲和层析进行纯化,SDS-PAGE结果(图3)显示,洗脱所得目的蛋白具有较高的纯度。使用TEV酶对洗脱蛋白进行酶切处理,酶切产物上样后收取流穿,进行SDS-PAGE检测;结果酶切处理后融合标签与K196R和A240L蛋白能够完全分离,标签去除后所得K196R和A240L蛋白纯度较高,大小分别为22 kD和27 kD左右(图3)。
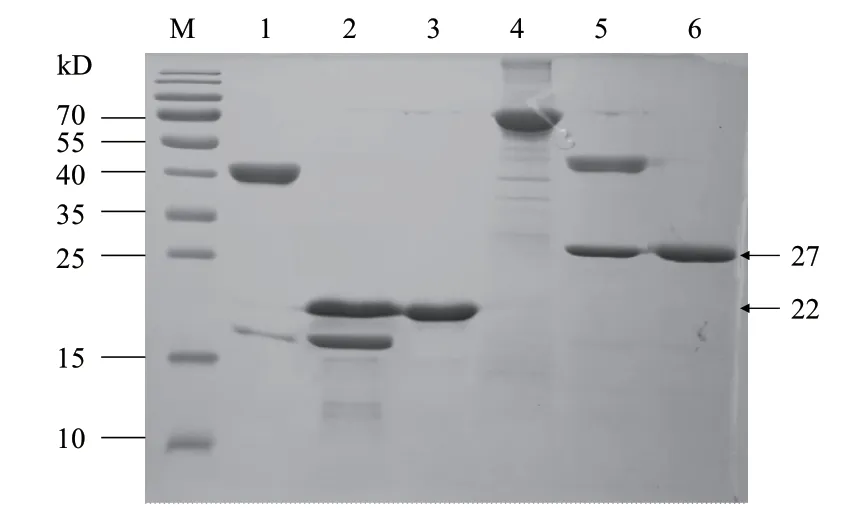
图3 目的蛋白纯化与酶切的SDS-PAGE检测
2.4 K196R和A240L蛋白的Western blot鉴定
K196R和A240L蛋白纯化后进行western blot鉴定,结果如图4中所示。纯化后的K196R蛋白可鉴定出大小为22 kD左右的特异性条带,与SDS-PAGE结果一致;而纯化后的A240L蛋白鉴定出的特异性条带大小为27 kD左右,同样与其SDS-PAGE结果一致;该结果表明,纯化所得K196R和A240L蛋白,均能够与ASF阳性血清产生较好的特异性反应。
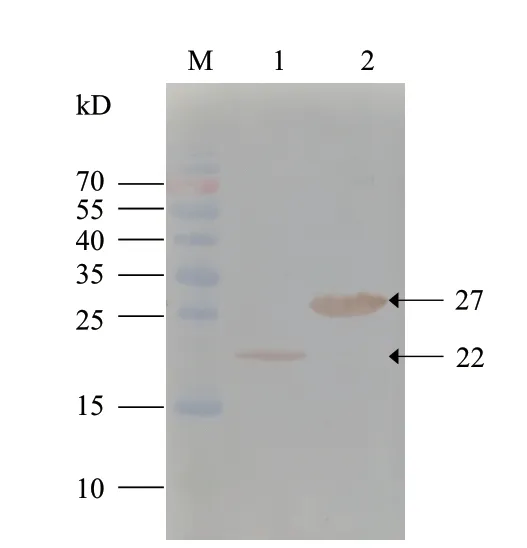
图4 K196R和A240L蛋白的Western blot鉴定
2.5 体外酶活力检测
纯化所得K196R和A240L蛋白利用酶活检测试剂盒进行体外酶活力分析,并根据标准曲线计算酶活力值,结果如图5所示。其中,K196R蛋白酶体外酶活力为(36.4±2.9)U/mg,而A240L蛋白酶体外酶活力为(47.9±3.6)U/mg;该结果显示与阴性对照组(Negative control)相比,纯化后的K196R和A240L蛋白均具有一定的体外酶催化活性。
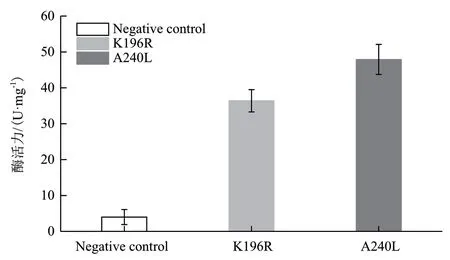
图5 K196R和A240L蛋白酶活力检测结果
3 讨论
ASFV基因组大小为170-194 kb,主要由3部分组成:末端为37 nt部分碱基互补配对的发卡环结构,由串联重复序列和多基因家族(Multigene families,MGF)构成的可变区以及中间部分的稳定区,而可变区基因的变化是造成ASFV株间差异的主要因素[12]。A240L蛋白为ASFV早期感染后表达的一种胸苷酸激酶,属于360多基因家族成员,具有较为保守的ATP及核苷酸结合功能域[13];ASFV的基因组学分析表明,A240L蛋白可能参与病毒DNA复制及转录相关的生物过程[14-15]。K196R蛋白是ASFV编码的一种胸苷激酶(Thymidine Kinase,TK),该蛋白于ASFV感染早期表达,且能够诱导宿主细胞产生较高水平的特异性抗体,具有较好的免疫原性[16-17]。
关于K196R和A240L蛋白在ASFV复制及感染过程中的作用,已有相关研究对其进行了阐述,然而目前尚无对这两种蛋白进行表达和鉴定的报道。本研究通过添加融合标签,实现了ASFV SY18株编码的K196R和A240L蛋白在大肠杆菌中的可溶性表达;Western blot结果显示这两种蛋白均能够与ASF阳性参考血清发生较好的特异性反应,说明ASFV感染宿主后产生了针对这两种蛋白的特异性抗体,且所产生的抗体可以很好的识别利用大肠杆菌原核表达系统表达出的抗原蛋白。此外,本研究利用ASF临床分离血清样本对表达的蛋白进行验证,结果与ASF阳性参考血清无差异(数据未显示),证明K196R和A240L蛋白可作为潜在的候选抗原蛋白用于ASFV相关诊断试剂的研究。
在疫苗研究方面,研究发现ASFV Malawi毒株缺失TK(K196R)后其毒力显著降低,且能够针对其亲本毒株提供较好的攻毒保护[18]。因此,K196R蛋白能够与ASFV阳性血清发生较好特异性反应的结果,在一定程度上说明该蛋白存在用于鉴别疫苗免疫及野毒感染的潜在可能性。此外,基因IX型的Ken06.Bus毒株与基因X型的Ken05/Tk1株相比,其360多基因家族多个基因的保守区均发生了截短,包括8L、A240L、O174L、C84L和I267L等[19];表明A240L蛋白在ASFV基因分型及流行病学研究方面同样具有一定的应用价值。
本研究还对K196R和A240L蛋白的特性进行了初步探究,酶活检测试验结果表明这两个蛋白均具有一定的体外酶催化活性。近来,以ASFV复制相关酶为靶点的靶向药物研究为ASFV的防控提供了新的思路[20]。因此,与ASFV复制相关的K196R和A240L蛋白酶可能对其靶向药物的研究开发也具有一定的价值。综上所述,本研究通过与促溶标签融合表达的方式实现了K196R和A240L蛋白在大肠杆菌中的可溶性表达,并对其反应性和活性进行了初步考察,为ASFV的临床诊断及蛋白的相关功能研究提供了一定的依据。
4 结论
ASFV K196R和A240L蛋白的编码序列密码子优化后,通过添加促溶标签,实现了在大肠杆菌中的可溶性表达;标签去除后K196R和A240L蛋白均可被ASF阳性血清特异性识别,且具有一定的体外酶催化活性。
