四烯甲萘醌保护成骨细胞氧化损伤的作用研究
2020-12-04蒋益忠林丽娟辛海量金玉娥蒋益萍薛黎明浙江省东阳市中医院浙江东阳05海军军医大学药学院生药学教研室上海004上海市疾病预防控制中心化学品毒性检定所上海006
蒋益忠,林丽娟,辛海量,金玉娥,蒋益萍,薛黎明 (. 浙江省东阳市中医院,浙江 东阳 05;. 海军军医大学药学院生药学教研室,上海 004;. 上海市疾病预防控制中心化学品毒性检定所,上海 006)
骨质疏松症(osteoporosis, OP)是以骨微细结构破坏和骨量减少为特征的全身性骨代谢疾病,可导致骨脆性和骨折风险增加,多见于老年人。衰老是致骨质疏松的一个重要因素,随着机体的衰老,骨骼中过多的活性氧(reactive oxygen species, ROS)抑制成骨细胞的增殖、分化和成熟,抑制成骨细胞分泌骨基质及骨基质的矿化,同时促进破骨细胞骨吸收,导致骨质疏松的发生。2018 年国家卫生健康委员会发布OP 流行病学调查结果显示,我国65岁以上人群OP 患病率达32.0%,其中,男性为10.7%,女性为51.6%[1]。四烯甲萘醌(menatetrenone, MK4)在临床上常单独或协同用于防治老年性骨质疏松症,疗效显著[2-3],是我国现版《原发性骨质疏松症诊疗指南》和《骨质疏松症中西医结合诊疗指南》的推荐药物[1-2]。药理研究发现,MK4能促进成骨增殖、分化和碱性磷酸酶(alkaline phosphatase, ALP)活性[3-4]。MK4能通过调节氧化应激相关基因和蛋白,在成骨细胞骨形成中发挥保护作用[5],且能阻止成骨细胞凋亡[6]。过氧化氢(H2O2)是ROS 在体内存在的主要形式,会穿透成骨细胞造成细胞损伤,本研究拟探讨MK4对H2O2刺激成骨细胞氧化损伤的保护作用和调控机制,阐明MK4抗老年性骨质疏松的作用机制。
1 材料
成骨细胞系MC3T3-El(中国科学院上海生命科学研究细胞资源中心);特级胎牛血清(FBS)、DMEM 高糖培养基、胰蛋白酶、双抗(青霉素和链霉素混合液)和PBS 缓冲液(pH=7.2)均购自美国GIBCO 公司;噻唑蓝(MTT)、MK4(Sigma 公司)。过氧化氢 (H2O2,比利时 Acros Organics 公司);丙二醛(MDA)试剂盒、谷胱甘肽(GSH)试剂盒、超氧化物歧化酶(SOD)试剂盒、JC-1 线粒体膜电势(MMP)试剂盒和活性氧(ROS)试剂盒均购自上海碧云天生物技术有限公司;BCA 蛋白检测试剂盒、Annexin V-FITC/PI 凋亡检测试剂盒、核酸提取试剂盒、反转录试剂盒和扩增试剂盒(均为Thermo Fisher 公司产品);叉头框蛋白 (FoxO1 和FoxO3)、β 细胞淋巴瘤/白血病基因 2(Bcl2)和凋亡基因(Bax)等引物购自生工生物工程(上海)股份有限公司。
2 方法
2.1 MTT 法检测成骨细胞活力
复苏MC3T3-El 小鼠成骨细胞系,置于5 ml含 10% FBS 的 DMEM 培养基中,放入 37 ℃、5%CO2培养箱。以2×104/ml 浓度的成骨细胞接种于96 孔培养板中培养 24 h 后,分别采用 0、10、20、50 和 100 μmol/L(n =10)的 H2O2处理,培养 4、12、24 h 后,采用碧云天MTT 试剂盒测定细胞活力。
以2×104/ml 浓度的成骨细胞接种于96 孔培养板中培养24 h 后,并按空白、氧化应激模型、药物剂量分组:①对照组,②选择合适浓度H2O2组,③H2O2+10 μmol/L MK4组,④H2O2+1 μmol/L MK4组,⑤H2O2+ 0.1 μmol/L MK4组。加入药物培养24 h,采用MTT 法检测细胞增殖活性。
2.2 成骨细胞 ALP 活性
以2×104/ml 浓度的成骨细胞接种于96 孔培养板中培养24 h,按照方法“2.1”项下设置各实验组,连续培养6 d,每3 d 换液1 次,采用硝基苯酚磷酸二钠法检测ALP 活性。给药6 d 后,弃培养液,PBS 洗 3 次,依次加入 100 μl 二乙醇胺(50 mmol/L),50 μl 的对硝基苯酚磷酸二钠(2.5 mmol/L),在 37 ℃孵育 30 min,再加入 50 μl 的 0.3 mol/L 氢氧化钠溶液终止反应,置405nm 处,测吸光度值(A)。以不同浓度的对硝基苯酚溶液绘制标准曲线,ALP 活性由每孔释放的对硝基苯酚的μmol 数表示。
2.3 成骨细胞骨结节面积
以5×104/ml 浓度的成骨细胞将MC3T3-El 细胞接种于 12 孔板内,放入 37 ℃,5% CO2培养箱,12 h 后换骨结节诱导培养基(0.1%牛血清白蛋白、10 nmol/L地塞米松、10 mmol/L β-甘油磷酸钠、50 μg/ml 抗坏血酸以及10%胎牛血清的DMEM 培养基)培养24 h,按照方法“2.1”项下设置各实验组,每3 d 换液1 次,连续培养14 d,采用0.1%茜素红-Tris-Hcl 染液(pH 8.3)染色,37 ℃下染色30 min,采用倒置相差显微镜 (Leica DMI 3000)观察,并随机拍照10 张,用image-Pro Plus (IPP 6.0)分析骨结节面积。
2.4 细胞线粒体膜电势、ROS 和氧化应激酶MDA、GSH、SOD 测定
以 2×105/ml 细胞浓度铺 6 孔板,培养 24 h 后,按照方法“2.1”项下设置各实验组,干预24 h 后,用荧光酶标仪法分别测定JC-1 单体和复合物的荧光,DCFH-DA 探针法测活性氧水平,ELISA 法测定 GSH、SOD 和 MDA 水平。
2.5 细胞凋亡检测
以 1×106/ml 细胞浓度铺 6 孔板,培养 12 h 后,按照方法“2.1”项下设置各实验组,干预24 h 后,依据Annexin V-FITC/PI 凋亡检测试剂盒说明书,采用流式细胞仪法检测。
2.6 RT-PCR
以 1×106/ml 细胞浓度铺 6 孔板,培养 12 h 后,按照方法“2.1”项下设置各实验组,干预24 h 后,依据试剂盒说明书进行提取总RNA 和反转录后,分别 对GAPDH 、SOD2、FoxO1、FoxO3、Bcl-2 和bax 进行 RT-PCR 扩增,引物序列见表 1,PCR 反应条件:采用预变性 95 ℃、10 min,变性 95 ℃、45 s,退火 60 ℃、45 s,延伸 72 ℃、50 s,循环 40 次,总反应体系为 10 μl。
2.7 统计学分析
每组实验重复3 次。采用SPSS 软件经ANOVA方差分析检验,差异有统计学意义(α=0.05),再采用Student's t test 检验进行两组比较,以P<0.05 为差异有统计学意义。

表1 小鼠引物序列
3 结果
3.1 H2O2 处理 MC3T3-El 成骨细胞
MC3T3-E1 经 0~100 μmol/L H2O2分别处理4、12、24 h,结果发现 0~100 μmol/L H2O2处理4 h 对细胞活力均无显著性影响(P>0.05),处理12 h 后,在 50 和 100 μmol/L H2O2下的细胞活力显著降低,分别降低19.4%和33.4%。H2O2干预24 h后,在 20、50、100 μmol/L 均具有显著性差异,分别降低13.2%,47.4%和57.9%(表2)。故后续实验选择 20 μmol/L处理 24 h。
3.2 MK4 对H2O2 损伤成骨细胞增殖、ALP 活性和骨结节形成的影响
MC3T3-E1 经 20 μmol/L H2O2处理 24 h 后,结果显示,显著抑制了成骨细胞的细胞活力(P<0.05),ALP 活性 (P<0.05) 和骨结节形成面积 (P<0.05),与空白组比较,分别降低13%、16%和85%,见表 3 和图 1。与模型组比较,MK4在 1~10 μmol/L可促进H2O2损伤成骨细胞增殖(P<0.05)。同样,MK4在 1~10 μmol/L 能显著改善 ALP 活性 (P<0.05)和提高骨结节形成面积(P<0.05),分别增加50.7%和 44.5% (表 3 和图 1)。
3.3 MK4 对H2O2 损伤成骨细胞线粒体膜电势、活性氧和抗氧化酶的影响
MC3T3-E1 成骨细胞 经 20 μmol/L H2O2处理24 h 后,结果发现显著降低成骨细胞膜电势和增高活性氧含量 (P<0.05)。与模型组比较,MK4在10 μmol/L 可促进H2O2损伤成骨细胞膜电势升高和降低活性氧含量(P<0.05)。与空白组比较,20 μmol/L H2O2能显著降低 FoxO1, FoxO3 和 SOD2的 mRNA 表达 (P<0.05)。与 H2O2组比较,给予10 μmol/L MK4后,FoxO1, FoxO3 和 SOD2的 mRNA表达均显著增高(P<0.01)。
3.4 MK4 对H2O2 损伤成骨细胞凋亡的影响
在通道1 和通道2 观察单个细胞分布区域,选定99.9%的细胞区域用于后续分析,在通道3 和通道4 观察凋亡细胞分布,Q4 为正常细胞,Q1 为坏死细胞;Q2 为晚期凋亡细胞,Q3 为早期凋亡细胞。与对照组比较,20 μmol/L H2O2处理 24 h 后,细胞的凋亡率显著增高(P<0.05)。经0.1~10 μmol/L 浓度 MK4干预 24 h 后发现,1~10 μmol/L浓度MK4能显著降低细胞凋亡率(P<0.05),与对照组相近,见表3 和图2。与空白组比较,20 μmol/L H2O2能显著降低 Bcl-2 的 mRNA 表达 (P<0.001),bax 表达无显著差异,给予 10 μmol/L MK4后,Bcl-2和bax 的mRNA 表达均显著增高(P<0.01),见图3。H2O2组的bax/Bcl-2 比值为对照组的22.5 倍,而MK4处理后降低至对照组的7.6 倍。
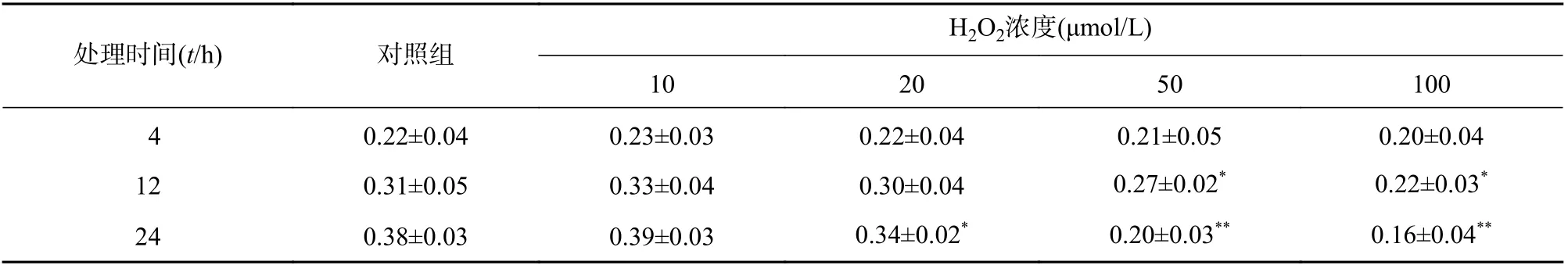
表2 H2O2 处理的时间与浓度对成骨细胞活力的影响

表3 MK4 对 H2O2 损伤成骨细胞的影响
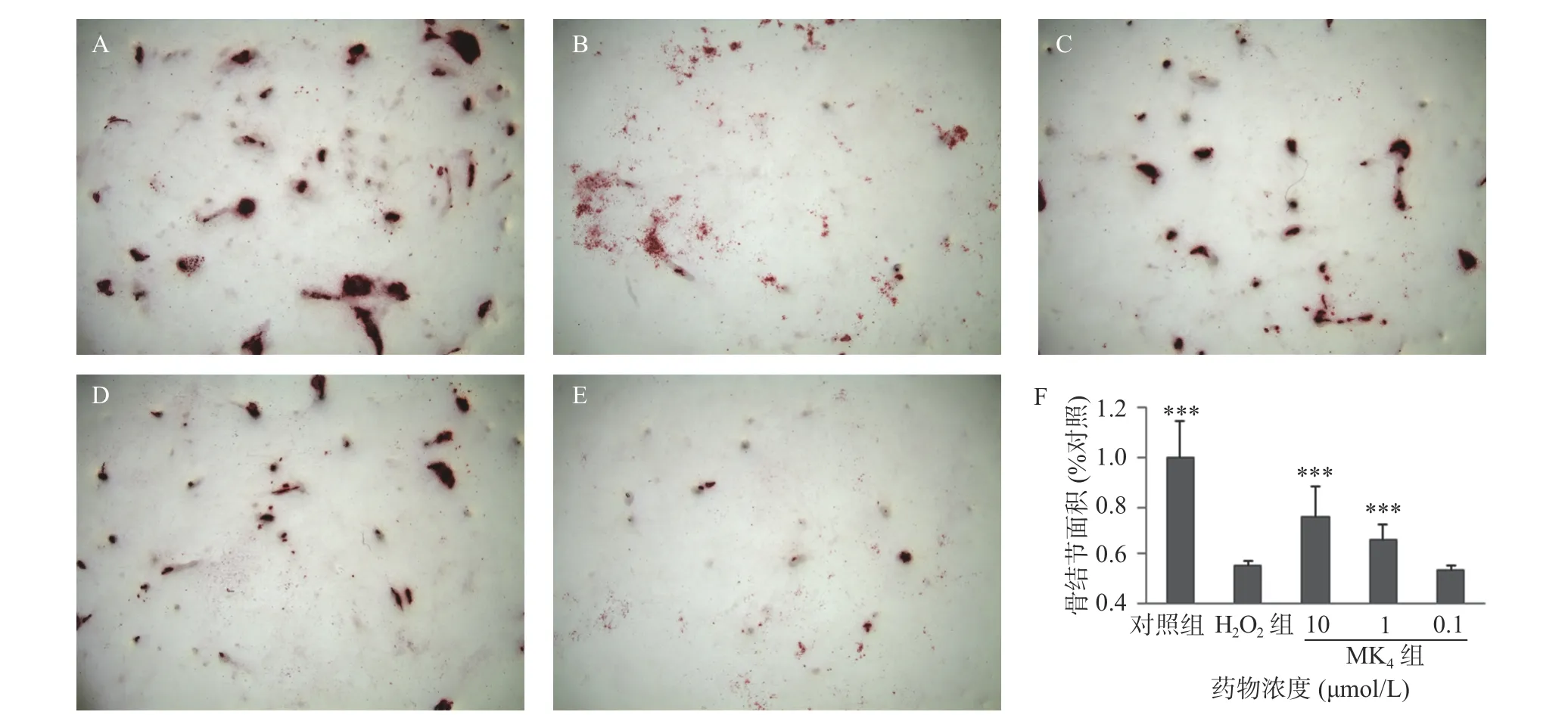
图1 MK4 对 H2O2 损伤成骨细胞骨结节的影响 (×200)
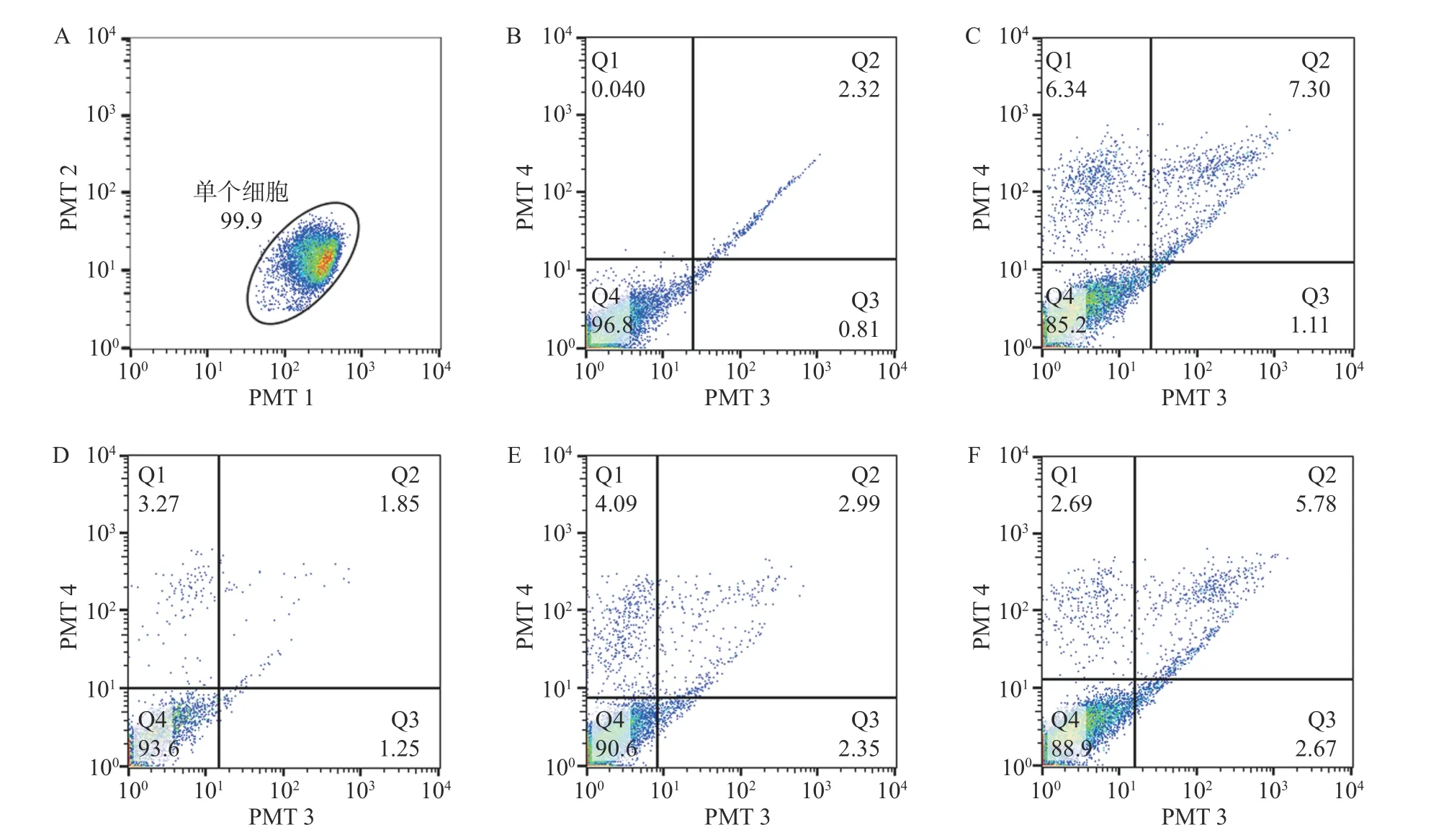
图2 MK4 对 H2O2 损伤成骨细胞凋亡的影响
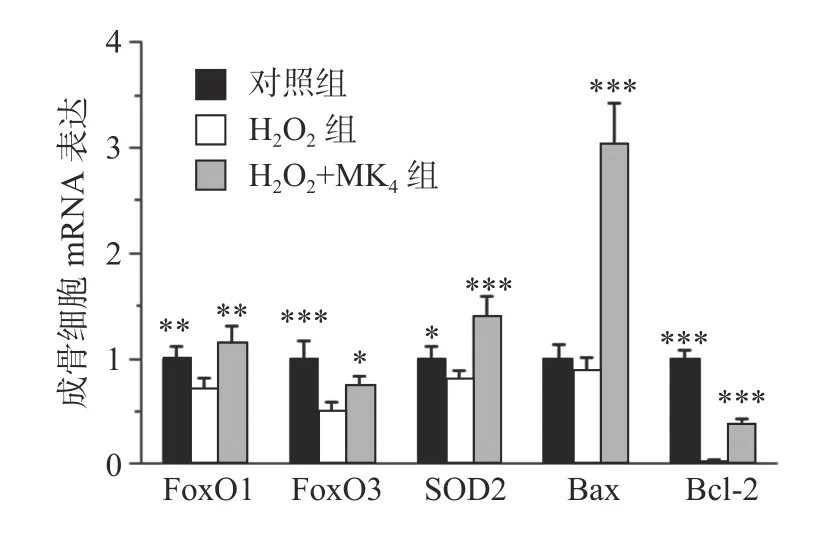
图3 MK4 对 H2O2 损伤成骨细胞氧化和凋亡相关mRNA 表达的影响
4 结论与讨论
骨代谢中,机体通过调节FoxOs 转录因子的活性,产生抗氧化物酶,对抗氧化应激对骨骼的损伤,包括 FoxO1、FoxO3、FoxO4 和 FoxO6 等,其中,FoxO1 和FoxO3 是调节成骨细胞氧化还原平衡和成骨功能的主要分子[7]。活性氧可激活FoxO1 的转录,调节线粒体抗氧化酶Mn-SOD 的活性[8]。随着活性氧的升高,FoxO3 下调,成骨细胞分化受损,抑制骨形成作用[9]。本研究发现,MK4对H2O2引起的氧化应激具有显著的改善作用,降低活性氧和脂质氧化产物MDA 水平,上调转录因子FoxO1、FoxO3 和抗氧化酶SOD 的mRNA 表达。
Bcl-2 蛋白可减少氧化应激水平,而bax 基因可与Bcl-2 形成异源二聚体,抑制Bcl-2 的作用,进而诱导细胞凋亡。MK4可上调Bcl-2/bax 比值,抑制了成骨细胞凋亡[10]。本研究发现,H2O2能显著提高成骨细胞凋亡率,同时增加bax 的表达,降低Bcl-2 蛋白表达。MK4处理组对成骨细胞凋亡的拮抗作用明显,随着剂量浓度增加而增加。MK4在在氧化应激状态下,可显著上调Bcl-2,下调bax 的基因表达,bax/Bcl-2 比值显著降低,抑制了成骨细胞凋亡。
FoxOs 激活促进Bcl-2 相关凋亡调节蛋白(Bim)转录,Bim 是线粒体凋亡通路的核心调控者,引起成骨细胞线粒体膜电位降低[10]。线粒体跨膜电位降低说明线粒体膜通透性转运孔(MPTP) 过度开放。若MPTP 过度开放,易引起呼吸链解偶联,线粒体基质渗透压增高,使得促凋亡活性物质从线粒体释放入细胞基质,导致细胞凋亡。MK4显著改善了H2O2刺激的成骨细胞线粒体膜电势降低,表明MK4对H2O2刺激成骨细胞的氧化损伤具有保护作用。
综上所述,MK4能显著抑制H2O2刺激的成骨细胞氧化损伤,机制与FoxO 转录因子相关。同时,MK4对H2O2引起的成骨细胞凋亡具有拮抗作用,其机制为上调Bcl-2 和下调bax 的基因表达。
