宏基因组来源的酯酶酶学性质及对邻苯二甲酸酯的降解*
2020-12-04刘艳艳刘孝龙赵萌范新炯
刘艳艳,刘孝龙,赵萌,范新炯,3
(1. 安徽医科大学基础医学院,安徽合肥230032;2. 中国科学技术大学化学与材料科学学院,安徽合肥230026;3. 中山大学生命科学学院,广东广州510275)
邻苯二甲酸酯(phthalates esters,PAEs)是塑料工业生产中的一种增塑剂和软化剂,用来提高塑料的弹性和柔韧性,因此被广泛应用于工业塑料产品和消费品中,如农药、润滑剂、橡胶、建筑材料、医疗器材、化妆品、餐具、儿童玩具等,其在塑料制品中的添加量高达20%~50%[1-2]。全球每年PAEs的使用量约1.8 亿t,而且这一数据可能会持续增长[3-5]。在塑料中,PAEs与塑料基质以非共价的形式结合,因此在塑料产品的生产、使用和废弃处理过程中,PAEs 很容易从塑料产品中释放出来进入环境[6]。PAEs 在我国水资源和土壤环境中检出率较高,长江、黄河和松花江等河流的多处水域受到PAEs 的污染,其浓度超出国家规定的饮用水标准限值[7]。大量研究表明,PAEs 的残留直接影响动植物的生长,同时在动植物体内蓄积,通过食物链转移到人体,危害人类的健康[5]。PAEs 作为一种环境内分泌干扰物,还可以通过消化、呼吸系统和皮肤等多种途径进入人体,在人体内蓄积,并对人体造成伤害[8]。多项研究表明,长期接触PAEs 可诱导胎儿死亡、癌症发生、肝脏功能和肾脏功能损伤[9]。也能够导致雄性生殖毒性,主要体现为促黄体生成素(LH)、睾酮、卵泡刺激素(FSH)等激素水平的改变,精子质量降低,严重的会导致睾丸癌[10-11]。产前接触PAEs 会影响母体甲状腺激素和性激素的分泌,同时其可能导致妊娠期高血压子痫及妊娠期糖尿病等疾病的发生、发展[12-15]。所以,有必要寻找消除PAEs污染物的有效途径。
生物降解是去除环境中PAEs 的主要途径,具有高效、低成本和环境安全等特点[16]。生物降解途径是通过酯酶逐步脱酯化反应,先生成相应的邻苯二甲酸单酯,然后生成邻苯二甲酸[17]。近些年通过基因组文库法、基因组或转录组测序及注释分析等方法克隆出了水解PAEs 的酯酶,但是数量并不多。来源于芽孢杆菌HJ14的酯酶EstZ1对邻苯二甲酸二乙酯(DEP)有降解作用[18];Sulfobacillus acidophilus DSM10332 中的PAEs 酯酶EstS1、来源于废水生物膜的宏基因组文库的酯酶DphB 以及克隆于Camelimonas sp. M11 的酯酶均不能水解毒性更大的邻苯二甲酸二甲酯(DMP)[19-21];来源于Picrophilus torridus 的PAEs 酯酶EstPt1 和Acinetobacter sp. LMB-5 的酯酶Est_3563 对邻苯二甲酸二丁酯(DBP)有降解作用[22-23];从土壤宏基因组文库中克隆FAEs 酶BDS4 能水解DMP、DEP、DBP,对邻苯二甲酸二丙酯(DPrP)以及其它中长侧链的PAEs 无降解作用[24];从Bacillus velezensis SYBC H47 中克隆的酯酶BaCEs04 能够水解DMP、DEP、DPrP、DBP,但是不能降解邻苯二甲酸二戊酯(DPP)、邻苯二甲酸二己酯(DnHP)[25]。上述酯酶能够水解邻苯二甲酸二烷基酯生成相应的单酯,但大多数酶对PAEs的降解谱较窄。来源于Acinetobacter sp. M673 的酯酶能够水解DMP、DEP、DPrP、DBP、DPP、DnHP 等多种PAEs 为相应的单酯,底物谱较广,最适pH 为7.5,但在碱性pH 中耐受性较差[26]。现阶段所筛选到的酯酶最适pH 多在7.5 ~8.0范围内,虽然酯酶EstZ1和酯酶EstPt1 最适pH 超过8.0,但是只能降解一种PAEs[18,23]。因此,筛选具有广谱PAEs 降解活性和良好环境适应性的酯酶具有重要意义。
本研究构建土壤宏基因组文库,利用功能筛选方法,从中克隆新的酯酶基因,并对其进行异源表达,研究其酶学性质,以期获得广谱PAEs 降解活性和良好环境适应性的新酯酶,为有效修复PAEs污染环境奠定基础。
1 材料与方法
1.1 材料
1.1.1 化学品和材料 对硝基苯酚酯均购自Sigma 公司(美国);T4DNA 连接酶、限制性核酸内切酶、DNA 聚合酶和低相对分子质量蛋白质标品购自TaKaRa(中国,大连)并根据制造商的推荐使用;E. Z. N. A®Plasmid Mini Kit 和E. Z. N. A®Gel Extraction Kit 购自OMEGA(美国);三丁酸甘油 酯、罗 丹 明B、PAEs (DMP、DEP、DPrP、DBP、DPP、DnHP)、氨苄青霉素钠(AMP)、异丙基-β-D-硫代半乳糖苷(IPTG)、硫酸卡那霉素(Kana)和5-溴- 4-氯- 3-吲哚-β-D-半乳糖苷(X-gal)购自Aladdin(中国,上海);蛋白纯化试剂盒(His·Bind®Purification Kit)购于Novagen 公司(德国);胰蛋白胨、酵母提取物购于OXOID 公司(英国);引物合成和基因测序由华大基因完成;除另有说明外,其它化学品和试剂均为分析级,并从商业来源购买。
1.1.2 培养基的制备
1)LB 培养基(g/L):胰蛋白胨10.0 g、酵母提取物5.0 g、NaCl 10.0 g,调pH 至7.0 并定容至1 L,121 ℃灭菌20 min。
2)LB 固体培养基(g/L):胰蛋白胨10.0 g、酵母提取物5.0 g、NaCl 10.0 g,加入w 为1.5%~2%的琼脂粉,调pH 至7.0,定容至1 L,121 ℃灭菌20 min。
3)酯酶筛选培养基:LB 固体培养基中加入100 μg/mL AMP(或100 μg/mL Kana)、0.1 mmol/L IPTG、0.1%(V/V)三丁酸甘油酯和0.1 mg/mL罗丹明B。
1.1.3 细菌菌株和质粒 使用Escherichia coli DH5α 和E. coli BL21(DE3)(本实验室保存)作为 分 子 克 隆 的 宿 主。 pUC118 (TaKaRa) 和pET-41a(+)(Novagen)分别用于构建宏基因组文库和基因表达。
1.1.4 实验仪器 Multiskan Go 全波长酶标仪(Thermo)、PCR 扩增仪(Bio-Rad)、恒温摇床(上海智诚生物有限公司)、隔水式电热恒温培养箱(上海一恒科学仪器有限公司)、电热恒温水槽(上海精宏实验设备有限公司)、移液器(Eppendorf)、蛋白电泳仪(北京六一生物科技有限公司)、核酸电泳仪(北京六一生物科技有限公司)、超声破碎仪(Sonics)、超净工作台(苏州净化设备有限公司)、立式压力蒸汽灭菌器(合肥华泰集团股份有限公司)。
1.2 方法
1.2.1 宏基因组文库的构建和筛选 按参考文献[27]的方法提取DNA,将提取的总DNA 用BamHⅠ不完全酶切,回收3~8 kb 大小的片段并连接到pUC118 载体中,然后将连接产物转入到宿主E.coli DH5α,将转化产物涂布到酯酶筛选培养基(含终质量浓度为100 μg/mL 的AMP)上,37 ℃培养过夜。含有酯酶基因的阳性克隆菌能够水解培养基中的三丁酸甘油酯,在菌落周围形成透明圈,罗丹明B可使透明圈清晰可见。因此,挑出具有明显透明圈的单克隆,进一步测试其对对硝基苯酚乙酸酯(p-NPC2)的水解能力,确定有活性的阳性克隆进行测序。利用NCBI 提供的ORF Finder 进行开放阅读框(open reading frame, ORF)搜索,利用NCBI 提供的BLAST 程序进行数据库同源搜索。用ClustalX 软件分析了氨基酸序列相关酶的保守基序。
1.2.2 酯酶基因的克隆、表达和纯化 通过PCR
从pUC118 重组质粒中扩增目的基因est924。在PCR 引物中引入BamHⅠ和HindⅢ限制性酶切位点,引物序列为:Forward:5′- TTATTGGATCCATGCCCAGCCAACAGCTCGC-3′(下划线部分为BamHⅠ酶切位点);Reverse:5′-ATCCAAGCTTCTAGCCGTGCTTGCGCACGAA- 3′(下划线部分为HindⅢ酶切位点)。 PCR 程序为:98 ℃,3 min;98 ℃,30 s ,63 ℃, 30 s,72 ℃,30 s,30 个循环;72 ℃,10 min。
将扩增产物以w=1%的琼脂糖凝胶电泳,利用E. Z. N. A®Gel Extraction Kit 回收目的片段。纯化后的目的片段经BamHⅠ和HindⅢ酶切后与经同种酶处理的pET-41a(+) 载体连接,并转入E. coli BL21(DE3)感受态细胞,涂布于酯酶筛选培养基(100 μg/mL Kana),37 ℃培养过夜。阳性克隆接种于LB液体培养基(含100 μg/mL Kana)中,37 ℃、190 r/min 条件下,恒温过夜培养。再以1/100 的接种量将活化的菌液转接到LB 液体培养基(含100 μg/mL Kana)中,37 ℃、200 r/min振荡培养2~3 h,当A600在0.5~0.6 时,加入终浓度为0.1 mmol/L 的IPTG 于30 ℃诱导表达8 h。收集菌体超声波破碎,12 000 r/min 离心5 min 获得粗酶液。用Ni-NTA 纯化目的蛋白,加入φ=50%甘油,-20 ℃保存备用。采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳法(SDS-PAGE)测定变性蛋白的相对分子质量,并用考马斯亮蓝染色以确定其相对分子质量的大小[28]。利用BCA蛋白定量测定纯化蛋白浓度。
1.2.3 底物特异性 依据Fan 等[27]研究方法,使用酯酶/脂肪酶的通用底物p-NPC2、对硝基苯酚丁酸酯(p-NPC4)、对硝基苯酚己酸酯(p-NPC6)、对硝基苯酚辛酸酯(p-NPC8)、对硝基苯酚葵酸酯(p-NPC10)、对硝基苯酚月桂酸酯(p-NPC12)、对硝基苯酚棕榈酯(p-NPC16)等研究Est924的底物特异性。以pH 7.0、100 mmol/L 的磷酸钾缓冲液配制100 mmol/L的底物工作液,用于检测Est924对不同碳链长度的底物的水解特性。底物与酶在55 ℃反应5 min 后,反应液在405 nm 波长下测定A值。最高酶活性计为100%,以相对酶活性对底物作图,以确定底物特异性。
1.2.4 最适温度 将适量的重组酯酶Est924 与100 mmol/L 的p-NPC4 为底物混合,分别置于20、30、40、50、55、60 和65 ℃的温度下孵育5 min后,在405 nm 波长下测定A 值,以确定最适温度。最高酶活性计为100%,以相对酶活性对温度作图。
1.2.5 最适pH 首先配制不同pH 的缓冲液,然后配制不同pH 的p-NPC4 工作液(pH 6.47~9.18)。将适量的重组酯酶Est924 与不同pH 的底物工作液在55 ℃下反应5 min 后,在405 nm 波长下测定A 值,以确定最适pH。最高酶活性计为100%,以相对酶活性对pH作图。
1.2.6 温度稳定性 将适量的酯酶在25、30、40、45、50 ℃等水浴中孵育,不同时间取样。以p-NPC4 为底物,55 ℃下反应5 min 后,反应液在405 nm波长下测定A值,测定其剩余酶活性。以未经热处理的初始酶活定义为100%,以相对酶活性对温度作图,以评估酶的热稳定性。
1.2.7 pH稳定性 通过浓缩菌体进行超声波破碎以减少缓冲液本身对pH 的影响。适量的重组酯酶Est924 在 不 同pH 的Na2HPO4-KH2PO4缓 冲 液 中,30 ℃水浴孵育,不同时间进行取样。以p-NPC4 为底物,55 ℃下反应5 min后,反应液在405 nm波长下测定A值,测定其剩余酶活性。以未经处理的酶活性定义为100%,以相对酶活性对pH作图,以确定其pH稳定性。
1.2.8 生化试剂对重组酯酶Est924 的影响 在酶液中加入终浓度为1 mmol/L金属离子(MgCl2、CaCl2、KCl、MnCl2、CoCl2、AlCl3、CrCl2、FeCl3、EDTA)和终浓度为1% (V/V)的有机溶剂(Tween-80、Triton X-100)。0 ℃放置24 h 后,以p-NPC4 为底物,55 ℃下反应5 min,反应液在405 nm 波长下测定A值,测定其剩余酶活性。以未经生化试剂处理的酶活性定义为100%。评估金属离子和有机溶剂对酶活性的影响。
1.2.9 重组酯酶Est924 对邻苯二甲酸酯的降解能力 根据Huang 等[29]方法,检测重组酯酶Est924对邻苯二甲酸酯的降解能力。反应体系1 mL,包括:1.6 μL 的PAEs (DMP、DEP、DPrP、DBP、DPP、DnHP)溶解于50 μL 二甲基亚砜(DMSO)、100 μL 粗 酶 液、848.4 μL pH 7.0 (10 mmol/L)Tris-HCl 缓冲液。以不加酶液为对照,在45 ℃反应3 h 后,用等体积的乙酸乙酯进行萃取。取适量萃取液点于硅胶板上,进行薄层层析(TLC)检测。展层剂为:石油醚∶乙酸乙酯∶冰乙酸(体积比为20∶1∶0.5)。展层结束后取出硅胶板,并在235 nm紫外灯下观察。
2 结 果
2.1 宏基因组文库的构建和筛选
从约12 000 个克隆子的土壤宏基因组文库中,筛选获得了一个在酯酶筛选培养基上产生水解透明圈的阳性菌。对测序结果分析,发现一个924 bp大小的酯酶基因,并命名为est924,序列见附加材料1。该基因编码由307个氨基酸残基构成的蛋白,此蛋白与已报道的来源于Synechococcus sp. CC9311的alpha/beta-水解酶具有最高同源性(62.42%),与来源于未培养微生物的酯酶(QCQ29100.1)具有49.51%的同源性。将Est924 与已报道的PAEs水解酶多序列比对分析,结果如图1所示,发现编码的蛋白中存在典型的催化三元组:位于保守基序G-X-S-X-G 中心的活性位点丝氨酸(S152)、保守的天冬氨酸(D253)和组氨酸(H279)。
2.2 酯酶基因的克隆、表达和纯化
以p-UC118 重组质粒为模板,经PCR 扩增得到一个大小924 bp 的基因片段,大小与预期一致。以pET-41a(+)为载体、E. coli BL21(DE3)为宿主菌构建重组菌。重组菌诱导表达后的蛋白利用Ni-NTA 分离纯化,SDS-PAGE 电泳检测纯化后蛋白,如图2所示,箭头指示目的蛋白,已去除绝大多数的杂蛋白。目的蛋白的相对分子质量为58 320,其中包含24 550的融合标签,与预测的蛋白相对分子质量相符。
2.3 重组酯酶Est924的酶学性质表征
2.3.1 底物特异性 选用酯酶/脂肪酶的通用底物研究Est924 的底物特异性,结果见图3。在所检测的对硝基苯酚酯中,重组酯酶Est924 对p-NPC4 的活性最高,p-NPC2、p-NPC6、p-NPC8 活性分别为p-NPC4 的50%、20%、14%,对p-NPC10、p-NPC12、p-NPC16几乎没有活性。说明酯酶的最适底物为p-NPC4,更适合降解短链至中链的对硝基苯酚酯。以p-NPC4 为底物时,该酶的Km和Vmax分别为77 μmol·L-1和6 μmol·L-1·min-1。
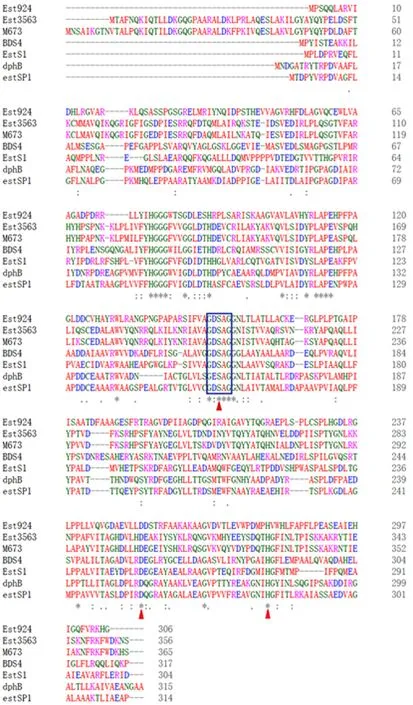
图1 Est924的多序列比对分析Fig.1 Multiple sequence alignment of Est924
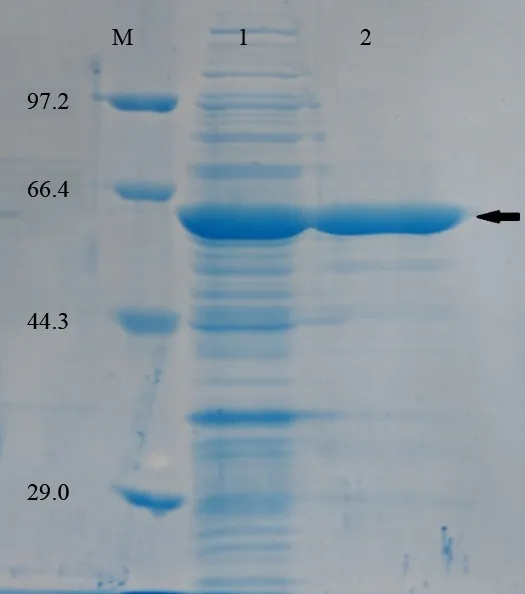
图2 重组蛋白Est924的SDS-PAGE鉴定Fig.2 SDS-PAGE electrophoresis of esterase protein
箭头所指出重组蛋白Est924;M:低相对分子质量标准蛋白(TaKaRa);1:纯化前的重组蛋白Est924; 2:纯化后的重组蛋白Est924
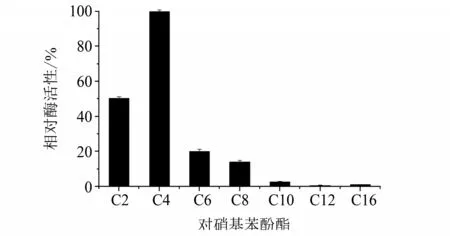
图3 重组蛋白Est924的底物特异性Fig.3 Substrate specificity of Est924
2.3.2 最适温度 在20、30、40、50、55、60、65 ℃下测定温度对酯酶Est924 活性的影响,结果见图4。随着温度的升高,酯酶活性逐渐升高,当温度超过55 ℃时,酯酶活性下降,说明其最适温度为55 ℃。在30~60 ℃温度范围内,相对酶活性均在60%以上,说明该酶具有很好的温度适应性。
2.3.3 最适反应pH 在pH 6.47 ~9.18 的范围内,以p-NPC4 为底物,测定酯酶的最适反应pH,结果见图5。重组酯酶Est924 在pH 8.34 时活性最高,在pH 7.38~9.18 的范围内,相对酶活在80%以上,表明该酶在中性至碱性条件下有很好的适应性。
2.3.4 温度稳定性 将酯酶Est924 在25、30、40、45、50 ℃分别保温不同的时间,以评估其热稳定性,结果见图6。重组酯酶Est924 在25 ℃和30 ℃处理24 h 后,保留80%以上的活性,说明酯酶在30 ℃以下十分稳定;在40 ℃孵育12 h 后仍保留约50%的酶活性。以上表明该酶在中低温条件下具有较好的热稳定性。但50 ℃时酶活性下降较明显,热处理2 h的剩余酶活性为20%。
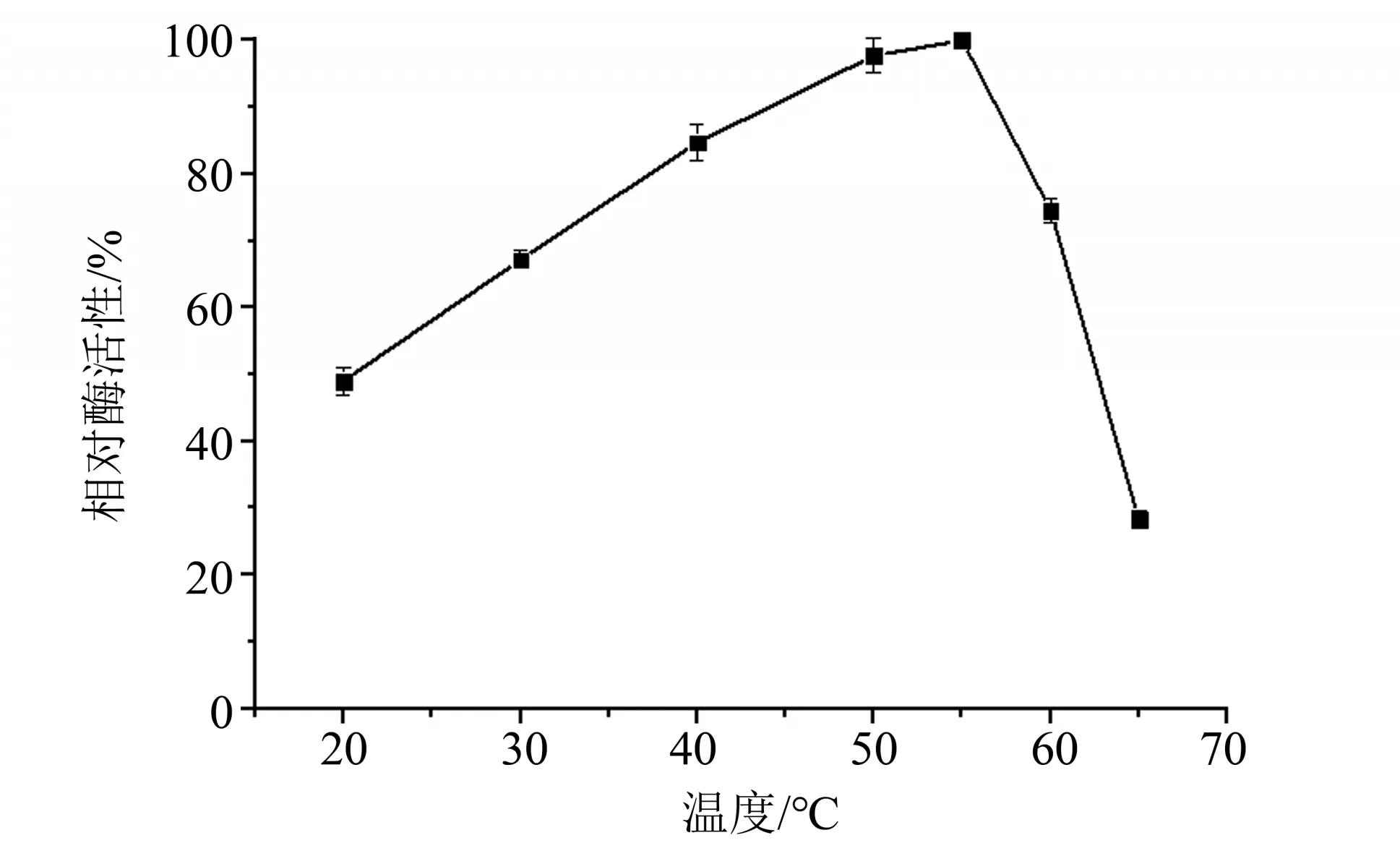
图4 温度对重组酯酶Est924活性的影响Fig.4 Effect of temperature on activity of Est924
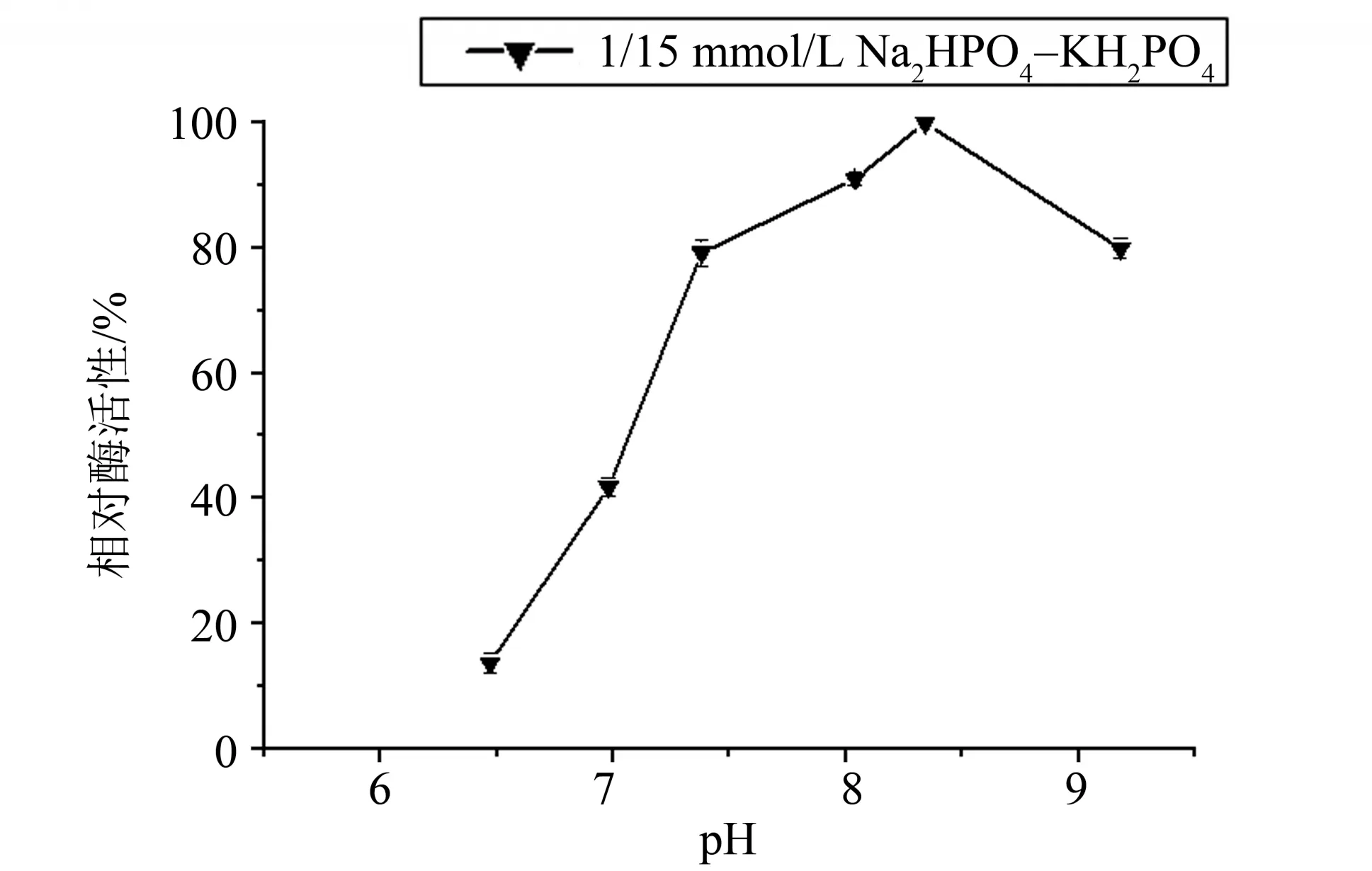
图5 pH对重组酯酶Est924活性的影响Fig.5 Effect of pH on activity of Est924
2.3.5 pH 稳定性 重组酯酶Est924 在不同pH(6.47~9.18)缓冲液中处理不同的时间后检测剩余酶活性,以此确定pH 对酯酶稳定性的影响,结果见图7。pH 6.47 时,孵育5 h 酯酶活性下降到50%左右;pH 6.98 时,12 h 酯酶活性下降至初始的70%左右;在pH 7.38~9.18 的范围内,24 h 仍保留70%以上的初始活性。说明此酶在碱性条件下具有良好的稳定性,能够很好的适应pH 的变化,是一种耐碱性酯酶。
2.3.6 生化试剂对重组酯酶Est924 的影响 酶促反应速率会受化学物质的影响。表1 的结果显示,多数金属离子对Est924 表现为不同程度的抑制作用,Mg2+、Ca2+、K+、Mn2+、Co2+、Al3+、Cr2+等的活性 分 别 为80.1%、 90.2%、 86.2%、 68.4%、31.3%、64.1%、78.2%。Fe3+以及表面活性剂Tween-80和Triton X-100等对Est924有不同程度的激活作用,酶活性分别为127.2%、107.1% 和140.0%。金属螯合剂EDTA 对酯酶Est924 表现为激活作用,说明酯酶Est924 是非金属酶,其催化活性不依懒于金属离子。

图6 温度对重组酯酶Est924稳定性的影响Fig.6 Effect of temperature on stability of Est924
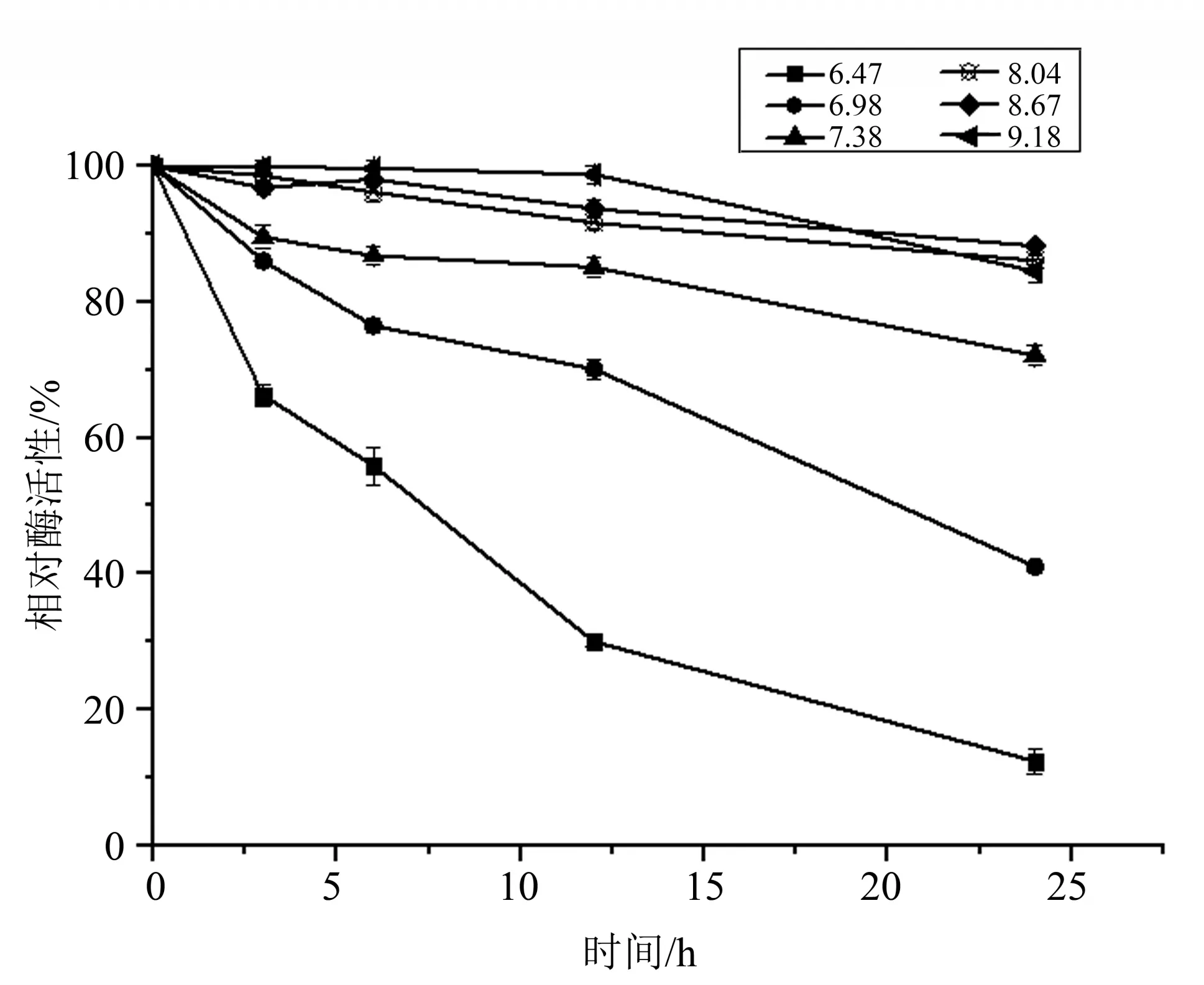
图7 pH对重组酯酶Est924稳定性的影响Fig.7 Effect of pH on stability of Est924
2.4 重组酯酶Est924对邻苯二甲酸酯的降解能力
以DMP、DEP、DPrP、DBP、DPP、DnHP 为底物来研究酯酶对PAEs降解作用,TLC结果如图8所示。图中对照组条带为PAEs,条带的明暗代表着PAEs 量的多少。实验组5、7、9 中PAEs 条带已基本消失,DPrP、DBP 和DPP 基本被降解完全;实验组1 和3 中PAEs 条带明显变淡。以上结果表明重组酯酶Est924 对DMP、DEP、DPrP、DBP 和DPP 具有很好的降解能力。实验组11 中PAEs 条带与对照组12 相比变淡,但还比较明显,说明该酶对DnHP 的降解能力较弱。仔细观察实验组发现,在1、3、5、7、9 的PAEs 条带下方、点样点上方位置,有新条带产生,而在对照组中没有。推测,新条带是PAEs 经水解后产生的单酯,重组酯酶Est924对邻苯二甲酸酯的降解作用是通过逐步脱酯化反应实现的。
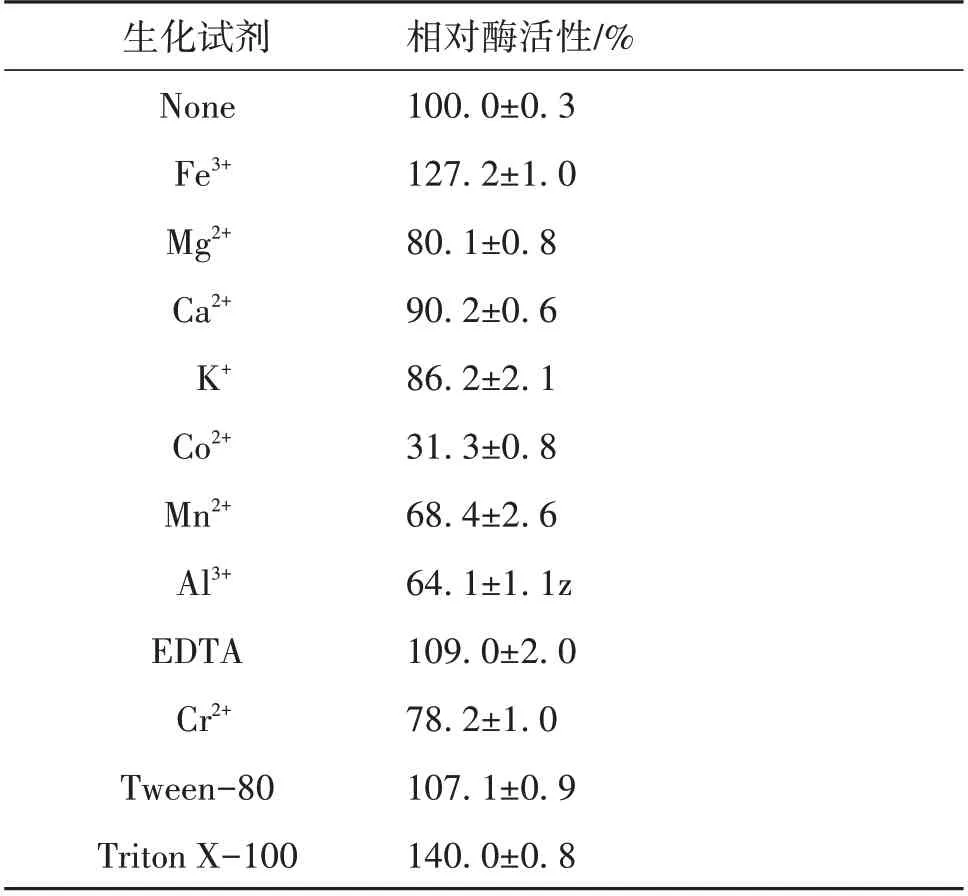
表1 生化试剂对酯酶Est924 活性的影响Table 1 Effect of the various chemical reagents on activity of Est924
3 讨 论
邻苯二甲酸酯是一类全球性的重要环境污染物。其中,短链烷基酯(C1~C4)的溶解度比长链同系物高,毒性更大[30]。美国环保局(EPA)将邻苯二甲酸二(2-乙基己基)酯(DEHP)、邻苯二甲酸正二辛酯(DOP)、邻苯二甲酸丁基苄基酯(BBP)、DBP、DEP、DMP 等6 种PAEs 列为优先控制的有毒污染物,中国环境监测总站将DEP、DMP 和DOP 等3 种PAEs 列为优先控制污染物[31]。因此,找到广谱高效降解PAEs 且具有良好环境适应性的降解酶尤为重要。
本研究利用宏基因组技术从土壤中挖掘出新酯酶Est924,并研究了其酶学性质以及对环境污染物PAEs 的生物降解。通过对Est924 进行序列分析,推测活性位点与丝氨酸、天冬氨酸和组氨酸形成的催化三联体有关,同时在活性丝氨酸位点周围含有典型的保守五肽结构G-X-S-X-G,这说明Est924 属于酯酶家族。底物特异性结果显示,重组酯酶Est924 对p-NPC4 的活性最高,对p-NPC2 的活性为50%,对p-NPC6 和ρ-NPC8 活性非常低,而当碳链长度大于10 时几乎没有活性,这与酯酶作用底物的碳链长度小于10 具有一致性[32]。重组酯酶Est924 的最适温度为55 ℃,在30~60 ℃温度范围内,相对酶活性均在60%以上;该酶在25 ℃和30 ℃处理24 h 后,保留80%以上的活性,在40 ℃孵育12 h后仍保留约50%的酶活性。这表明该酶具有很好的温度适应性和较好的热稳定性。重组酯酶Est924在pH 8.34时活性最高,在pH 7.38~9.18 的范围内,相对酶活在80%以上;在pH 7.38~9.18 的环境下处理24 h,仍保留70%以上的酶活性。这表明该酶是一个耐碱酶,且在中性至碱性条件下有很好的适应性。研究重组酯酶Est924 对PAEs 的降解能力发现,该酶对DMP、DEP、DPrP、DBP 和DPP 均具有很好的降解能力。以上研究数据证明,重组酯酶Est924 是一个具有良好稳定性和环境适应性的耐碱酯酶,且对PAEs的降解具有广谱的底物特异性。

图8 TLC分析Est924对邻苯二甲酸酯的降解能力Fig.8 PAEs degradation ability analysis of Est924 by TLC
目前,也有降解PAEs 碱性酯酶的报道,它们与Est924 有着32%以上的同源性,基本的酶学性质有一些相似之处。其中EstZ1 在pH 7.0~9.5 的范围内维持50%以上的活性,对DEP 有降解作用,对其它PAEs 无水解作用[18];EstPt1 是一个耐热碱性酯酶,最适温度高达85 ℃,有着良好的热稳定性,但只有水解DBP 的数据[23];酯酶EstSP1 的最适pH(9.0)高于酯酶Est924,能很好的耐受有机溶剂(甲醇和DMSO),最适温度为40 ℃,在25 ℃下处理2 h,酶活性下降为初始的37%,稳定性较差[33]。近些年,克隆的能降解PAEs 的酯酶/脂肪酶数量还不多。来源于Nocardia erythropolis 的脂肪酶,其最适pH 为8.6,在pH 7.0~8.0 范围稳定,能分解大多数PAEs,底物谱较广,但其氨基酸序列未报道[34]。DphB 是一种冷适应酶,最适温度为10 ℃,能催化DPrP、DBP、DPP 的水解[20]。克隆于Camelimonas sp. M11 的酯酶是一种金属酶,不能水解DMP,当pH 大于8.0 时该酶几乎没有活性[19]。BDS4 是一个对PAEs 和阿魏酸酯均具有降解 作 用 的 酯 酶,能 水 解3 种 短 链PAEs[24];BaCEs04 最适温度为60 ℃,高于酯酶Est924,在pH 5.5~8.0 范围内稳定,只能水解PAEs(C1 ~C4) 到 相 应 的 单 酯[25]。来 源 于Acinetobacter sp.M673的酯酶[26]与Est924底物谱类似,该酶最适反应pH 为7.5,当pH 值超过6.0 和9.0 时,酶活性急剧下降。酯酶GoEst15 具有广谱的底物特异性,能够水解几乎所有的PAEs,在pH 7.5~8.0 条件下处理不到2 h,几乎失活,在40 ℃活性迅速下降[29],其pH和温度稳定性有待提高。
值得注意的是,现阶段所报道的酯酶多水解PAEs 的一个酯键,生成单酯;仅有个别酶能水解两个酯键,如GoEst15 能将PAEs 水解为相应的单酯,与GoEstM1 共表达后将单酯水解为邻苯二甲酸[29];从Bacillus sp. K91 基因组克隆了一个酯酶基因CarEW 能水解邻苯二甲酸二异丁酯(DIBP)的两个酯键生成邻苯二甲酸[35]。本文Est924 具有良好的酶学性质,但其对PAEs 的降解机制需要继续深入研究。后续我们将利用突变技术对Est924定向改造,获得更优良的突变酶,同时阐述其对PAEs 的降解机理,从而获得更好的应用前景和理论研究基础。
