基于药效团模型的药物设计与筛选
2020-12-02刘景陶
刘景陶
摘 要:随着计算机辅助药物设计技术的发展,通过人工智能机器深度学习功能,进行药效基团模型模建虚拟受体图形,并作3D构效分析、推测受体的空间形象、挑选药物活性、计算配体与受体结合能量,从而发现新药。基于药效团模型的药物设计与筛选已成为现代药物研发的重要方法和主要策略。
关键词:药物设计;药效团;筛选
中图分类号:R91 文献标志码:A 文章编号:2095-2945(2020)34-0069-03
Abstract: With the development of computer-aided drug design technology, the pharmacophase model is used to model the virtual receptor graph through the deep learning function of artificial intelligence machine, and 3D structure-activity analysis is performed to predict the spatial image of the receptor, select drug activity, and calculate the binding energy of ligand and receptor, so as to find new drugs. Drug design and screening based on pharmacophore model has become an important method and main strategy in modern drug development.
Keywords: drug design; pharmacophore; screening
1 計算机辅助药物设计方法学
随着计算机技术与药物设计学科的融合,利用计算机的模拟技术和图形技术进行药物分子筛选成为一门崭新的学科。计算机辅助药物设计通过对配体和受体间相互作用的原理的研究。是基于各种分子模拟技术及各种数理统计方法,在缺乏受体结构的情况下,可以进行基于配体小分子的虚拟筛选。即间接法,从一系列分子中寻找出受体活性位点,再以此设计新的配体。
现代药物研发工作中,基于结构的分子设计已成为临床前药物开发有效策略的标志。随着对蛋白结构和功能的认识越来越深入,以及基因组学推进了基于结构设计新药的进步,并为该策略应用于新疗法的药物开发提供了巨大的保障。人类基因组测序结果表明有20000~25000个人类蛋白编码基因,每个基因可以为一种蛋白质编码,这些蛋白负责实现人体内所有的细胞功能。同时这些蛋白也可以参与病理过程。为了充分利用新靶点和结构信息,需要深入了解酶的功能、理解分子设计的基本原理、并明确基于结构设计药物活性分子时可能面临的障碍,因而为基于结构的新药设计和新药研发提供独特的机会和挑战。基于结构设计的方法彻底改变了药物化学实践过程和临床前药物研发过程。
2 通过间接法进行药物设计
相似的化学结构可能产生相似的生物活性,这就是配体相似性原则,在配体相似性原则指导下,将化学结构相似的一对生物靶标的活性作系统的相关性分析,采用“全局”或“局部”的分子观点,揭示并预测化学结构与药理活性的关系。化学结构决定着药理作用和成药性, 杂泛性关系到药效、药代和安全性等内容,利用靶标的三维结构或根据药物分子的结构的相似性或药效团总结出的规律或模型,可对药物分子的杂泛性进行预测。
基于结构的设计,在许多首创药物发现和开发中的成功应用,产生了药物发现和开发中的新概念和新工具。高强度同步源的X射线的出现,可以提供许多蛋白质-复合物的高分辨率X射线晶体结构。实现从分子层面考察和靶点的相互作用,从而指导早期先导化合物的结构优化。通过这些三维相互作用和生物活性信息,决定下一步分子设计和结构优化工作。
药物发现过程,需要进行分子修饰,以提高结构活性和选择性或改善理化参数和药代动力学特征。基于结构的设计方法可减少分子迭代,降低成本,加快候选药物的发现过程。
结构相似,作用类型相同,活性不同的一系列药物分子,具有相同的结构基团,它们都能与同一蛋白质的活性位点作用。因此,可以在同一簇药物分子的结构基础上,发现共同的药效团,这属于一种间接的药物设计方法。间接药物设计主要包括基于配体的药效团模型,基于配体相似性的筛选及3D-QSAR等方法。
到目前为止,大部分靶点结构并不清楚,有些只获知靶点蛋白的一级结构是很有限的,通过分子叠合与相似性工具可以实现优化分子叠合并使得分子三维相似性最大化。受体对配体分子的识别是通过三维分子表面互补实现。用表面的分子结构相似,使得叠合结构的分子体积最小,生成一套配体小分子的三维活性构象的结构并进行分子叠合,这就是基于三维药物小分子结构的间接设计以及虚拟筛选。
基于药物小分子的结构设计是在蛋白质靶点的三维结构没有探明的情况下,在一簇结构相似药物小分子的基础上,通过药物的结构和活性之间的关系进行设计,即通过构象研究推测配体分子共同的药效基团模型用于模建虚拟受体图形,并作3D构效分析,推测受体的空间形象。包括基于药效团的方法和配体相似性的整合方法。
间接药物设计把已认知的配体分子的结构作为设计模板,对一系列具有作用机制相同的药物分子,分析其内部的结构,提示同类配体分子的反应位置和三维特征,虚拟出药效基团模型,并构建出受体的模拟构型,然后通过模拟构型进行虚拟筛选,得到先导化合物;对所得到的先导化合物经过若干次设计和反复优化,最后把活性最强的先导化合物作为候选药物,从而完成虚拟筛选。
3 基于药效团模型的药物设计
3.1 基于配体的药效团模型
药效团模型是指药物活性分子中对活性起着重要作用下“药效特征元素”及其空间排列形式。药效团并不是代表某个分子或某个具体官能团,而是代表一类化合物与同一受体共有的相互作用,可以认为是大量活性化合物的共同成药或活性特征。药效团是由药效特征元素组成的。这些“药效特征元素”是配体与受体发生相互作用时的活性位点,既可能是原子或原子团,也可能是某些化学特定结构,如氢键给体、氢键受体、疏水基团、正电子和负电离子及芳环中心等组成。氢键供体主要是指能够提供氢的基团,也包括一些较弱氢键供体,如巯基(-SH)等。疏水中心是指和不带电原子或电负性中心相连的一组连续的碳原子或基团,如-CH3、-C2H5及-Phenyl等。正电中心或负电中心是指能与受体形成盐桥或较强的静电相互作用,带有电荷的原子或基团。常用的正电中心如-NH3+,负电中心由-COO-等基团组成。
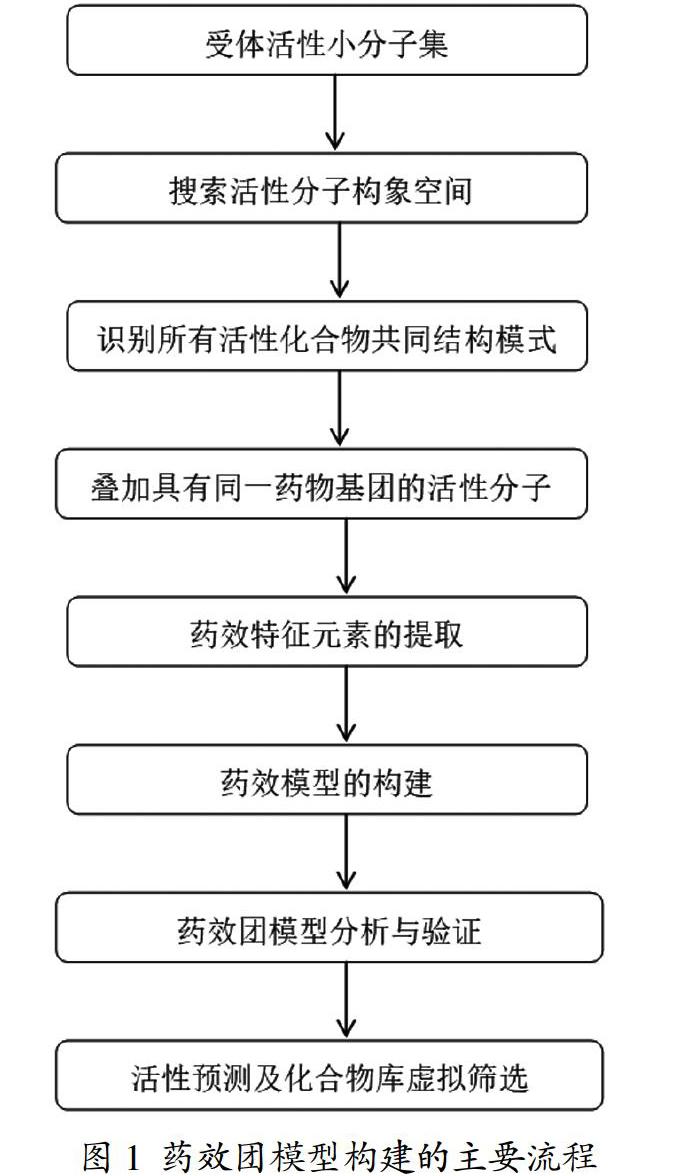
药物分子可以看作是由骨架与药效团组合而成,一个药效团是与一个化合物的一定生物活性有关的图像集合,药效团是对已认知的活性分子结构本质的剖析,是对现实药物分子的进一步解析,得到基于药物小分子的药效团模型需要有一系列作用于同一受体结合位点,具有相同作用分理的活性化合物,由这些活性物质的可靠数据和结构特征预测配体分子与蛋白质结合时的重要基团或性质功能特征,以及这些基团和功能特征之间的空间排列。药效团构建这一过程也称作药效团映射。建好藥效团模型后,可利用药效团搜寻已知小分子化学品数据库寻找新骨架活性分子,及定性或定量地解释化合物构效关系(QSAR),阐明化合物的选择性机理。由于药效团模型中包含了配体和受体靶点结合的三维结构数据,因此不仅能优化结构,还能预测出更多新的先导化合物。
药效团的识别有分子叠合和活性类似法。系列分子叠合要求与靶点作用机制相同。活性强度大刚性较大,结构差别较大即多样性较丰富,可获得更可信的模型。每个分子都作构象分析,然后对各分子的低能构象进行叠合。活性类似法从一组不同结构和生物活性的配体的低能构象中抽取出关键的特征,进行各配体构象的重叠,使每个分子尽可能处于低能构象,关键特征尽可能重叠在一起,经过反复叠合,找到最好的重叠构象。
3.2 基于配体的药效团模型构建步骤
G蛋白偶联受体(GPCR)拥有1000多个成员,参与许多重要的生理和病理过程,是全人类基因组中最大的膜蛋白簇系。它们受体的共同点是立体结构中都七个跨膜α-螺旋。通过表征一系列不同的G蛋白,发现其具有不同的氨基酸序列,可以与不同的受体结合,还可以激活或拮抗不同效应器。效应器是可以产生笫二信使的酶或离子通道。基于已知的GPCR高分辨率结构,建立更可靠的GPCR蛋白模型-同源模建结构,并将这些模型用于靶向GPCR的药物研发。这就是基于配体药效团模型构建的过程,随着以X射线晶体结构为基础设计的GPCR新型配体的发展,基于结构的药物研发的策略已成为重要的药物设计途径。
3.3 基于配体的药效团模型的应用
2000年,视紫红质素的X射线晶体结构的发现,建立了许多GPCR蛋白模型,并成功地把这些模型应用于靶向GPCR的研发。2007年,药物成功设计了β2肾上腺素能受体反向激动剂和激动剂-受体复合物X射线晶体结构,接着,β1肾上腺素能受体、β2肾上腺素能受体、腺苷A2A受体多巴胺D3受体和CCR5受体等许多GPCR结构相继得到确定,成为基于结构的GPCR药物设计的成功案例。
4 基于配体的药效团模型的虚拟筛选
虚拟筛选是基于药物设计理论,借助计算机技术发展起来的一种新型药物筛选方法,是利用专业计算机软件模拟化合物与医用靶点的结合,通过预测结合能力从化合物数据库中高效挑选苗头化合物。对于三维结构已知的受体,可以分析受体结合位点的医用方式和空间特征,建立起基于受体的三维药效团,根据结构和空间互补的原则,能推断得到配体的结构形状。也可以根据已知的复合物的立体结构,直接分析观察药效团。对于三维结构没有认知的蛋白质,可通过同源模建,构建分子模型,根据一系列活性药物分子的结构数据,进行结构-活性关系研究,从中总结出一些对活性至关重要的原子和基团及其空间关系,模建出三维(3D)药效团模型进行虚拟筛选。
常用的基于配体的虚拟筛选策略有基于配体药效团模型法及基于分子相似性虚拟筛选等。基于药效团模型的虚拟筛选是计算机辅助药物设计中一种常见方案,该方法利用配体的部分结构特征,通过构建药效团模型搜索化合物数据库,对具有相同作用机制的化合物进行定量构效关系研究。
基于药物药效团模型的三维结构搜寻方法,即药效团搜寻,是以药效团模型为搜寻目标,搜寻药物小分子三维结构数据库,得到新结构药物分子。
基于配体相似性的分子搜寻方法主要是二维结构搜寻。二维结构搜寻包括二维子结构搜寻和二维相似性搜寻。二维子结构搜寻即子结构匹配,是在数据库中找出具有与提问结构相同子结构的化合物分子。二维相似性搜寻与提问结构某些特征相似的化合物分子,能命中包括生物电子等排体在内的拓扑特征和电性相似性分子。
5 结论
基于药效团模型的药物设计与筛选是进行药物研发的重要手段,其本质是利用分子相似性原理。虚拟筛选进行活性收集,主要以相似性搜索和机器学习方法进行收集,这些方法代表了具有一定精确度的预测。以一个先导化合物结构作为起点,衍生出一个系列,一个先导化合物系列是一个先导化合物结构的类似物所组成的化合物库,先导化合物系列可以用来建立一个局部的构效关系,从而进行基于药效团模型的药物设计与筛选。
参考文献:
[1]Gisbert Schneider.药物分子设计[M].华东理工大学出版社,2012.
[2]朱瑞新.计算机辅助药物设计[M].大连理工大学出版社,2011.
[3]仇缀百.药物设计学[M].2版.高等教育出版社,2008.
[4]高祖新.医药数理统计方法[M].4版.人民卫生出版社,2007.
[5]魏冬青.分子模拟与计算机辅助药物设计[M].上海交通大学出版社,2012.
[6]吴梧桐.生物化学[M].6版.人民卫生出版社,2007.
[7]Arun Ghosh Sandra Gemma.基于结构药物及其他生物活性分子设计[M].科学出版社,2017.
[8]郭宗儒.药物设计策略[M].科学出版社,2017.
[9]段为钢.现代药物活性筛选[M].科学出版社,2017.
[10]叶德泳.计算机辅助药物设计导论[M].化学工业出版社,2004.
