新型苯并异喹啉类衍生物的设计、合成及抗辐射活性
2020-12-01黄林峰李铭东胡文祥李庶心陈梦雅2
杨 洋, 黄林峰, 梁 妍, 李铭东*, 吴 诗, 胡文祥, 李庶心, 陈梦雅2,
(1. 广东药科大学 药学院,广东 广州 510006; 2. 军事科学院 军事医学研究院辐射医学研究所,北京 100850;3. 江西中医药大学 药学院,江西 南昌 330006; 4. 湖北科技学院 药学院,湖北 咸宁 437100; 5. 北京神剑天军医学科学院 京东祥鹄微波化学联合实验室,北京 101601)
近年来,辐射对人体危害愈发严重[1],辐射损伤细胞、组织、器官,从而诱发多种疾病,如:白血病、肿瘤、早衰等[2],辐射已成为当今危害人类健康的致病源之一。近年来,各国研究的新型抗辐射药物包括:PrC-210、 Ex-RAD、 5-AED等,PrC-210是一种氨基硫醇类化合物,用于预防放射性皮炎[3-5];Ex-RAD是一种氯苄基砜衍生物,用于保护60Coγ辐射[6-7];5-AED是一种肾上腺皮质类固醇激素,用于治疗ARS[8-9]。但临床研究表明现有抗辐射药物仍存在诸多缺点,如稳定性差、毒副作用大、疗效低等。现有研究通过基因敲除实验证明,溶血磷脂酸2(G protein-coupled lysophos-phatidic acid 2,LPA2)受体是与辐射敏感性相关的靶标,是保护辐射损伤的重要基础[10-12],是抗辐射研究的理想靶标。DBIBB(2-((((4-(1,3-二氧代-1H-苯并[异]异喹啉-2(3H)-基)丁基)氨基)磺酰基)-苯甲酸)是LPA2受体的特异性激动剂[13-15],它能抑制除LPAR2外的其他LPA受体且其缺乏LPAR3拮抗作用,在LPAR2的DBIBB药理学表征显示具有纳摩尔效力[半抑制浓度(half maximal inhibitory concentration, IC50~100nmol/L),比GRI977143增加33倍][15],是第一个能够降低由造血和胃肠道急性放射综合征引起死亡的小分子候选药物[16]。
根据DBIBB在 LPA2受体的药效团中模型的结构特点[15-16],以其为先导化合物进行结构优化与改造(Chart 1):(1)头部保留芳酸或在羧酸间位引入氟、氯和溴等卤族元素,以增强芳酸的酸性或将头部芳酸替换为链状羧酸以增强与相应残基的结合;(2)连接基团替换为酰胺或保留磺酰氨,以保留连接基团原有的氢键结合位点;(3)连接部保留四碳链状基团或以疏水芳环替换,促进化合物的刚性来增强其选择特异性;(4)尾部保留1,8-萘二甲酰亚胺或以(E)-4-(丙-1-烯-1-基)苯酚替换,保留尾部的芳香性、疏水性和π-π相互作用,增加化合物的作用效力;合成了14个新型苯并异喹啉类衍生物,其结构经1H NMR和HR-MS(ESI)表征,并评价了了化合物对HUVEC细胞在辐射照射后的增殖活性的作用。
1 实验部分
1.1 仪器与试剂
RY-1型熔点仪;JNM-ECA-400 MHz型核磁共振仪(DMSO-d6为溶剂,TMS为内标);Agilent 1100型四级杆液相色谱质谱联用仪。
9实验室自制[17-19];人脐静脉内皮细胞,药理课题组馈赠;其余所用试剂均为分析纯。
1.2 合成
(1)2和5的合成(以5为例)
将4-(氯甲基)苯甲酸10.0 g(73.26 mmol)加入到100 mL单口瓶中,二氯甲烷为溶剂,加入2 eq.的氯化亚砜并以N,N-二甲基甲酰胺作催化剂室温搅拌0.5 h,蒸干体系后加入少量二氯甲烷,溶清后蒸干(重复此操作3次)得淡黄色油状液体10.9 g,收率98.3%,直接用于下一步。
用类似方法合成2,得油状液体10.8 g,收率95.0%。
(2)3、6a~6d和7的合成(以3为例)
氮气保护下,将3-氨基丙酸乙酯2.0 g(13.25 mmol),二氯甲烷(10 mL)加入到50 mL三口烧瓶中搅拌,冰盐浴下,缓慢滴加5-氯戊酰氯2.5 g(16.13 mmol)和三乙胺3.3 g(32.67 mmol)的二氯甲烷溶液(10 mL),滴毕,室温反应2 h。冰水淬灭反应,分液,水层用二氯甲烷(3×20 mL)萃取,合并有机相,依次用水(3×20 mL)洗涤,无水硫酸钠干燥,过滤,减压浓缩后经硅胶柱层析 [洗脱剂:V(石油醚)/V(乙酸乙酯)=2/1] 纯化得淡黄色油状液体33.1 g,收率87.2%, m. p. 51~53 ℃。
用类似方法合成6a: 白色固体0.5 g,收率82.9%, m. p.158~160 ℃;6b: 白色固体0.5 g,收率92.9%, m. p.127 ~129 ℃;6c: 白色固体0.5 g,收率89.1%, m. p.71~73 ℃;6d: 白色固体0.5 g,收率94.0%, m. p.173~175 ℃;7: 白色固体0.6 g,收率85.4%, m. p.78~80 ℃。
(3)8的合成
在氮气保护下,将2-[4-(氯甲基)苄基]-1H-苯并[异]异喹啉-1,3(2H)-二酮3.0 g(15.23 mmol),1,4-双(氯甲基)苯3.1 g(18.25 mmol),碳酸钾5.3 g(8.41 mmol)和N,N-二甲基甲酰胺(20 ml)依次加入到100 mL三口烧瓶中搅拌,70 ℃反应5 h。加入到30 mL冰水中,产生大量固体,抽滤,滤饼用水洗涤至中性,晾干得灰白色固体3.9 g,收率88.8%, m. p.191~193 ℃。

Chart 1
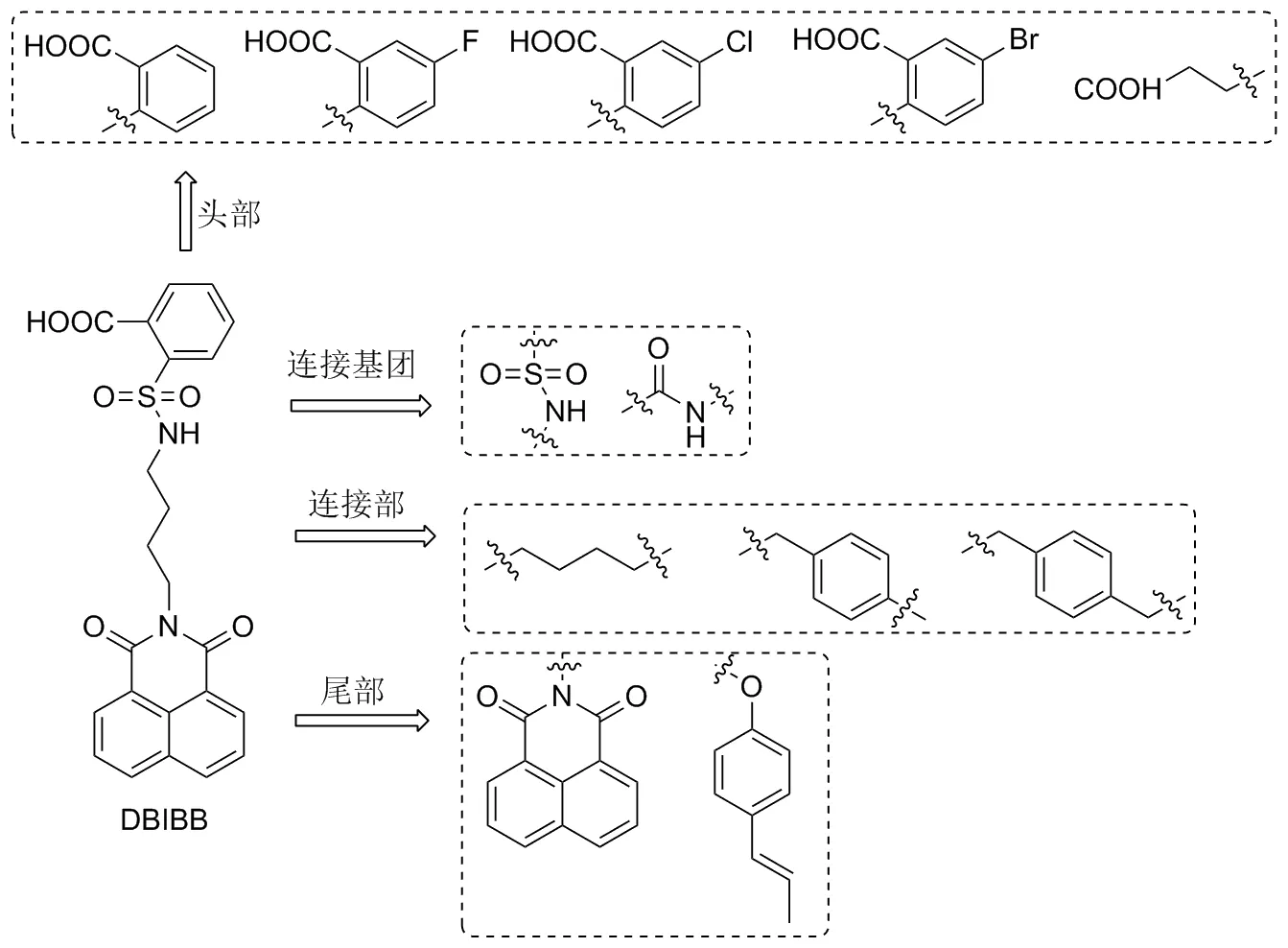
Chart 2
(4)9的合成[17-19]
在氮气保护下,将2-(氯磺酰基)苯甲酸甲酯2.0 g(9.3 mmol)和乙腈(10 mL)加入到50 mL三口烧瓶中,将体系冷却至0 ℃,滴加8 mL氨水溶液,室温搅拌1 h,减压浓缩后晾干,得白色固体91.5 g,收率82.4%, m. p.123~125 ℃。
(5)10的合成
氮气保护下,将80.5 g(1.74 mmol),90.6 g(2.58 mmol),碳酸钾0.6 g(4.35 mmol),碘化钾0.03 g(0.18 mmol)和N,N-二甲基甲酰胺(6 mL) 依次加入到50 mL三口烧瓶中,80 ℃反应3.5 h。体系冷却至室温后加冰水淬灭,分液,水层用乙酸乙酯(3×20 mL)萃取,合并有机相,依次用水(3×20 mL)洗涤,无水硫酸钠干燥,过滤,减压浓缩得白色固体0.7 g,收率87.7%,m. p.155~157 ℃。
(6)11、12a~12d和13的合成(以11为例)
氮气保护下,将1,8-萘二甲酰亚胺0.2 g(1.02 mmol),70.3 g(1.11 mmol),碳酸钾0.4 g(2.54 mmol)和 二氯甲烷(5 mL)依次加入到50 mL三口烧瓶中,75 ℃反应5 h。冷却至室温后加入冰水中淬灭,分液,水层用乙酸乙酯(3×20 mL)萃取,合并有机相,依次用水(3×20 mL)洗涤,无水硫酸钠干燥,过滤,减压浓缩后经硅胶柱层析 [洗脱剂:V(石油醚)/V(乙酸乙酯)=3/1] 纯化得白色固体110.3 g,收率77.1%, m. p.118~120 ℃。
用类似方法合成12a: 灰色固体0.5 g,收率97.8%, m. p.264~266 ℃;12b: 白色固体0.2 g,收率87.5%, m. p.265~267 ℃;12c: 白色固体0.2 g,收率88.0%, m. p.289~291 ℃;12d:白色固体0.3 g,收率89.3%, m. p.300~302 ℃;13: 白色固体0.3 g,收率73.2%, m. p.175~177 ℃。
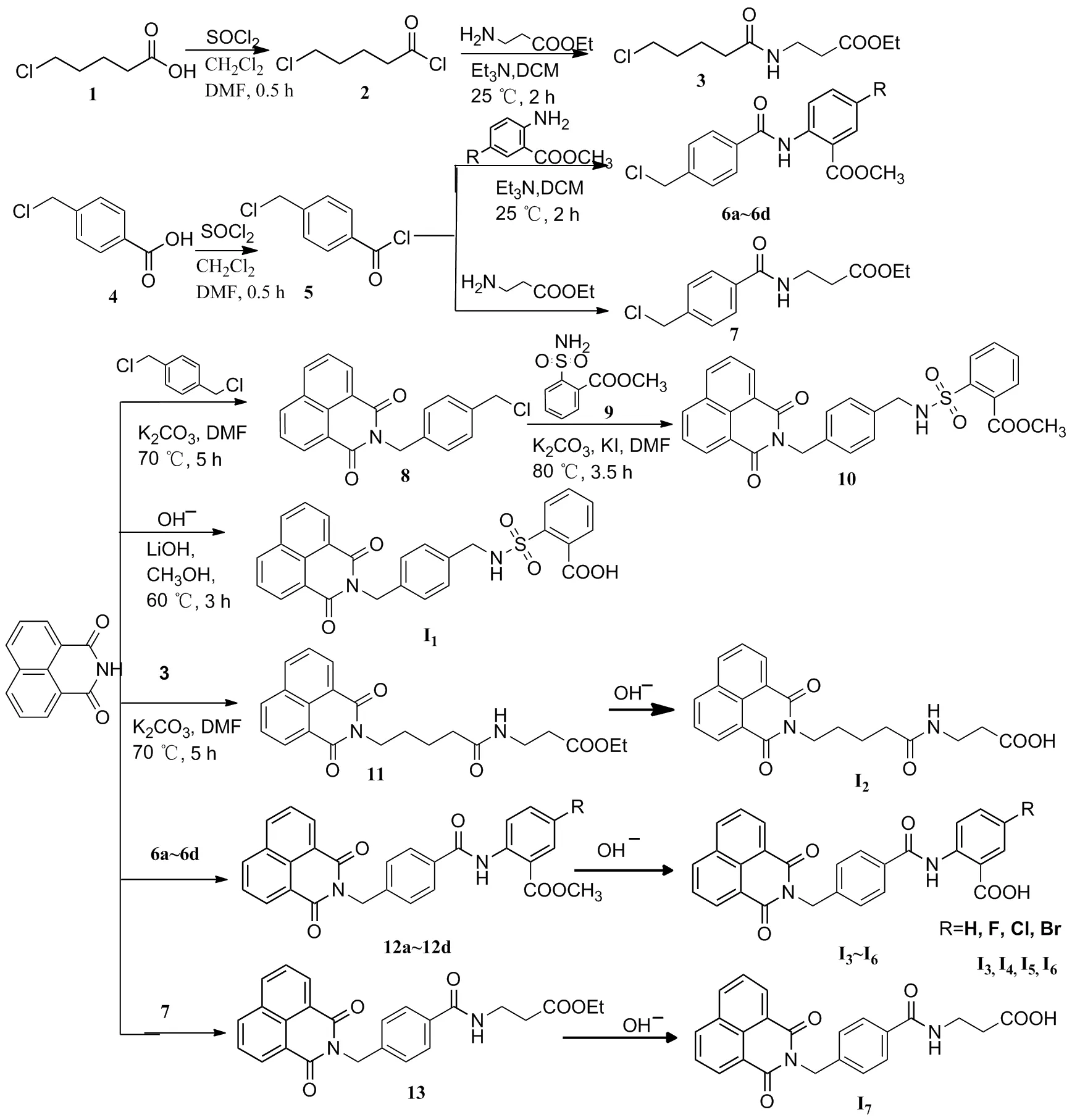
Scheme 1
(7) 2-{N-[(4-(1,3-二氧代-1H-苯并[异]异喹啉-2(3H)-基)甲基)苄基]氨磺酰基}苯甲酸(I1)的合成
将100.1 g(0.27 mmol)和甲醇(3 mL)加入到50 mL单口瓶中,室温下滴入氢氧化锂0.03 g(0.55 mmol)的水溶液2 mL,60 ℃反应3 h。减压浓缩后加入8 mL水,用5%稀盐酸调至pH为弱酸性,产生大量白色固体,抽滤,滤饼经水洗至中性,干燥得2-{N-[4-(1,3-二氧代-1H-苯并[异]异喹啉-2(3H)-基)甲基)苄基]氨磺酰基}(I1): 白色固体,收率77.7%, m.p.259~261 ℃;1H NMR(DMSO-d6, 400 MHz)δ: 13.54(s, 1H), 8.48(dd,J=14.9 Hz, 7.8 Hz, 4H), 7.90~7.82(m, 2H), 7.75~7.68(m, 1H), 7.59~7.44(m, 3H), 7.31~7.25(m, 1H), 7.20(d,J=7.8 Hz, 2H), 7.11(d,J=7.8 Hz, 2H), 5.17(s, 2H), 4.00(d,J=5.8 Hz, 2H); MS(ESI)m/z: Calcd for C27H20N2O6S{[M-H]-}500.1000, found 499.0982。
用类似的方法合成I2~I7,II1~II7:
3-{5-[1,3-二氧代-1H-苯并[异]异喹啉-2(3H)-基]戊酰胺基}丙酸(I2): 白色固体,收率69.9%, m.p.203~205 ℃;1H NMR(DMSO-d6, 400 MHz)δ: 12.08(s, 1H), 8.51~8.37(m, 4H), 7.90~7.77(m, 3H), 4.00(t,J=7.0 Hz, 2H), 3.16(dd,J=12.6 Hz, 6.9 Hz, 2H), 2.31(t,J=6.9 Hz, 2H), 2.06(t,J=7.2 Hz, 2H), 1.62~1.44(m, 4H) ; MS(ESI)m/z: Calcd for C20H20N2O5{[M-H]-}368.1400, found 367.1281。
2-{4-[(1,3-二氧代-1H-苯并[异]异喹啉-2(3H)-基)甲基]苯甲酰氨基}苯甲酸(I3): 白色固体,收率81.4%, m.p.273~275 ℃;1H NMR(DMSO-d6, 400 MHz)δ: 12.58(s, 1H), 8.64(d,J=8.4 Hz, 1H), 8.48(dd,J=14.5 Hz, 7.8 Hz, 4H), 8.00(dd,J=7.9 Hz, 1.4 Hz, 1H), 7.86(t,J=7.6 Hz, 4H), 7.60~7.53(m, 1H), 7.52(d,J=8.2 Hz, 2H), 7.12(t,J=7.6 Hz, 1H), 5.30(s, 2H); MS(ESI)m/z: Calcd for C27H18N2O5{[M-H]-}450.1200, found 449.1178。
2-{4-[(1,3-二氧代-1H-苯并[异]异喹啉-2(3H)-基)甲基]苯甲酰氨基}-5-氟苯甲酸(I4): 白色固体,收率84.4%, m.p.291~293 ℃;1H NMR(DMSO-d6, 400 MHz)δ: 14.09(bs, 1H), 11.97(s, 1H), 8.62(dd,J=9.3 Hz, 5.2 Hz, 1H), 8.53~8.45(m, 4H), 7.91~7.81(m, 4H), 7.71(dd,J=9.4 Hz, 3.1 Hz, 1H), 7.53(d,J=8.3 Hz, 3H), 5.31(s, 2H) ; MS(ESI)m/z: Calcd for C27H17N2O5F{[M-H]-}468.1100, found 467.1083。
5-氯-2-{4-[(1,3-二氧代-1H-苯并[异]异喹啉-2(3H)-基)甲基]苯甲酰氨基}苯甲酸(I5): 淡黄色固体,收率85.7%, m.p.293~295 ℃;1H NMR(DMSO-d6, 400 MHz)δ: 12.66(s, 1H), 8.65(d,J=9.0 Hz, 1H), 8.52~8.42(m, 4H), 7.93(d,J=2.6 Hz, 1H), 7.90~7.81(m, 4H), 7.61(dd,J=9.0 Hz, 2.6 Hz, 1H), 7.51(d,J=8.3 Hz, 2H), 5.30(s, 2H) ; MS(ESI)m/z: Calcd for C27H17N2O5Cl{[M-H]-}484.0800, found 483.0788。
5-溴-2-{4-[(1,3-二氧代-1H-苯并[异]异喹啉-2(3H)-基)甲基]苯甲酰氨基}苯甲酸(I6): 灰色固体,收率90.8%, m.p.286~288 ℃;1H NMR(DMSO-d6, 400 MHz)δ: 13.22(s, 1H), 8.59(d,J=9.0 Hz, 1H), 8.47(dd,J=12.8 Hz, 7.8 Hz, 4H), 8.08(d,J=2.3 Hz, 1H), 7.85(t,J=7.6 Hz, 4H), 7.67(dd,J=9.0 Hz, 2.3 Hz, 1H), 7.51(d,J=8.2 Hz, 2H), 5.29(s, 2H) ; MS(ESI)m/z: Calcd for C27H17N2O5Br{[M-H]-}528.0300, found 527.0250。
3-{4-[(1,3-二氧代-1H-苯并[异]异喹啉-2(3H)-基)甲基]苯甲酰氨基}丙酸(I7): 白色固体,收率81.3%, m.p.255~257 ℃;1H NMR(DMSO-d6, 400 MHz)δ: 12.20(s, 1H), 8.46(dd,J=12.0 Hz, 7.8 Hz, 5H), 7.90~7.80(m, 2H), 7.72(d,J=8.3 Hz, 2H), 7.39(d,J=8.3 Hz, 2H), 5.25(s, 2H), 3.39(dd,J=12.6 Hz, 6.9 Hz, 2H), 2.44(d,J=7.0 Hz, 2H); MS(ESI)m/z: Calcd for C23H18N2O5{[M-H]-}402.1200, found 401.1159。
(E)-2-{N-[4-((4-(丙-1-烯-1-基)苯氧基)甲基)苄基]氨磺酰基}苯甲酸(II1): 白色固体,收率81.9%, m.p.213~215 ℃;1H NMR(DMSO-d6, 400 MHz)δ: 9.58(s, 1H), 7.70(d,J=7.7 Hz, 1H), 7.63(d,J=7.2 Hz, 1H), 7.51(t,J=7.5 Hz, 1H), 7.45~7.08(m, 8H), 6.87(d,J=8.7 Hz, 1H), 6.29(d,J=16.6 Hz, 1H), 6.13~6.02(m, 1H), 5.00(s, 2H), 3.86(d,J=3.7 Hz, 2H), 1.77(d,J=5.8 Hz, 3H); MS(ESI)m/z: Calcd for C24H23NO5S{[M-H]-}437.1300, found 436.1267。
(E)-3-{5-[4-(丙-1-烯-1-基)苯氧基]戊酰胺基}丙酸(II2): 白色固体,收率75.5%, m.p.150~152 ℃;1H NMR(DMSO-d6, 400 MHz)δ: 12.13(s, 1H), 7.86(t,J=5.4 Hz, 1H), 7.24(d,J=8.7 Hz, 2H), 6.81(d,J=8.7 Hz, 2H), 6.29(dd,J=15.8 Hz, 1.5 Hz, 1H), 6.13~6.02(m, 1H), 3.89(t,J=6.0 Hz, 2H), 3.19(dd,J=12.6 Hz, 6.8 Hz, 2H), 2.33(t,J=6.9 Hz, 2H), 2.07(t,J=7.0 Hz, 2H), 1.77(dd,J=6.6 Hz, 1.5 Hz, 3H), 1.68~1.51(m, 4H); MS(ESI)m/z: Calcd for C17H23NO4{[M-H]-}305.1600, found 304.1542。
(E)-2-{4- [(4-(丙-1-烯-1-基)苯氧基)甲基]苯甲酰氨基}苯甲酸(II3): 白色固体,收率85.6%, m.p.252~255 ℃;1H NMR(DMSO-d6, 400 MHz)δ: 15.49(s, 1H), 8.66(d,J=7.5 Hz, 1H), 8.05(d,J=8.2 Hz, 3H), 7.59(d,J=8.3 Hz, 2H), 7.37~7.27(m, 3H), 7.03~6.93(m, 3H), 6.34(dd,J=15.8 Hz, 1.5 Hz, 1H), 6.18~6.08(m, 1H), 5.19(s, 2H), 1.81(dd,J=6.6 Hz, 1.5 Hz, 3H) ; MS(ESI)m/z: Calcd for C24H21NO4{[M-H]-}387.1500, found 386.1421。
(E)-5-氟-2-{4- [(4-(丙-1-烯-1-基)苯氧基)甲基]苯甲酰氨基}苯甲酸(II4): 白色固体,收率84.6%, m.p.243~245 ℃;1H NMR(DMSO-d6, 400 MHz)δ: 14.13(s, 1H), 12.00(s, 1H), 8.64(dd,J=9.2 Hz, 5.2 Hz, 1H), 7.93(d,J=8.2 Hz, 2H), 7.73(dd,J=9.3 Hz, 3.1 Hz, 1H), 7.61(d,J=8.1 Hz, 2H), 7.52(td,J=9.0 Hz, 3.1 Hz, 1H), 7.27(d,J=8.6 Hz, 2H), 6.93(d,J=8.7 Hz, 2H), 6.38~6.22(m, 1H), 6.17~6.02(m, 1H), 5.17(s, 2H), 1.77(d,J=6.5 Hz, 3H); MS(ESI)m/z: Calcd for C24H20NO4F{[M-H]-}405.1400, found 404.1341。
(E)-5-氯-2-{4-[(4-(丙-1-烯-1-基)苯氧基)甲基]苯甲酰氨基}苯甲酸(II5): 白色固体,收率82.5%, m.p.245~247 ℃;1H NMR(DMSO-d6, 400 MHz)δ: 14.18(s, 1H), 12.35(s, 1H), 8.67(d,J=9.0 Hz, 1H), 7.95(dd,J=10.6 Hz, 5.5 Hz, 3H), 7.67(dd,J=9.0 Hz, 2.6 Hz, 1H), 7.61(d,J=8.2 Hz, 2H), 7.27(d,J=8.7 Hz, 2H), 6.93(d,J=8.7 Hz, 2H), 6.31(d,J=15.9 Hz, 1H), 6.16~6.04(m, 1H), 5.17(s, 2H), 1.78(dd,J=6.5 Hz, 1.4 Hz, 3H); MS(ESI)m/z: Calcd for C24H20NO4Cl{[M-H]-}421.1100, found 420.1054。
(E)-5-溴-2-{4- [(4-(丙-1-烯-1-基)苯氧基)甲基]苯甲酰氨基}苯甲酸(II6): 白色固体,收率86.6%, m.p.238~240 ℃;1H NMR(DMSO-d6, 400 MHz)δ: 14.21(s, 1H), 12.31(s, 1H), 8.62(d,J=9.0 Hz, 1H), 8.09(d,J=2.5 Hz, 1H), 7.93(d,J=8.3 Hz, 2H), 7.81(dd,J=9.0 Hz, 2.5 Hz, 1H), 7.61(d,J=8.3 Hz, 2H), 7.28(d,J=8.7 Hz, 2H), 6.93(d,J=8.8 Hz, 2H), 6.30(dd,J=15.8 Hz, 1.5 Hz, 1H), 6.14~6.06(m, 1H), 5.17(s, 2H), 1.77(dd,J=6.6 Hz, 1.4 Hz, 3H); MS(ESI)m/z: Calcd for C24H20NO4Br{[M-H]-}465.0600, found 464.0579。
(E)-3-{4- [(4-(丙-1-烯-1-基)苯氧基)甲基]苯甲酰氨基}丙酸(II7): 灰白色固体,收率85.2%, m.p.215~217 ℃;1H NMR(DMSO-d6, 400 MHz)δ: 8.60(t,J=5.3 Hz, 1H), 7.84(d,J=8.2 Hz, 2H), 7.50(d,J=8.2 Hz, 2H), 7.30(d,J=8.7 Hz, 2H), 6.94(d,J=8.7 Hz, 2H), 6.33(dd,J=15.8 Hz, 1.3 Hz, 1H), 6.18~6.08(m, 1H), 5.15(s, 2H), 3.44(dd,J=12.5 Hz, 6.9 Hz, 2H), 2.46(t,J=7.1 Hz, 2H), 1.81(dd,J=6.5 Hz, 1.3 Hz, 3H); MS(ESI)m/z: Calcd for C20H21NO4{[M-H]-}339.1500, found 338.1420。
1.3 体外抗辐射活性[20-21]
通过MTS法检测HUVEC细胞在辐射照射后的增殖活性用于评价化合物的抗辐射活性。实验分为空白组(只含空白培养基)、照射对照组(细胞只照射不给药)、阴性对照组(细胞不照射不给药)、DBIBB组和化合物组。取对数生长期的HUVEC细胞,0.25%胰蛋白酶消化接种,用含10%胎牛血清的1640培养液制成细胞悬液,在显微镜下调整细胞密度为5×106/L,将100·L/孔细胞悬液接种到96孔板上,每一化合物含有3个平行孔并设不含细胞的空白培养基孔做空白对照,于37 ℃, 5% CO2细胞培养箱培养24 h后加药。空白组、照射对照组和阴性对照组每孔加入100·L空白培养基,DBIBB组和化合物组每孔加入100·L含药培养基(DMSO溶解至100 mmol/L加药前稀释至5·mol/L)。治疗给药组在细胞于8.0 Gy60Coγ射线照射后3 h进行加药,完成后立即将细胞放回细胞培养箱培养;预防给药组加药24 h后将细胞置于8.0 Gy60Coγ射线下一次性照射,照射完毕立即放回细胞培养箱。照后3 d,采用MTS比色法检测各组细胞存活率,每孔加入20·L MTS, 0.5 h后用酶标仪检测490 nm的吸光度值(A490),计算细胞存活率。
2 结果与讨论
2.1 合成
在5的合成中,直接用氯化亚砜室温搅拌,或以乙酸乙酯作溶剂,2 eq.的氯化亚砜室温搅拌或在此条件下加入催化剂N,N-二甲基甲酰胺进行反应,或将上述均升温处理,均未得到5。最后用二氯甲烷作溶剂加入2 eq.的氯化亚砜并以N,N-二甲基甲酰胺作催化剂室温搅拌0.5 h,反应彻底且产率较高。推测原因为原料溶解性差异造成。

表1 I1~I7和II1~II7在8.0 Gy 60Co γ照射下的细胞存活率
2.2 化合物的抗辐射活性
表1为I1~I7和II1~II7在8.0 Gy60Coγ射线照射后的细胞增殖活性。由表1可见,I1在治疗给药时的细胞存活率64.68±1.04* #,与DBIBB组57.55±1.20和照射对照组58.16±2.12相比均上升,具有抗辐射活性;I2在治疗给药时的细胞存活率58.95±1.34* #,与DBIBB组57.55±1.20和照射对照组58.16±2.12相比有提升(差异均有统计学意义),具有抗辐射活性。由此可见连接基团为酰胺基、头部为链状羧酸时具有抗辐射活性。I3~I7和II1~II7的细胞存活率在预防给药和治疗给药时与DBIBB组和照射对照组相比均下降,表明当连接部为疏水芳环时化合物无抗辐射活性,甚至出现细胞毒性作用,从而抑制细胞的生长,但不排除化合物分子的细胞毒性与钴源的辐射损伤作用相叠加,使此类化合物细胞存活率下降明显。
以DBIBB为先导化合物设计合成了14个新型苯并异喹啉类衍生物(I1~I7和II1~II7),并对其进行了活性考察,结果表明:在8.0 Gy60Coγ射线照射下经照前预防给药和照后治疗给药的细胞增殖活性结果显示化合物I1和I2具有较好的体外抗辐射活性。化合物I1是将连接部替换为疏水芳环结构,在治疗给药时的细胞存活率64.68±1.04* #,优于阳性对照组,化合物I2是将先导化合物DBIBB的连接基团氨磺酰基替换为酰胺基、头部替换为链状羧酸,在治疗给药时的细胞存活率58.95±1.34* #,优于阳性对照组,说明I1和I2具有一定的抗辐射活性。
