利用正交实验法优化氢氧化亚铁的制备
2020-11-30李婉冰姜建文李永红
李婉冰 姜建文 李永红
摘要:综述了目前已有的氢氧化亚铁的制备中存在的问题,通过利用正交实验法对硫酸浓度、氢氧化钠浓度、试管大小三个因素进行了系统探究,结合智能手机颜色识别软件鉴定沉淀颜色作为指标,得出氢氧化亚铁的最佳制备条件。
关键词:氢氧化亚铁;正交实验法;制备条件;颜色识别软件
文章编号:1008-0546(2020)09-0088-03
中图分类号:G632.41
文献标识码:B
一、问题的提出
在高中化学教学学习铁的重要化合物这一节内容中,Fe(OH)2的制备实验是重点演示实验内容。2017版《普通高中课程标准》凝练了化学学科核心素养,其中“科学探究与创新意识”这一素养的落实与实验的创新与改进息息相关。在课标的“学习活动建议”中,将Fe(OH)2的制备实验列为应该开展的实验及探究活动之一。在人教版必修一教科书中是这样描述的:在FeSO4溶液中加入NaOH溶液时,生成的白色絮状沉淀迅速变成灰绿色,最后变成红褐色。但在实际课堂演示时,绝大多数老师反映学生基本观察不到白色,看到的沉淀都是灰绿色的。因此,Fe(OH)2的制备一直都是高中化学课堂教学中一个重要的探究实验。
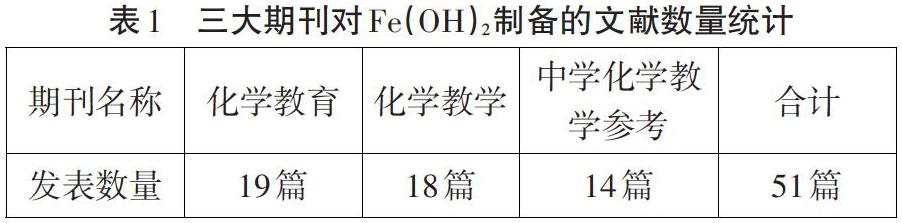
许多学者都对Fe(OH)2的制备进行了相关的研究。在中国知网内以“Fe(OH)2制备”以及“氢氧化亚铁制备”为主题词进行检索,合计有131篇相关文献。对其中发表在《化学教育》和《化学教学》以及《中学化学教学参考》三本期刊上的文献进行了统计分析,截止到2019年底发布的数量统计如表一:
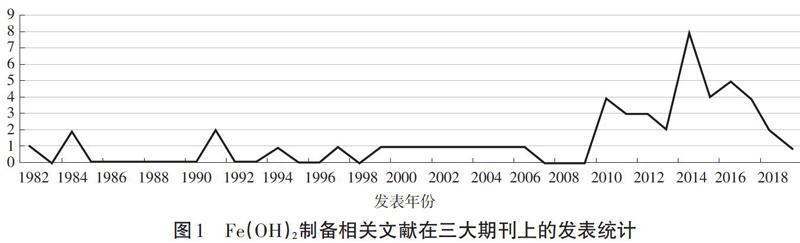
同时,三大期刊在各个年度发表的有关Fe(OH)2制备的文献进行分析,所得的数据趋势图如图1:
从表1和图1可以得知,自21世纪以来,有关Fe(OH)2制备的相关研究一直保持着一定的热度,说明有关Fe(OH)2制备确实是中学的热点研究实验,并且一直存在着问题和争议。
对Fe(OH)2制备的相关研究具体可分为以下两类:一、Fe(OH)2制备的实验改进;二、灰绿色沉淀的成分探究。其中,第一类又可以进行更具体的细分,主要包括实验装置的创新改进,实验方案的设计,实验条件的优化等。在早期的研究中,认为影响Fe(OH)2制备过程中的主要影响因素是氧气的存在,包括空气中的氧气与溶液中的溶解氧。因此,实验改进的方案主要针对减少与空气的接触,驱赶溶解氧,具体的实验手段包括:将滴管伸入溶液、煮沸溶液、加入煤油、石蜡油等隔绝空气。学者们在装置的改进方面主要是形成密闭装置,隔绝外界的空气。例如梁峻峰设计了一套Fe(OH)2制备与氧化的密闭装置,唐悦利用Fe与H2SO4反应产生氢气的压强设计了实验装置,刘彩虹结合医用输液器、注射器自制实验装置。在试剂的选取和配置上,主要的改进方向是减少溶液中的溶解氧。例如,陈杨展用氯化钠的盐析效应来配制硫酸亚铁和氢氧化钠的溶液,段中东用乙醇-水作为溶剂来配置NaOH溶液。
笔者采取文献中的部分实验方法进行重复实验,发现结果并不如人意。因此,对灰绿色沉淀的成因的理论分析对Fe(OH)2制备起着导向作用。目前,对灰绿色沉淀的成分主要的观点是:灰绿色是由于氢氧化亚铁沉淀吸附了溶液中的亚铁离子。吴文中对此进行了详细的理论阐述,朱成东也运用手持技术得出白色沉淀转化为灰绿色并不是由溶解的氧气氧化所导致,而是因为生成的Fe(OH)2沉淀吸附亚铁离子,并通过实验进行了验证。由此,笔者得出:在亚铁离子含量较低,NaOH溶液浓度较高时,产生白色沉淀的概率较大。但在目前的研究中,对于产生Fe(OH)2沉淀的最佳实验条件的研究较少。其中,段中东提出的最佳实验条件,虽然能够得到白色沉淀,但溶液的配制更为繁琐。重复伊慧澄、邹灵得出的最佳实验条件,也未能得出同样的实验结果。
因此,基于以上分析,笔者认为,应该在教材实验原理的基础之上,对实验的最佳条件进行探究。本实验基于原有的实验反应原理,对H2SO4的浓度、NaOH浓度、以及试管的大小三个因素进行了系统探究,以期找出Fe(OH)2制备的最佳制备条件。
二、实验条件的优化
1.实验因素、水平的确定
(1)因素的选取
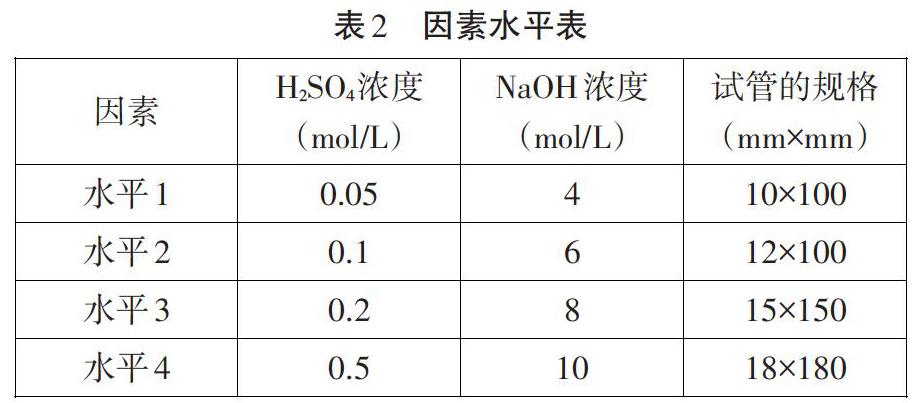
在人教版、鲁科版的教材中,制备Fe(OH)2沉淀的基本反应原理是:Fe2++20H-=Fe(OH)2↓。对文献进行整理可得影响Fe(OH)2制备的主要因素有:Fe2+的浓度、OH-的浓度、实验装置,次要因素有:试管是否伸到液面以下、溶液是否煮沸、滴加的顺序。本实验主要探究了三个主要因素对实验的影响。
(2)水平的确定
①Fe2+的浓度。反应的FeSO4溶液的来源主要有两种方案:采用Fe和稀硫酸新制FeSO4溶液,采用FeSO4·7H2O晶体溶解配制。对两种实验方案进行了预备实验,结果发现,采用FeSO4·7H2O晶体溶解配制的FeSO4溶液几乎看不到白色沉淀,于是采用Fe和稀硫酸来新制FeSO4。由于Fe2+的浓度对实验的影响较大,因此,采用在过量的Fe粉中加入不同浓度的等体积的硫酸进行制备,将FeSO4溶液的浓度进一步明确为H2SO4的浓度。邹灵得出最佳Fe2+的最佳浓度为0.4mol/L,徐建飞得出Fe2+的浓度0.1mol/L。因此,本实验将配制FeSO4溶液的H2SO4溶液设为:0.05mol/L、O.1mol/L、0.2mol/L、0.5mol/L。
②OH-的浓度。徐建飞通过控制变量法对比4mol/L、6mol/L、8mol/L NaOH溶液浓度与0.1mol/LFeSO4溶液反应,得出NaOH溶液浓度为8mol/L时为最佳條件。邹灵通过正交实验探究1mol/L、2mol/L、4mol/L、8mol/L NaOH溶液浓度的影响,同样得出最佳条件为8mol/L。而伊慧澄得出NaOH溶液最佳浓度为4mol/L。因此,本实验选用了4mol/L、6mol/L、8mol/L、10mol/L NaOH溶液浓度四个水平。
③试管的型号。为了实验操作的简易,并未采取较为复杂的实验装置,而是采用了不同型号的试管作为反应装置。选取的试管的规格是:10mm×100mm、12mm×100mm、15mm×150mm、18mm×180mm。
基于以上分析,本实验的因素水平表如表2所示:
2.正交指标的确定
本实验以Fe(OH)2沉淀白色的保留时间作指标。由于用眼睛观察沉淀颜色存在一定的主观因素误差,本实验结合智能手机的颜色识别软件——“颜色识别器”进行颜色的鉴别和判定。由于该软件具备实时拍摄识别功能,可以同步识别颜色,记录实时沉淀的RGB、HSL等颜色信息,并通过目前最常用的潘通色卡转化为日常熟知的颜色。从加入试剂之后进行识别时开始计时,到识别出现绿色时结束计时,为了避免识别的位置产生的误差,固定识别的点处于液面下方约1cm处。同时,进行实验时天气为阴天,室内的光线基本保持一致。
3.实验的过程
(l)FeSO4溶液的配制:
①使用1mol/L的稀硫酸进行稀释,配制成50mL0.05mol/L、0.1mol/L、0.2mol/L、0.5mol/L的稀H2SO4溶液。
②分别称取2g(确保对四种浓度都是过量)的铁粉,放入盛有不同浓度的稀H2SO4溶液的烧杯中,将小烧杯放入40℃的恒温水浴锅中,并用玻璃棒不断搅拌,直至溶液中无气泡冒出。
③放入试剂瓶中静置,备用。
(2)NaOH溶液的配制:分别称取8g、12g、16g、20g的NaOH固体粉末,配制成50mL 4mol/L、6mol/L、8mol/L、10mol/L的NaOH溶液,待用。(新配制的NaOH溶液无须煮沸处理)
(3)进行FeSO4溶液和NaOH溶液的反应:
①在试管中加入4mL NaOH溶液。
②用5mL的注射器吸取1mL的FeSO4溶液,插入到NaOH溶液液面以下,均匀的注射到NaOH溶液中。
③打开手机的“颜色识别器”软件,在NaOH溶液的液面下面1cm处识别沉淀的颜色。并用计时器同步开始计时,在软件中显示沉淀变成绿色停止计时。
4.实验的方案及结果
本实验设计为三因素四水平的正交实验,因此选用了L16(45)的正交表来进行实验。具体的实验以及结果如表3所示。
5.实验结果的直观分析
对以上的实验结果进行数据的直观分析,得出的结果如表4所示:
根据表格,可以得出:
(1)实验因素主次关系。通过对比不同因素的R值,从而判断得出:三个因素对影响保存Fe(OH)2白色的时间的主次影响为:
可以得出NaOH浓度是最主要的影响因素。这可能是因为在碱液浓度较高时,反应后体系pH较大,使得体系中的c(Fe2+)浓度较小,Fe2+不易被吸附在[Fe(OH)]m胶核或沉淀表面。同时可以得出,当Fe2+的浓度越低时,沉淀的保存時间越长。
(2)本实验的最佳实验配比是:A1B4C2。经过进行实验验证,白色沉淀的保存时间长达30min刚刚生成的Fe(OH)2沉淀如图2,30min以后的Fe(OH)2沉淀如图3。
三、研究结论
本实验采取正交实验法得出了Fe(OH)2的最佳制备条件,无须复杂的装置,无须对试剂配制的特殊要求,也无须煮沸和加入石蜡油液封,只需要确保Fe2+的浓度和OH-的浓度即可。采用智能手机颜色识别软件,有效的避免了肉眼观察的主观性。在实验的过程中发现,沉淀接触液面的部分更容易变成灰绿色,时间稍长会变成红棕色。恰好能够说明,Fe(OH)2和空气发生了接触,和氧气反应生成了红棕色的Fe(OH)3。因此,笔者建议,在实际教学中,教师可根据不同的实验目的和教学设计对条件进行合理的调整。
