抗血小板药物作用靶点的研究进展
2020-11-30柯佳韩燕
柯佳 韩燕
摘 要 目的:为新型抗血小板药物的研发提供参考。方法:以“抗血小板”“血小板黏附”“血小板活化”“血小板聚集”“作用机制”“Antiplatelet”“Platelet adhesion”“ Platelet activation”“ Platelet aggregation”“Mechanism”等为中英文关键词,在中国知网、万方数据、PubMed等数据库中组合查询2003年1月-2020年2月发表的相关文献,就血小板参与血栓形成过程中各个级联反应相关的重要信号通路及其作用,以及以各个分子信号为靶点的药物研究进展进行综述。结果与结论:共检索到相关文献3 863篇,其中有效文献52篇。目前,抗血小板药物作用靶点包括血小板黏附信号靶点[如膜糖蛋白(GP)Ⅰb-Ⅸ-Ⅴ与血管性血友病因子的相互作用、GPⅥ与胶原的相互作用]、血小板活化信号靶点[二磷酸腺苷(ADP)受体通路、磷酸二酯酶相关信号、磷脂酰肌醇-3-激酶信号、血栓素相关信号)、血小板聚集靶点[GPⅡb/Ⅲa、蛋白酶激活受体]、磷脂酶C、P-選择素、血小板活化因子等。这些靶点和信号通路参与了血小板黏附、激活、聚集过程以及促进了血小板相关血栓的形成,许多作用于上述靶点的抗血小板药物被研发,包括卡普赛珠单抗、西洛他唑、氮吡格雷等。现有抗血小板药物或在动物实验阶段,或在临床试验阶段,仅有部分药物被批准用于临床。
关键词 抗血小板;血小板黏附;血小板激活;血小板聚集;药物研发;作用靶点
中图分类号 R972 文献标志码 A 文章编号 1001-0408(2020)20-2551-06
DOI 10.6039/j.issn.1001-0408.2020.20.21
血小板是一类直径约2~5 μm的无核细胞碎片,起源于脱落的巨核细胞细胞质,在生理性止血和病理性血栓的发生发展中起着至关重要的作用。活化的血小板会发生形态改变,并通过细胞内及细胞外信号诱导其黏附、聚集,并促进凝血级联反应,形成血栓[1]。因此,许多血栓性疾病的主要治疗方法是抗血小板治疗,尤其是急性冠脉综合征、中风等动脉血栓性疾病。但是目前临床使用的抗血小板药物仍存在出血风险大、疗效个体差异大、药物抵抗等不足[2-4],寻求更安全有效、靶向作用更强的抗血小板药物是抗血小板研究亟待解决的重点。为总结抗血小板治疗可能的作用靶点,笔者以“抗血小板”“血小板黏附”“血小板活化”“血小板聚集”“作用机制”“Antiplatelet”“Platelet adhesion”“Platelet activation”“Platelet aggregation”“Mechanism”等为中英文关键词,在中国知网、万方数据、PubMed等数据库中组合查询2003年1月-2020年2月发表的相关文献。结果,共检索到相关文献3 863篇,其中有效文献52篇。现从血小板相关血栓的形成过程出发,阐述血小板参与该过程中各个级联反应相关的重要信号通路及其作用,以及以各个分子信号为作用靶点的抗血小板药物的研究进展,旨在为新型抗血小板药物的研发提供参考。
1 血小板相关血栓的形成过程
正常状态下,血小板不会黏附于血管内皮,这是因为血管内皮分泌的前列腺素I2(PGI2)和一氧化氮(NO)可以降低血小板的反应性。其中,PGI2可通过与血小板表面的前列腺素受体(IP)结合来促进血小板中环磷酸腺苷(cAMP)的生成,NO则可以直接促进血小板内环磷酸鸟苷(cGMP)的生成[5]。cAMP和cGMP在降低血小板反应性上具有很强的协同作用,两者可以使血小板反应迟钝,进而抑制血小板的活化;此外,血小板内含有清除cAMP和 cGMP的磷酸二酯酶(PDE),用于维持cAMP和 cGMP的动态平衡[6]。
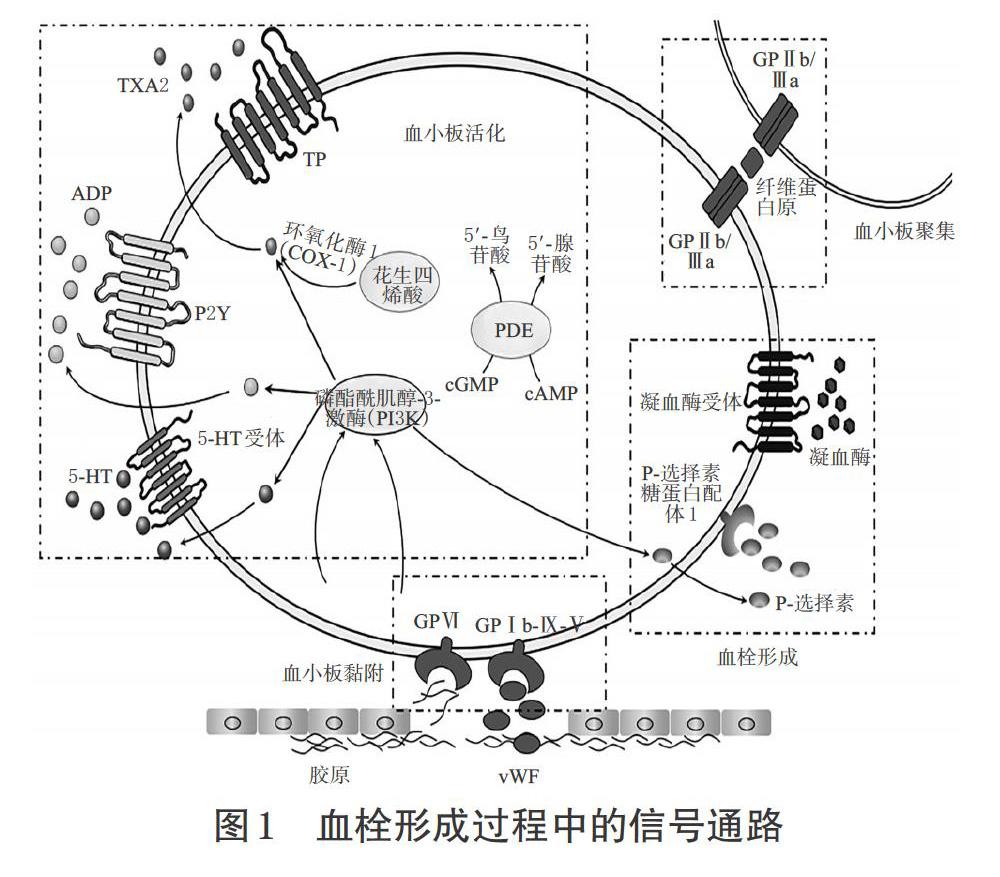
当血管受到损伤后,暴露的内皮下基质[如胶原、血管性血友病因子(vWF)、纤维蛋白原、纤维连接蛋白和层粘连蛋白等]可以与血小板表面的诸多膜糖蛋白(GP)受体相互作用,促进血小板的黏附、活化和聚集,导致血栓形成[6]。其中,vWF可以与血小板表面的血小板黏附受体GP Ⅰb-Ⅸ-Ⅴ复合物结合并触发血小板与受损血管壁的初始黏附,促进血小板表面其他GP的活化,如GP Ⅵ,可引起“外-内”信号的激活;活化后的GP Ⅵ还可与胶原进一步结合,进而稳定血小板与受损血管内皮之间的黏附[7-9]。vWF与GPⅠb-Ⅸ-Ⅴ复合物的结合还会促进血小板分泌二磷酸腺苷(ADP)、血栓素A2(TXA2)、5-羟色胺(5-HT)等[1]。ADP、TXA2可以与血小板表面的嘌呤能受体(P2Y)和血栓素受体(TP)相结合,诱导血小板的活化,使血小板由光滑的圆盘状变为有大量伪足的激活状态[1,7]。血小板的活化会促进其表面GPⅡb/Ⅲa受体的表达和构象改变,使其能与纤维蛋白原结合,形成血小板间的纤维蛋白原桥,引起血小板的聚集,同时还可从循环中招募更多的血小板;活化的血小板还会诱导其表面P-选择素的表达,促进P-选择素与配体相结合,诱导血小板聚集和血管炎症反应,加速血栓的形成[1,7-9]。另外,损伤部位的细胞还会释放组织因子,激活凝血级联反应,促进凝血酶的活化和释放。凝血酶可以和血小板表面的蛋白酶激活受体(PARs)相结合,放大血小板激活反应,并促进纤维蛋白原转化为纤维蛋白,从而形成纤维蛋白网络,使血栓更稳定[1,6-8]。血栓形成过程中的信号通路见图1。
2 血小板黏附信号靶点及相关药物
2.1 GPⅠb-Ⅸ-Ⅴ与vWF
vWF是一种黏附性GP,分布在血浆、血小板和内皮中,在血小板黏附到内皮的过程中起着重要作用[7,10]。在狭窄动脉等具有高剪切变化的环境中,vWF会展开成串状,其A1结构域会发生构象变化,暴露血小板结合位点,与血小板膜上GPⅠb-Ⅸ-Ⅴ复合物中GPⅠbα胞外结构域的N端区域相结合,触发血小板初始黏附信号[10-11]。另外,GPⅠb有一个高亲和力的α-凝血酶结合位点,可以同时结合两个凝血酶分子,促进凝血反应发生[12]。vWF与GPⅠb-Ⅸ-Ⅴ复合物结合还可以传递细胞内信号,触发血小板脱颗粒、细胞内Ca2+水平升高、细胞骨架-肌动蛋白重排[12-14]。总之,血管损伤后,vWF与GPⅠb-Ⅸ-Ⅴ复合物的结合标志着损伤部位血栓形成程序的正式启动。由于GPⅠb-Ⅸ-Ⅴ与vWF只有在血管狭窄等高切变条件下才可发挥作用,对于形态正常的血管影响较小,所以其诱导其他部位出血的风险较小,因此成为了抗血小板药物理想靶点。
卡普赛珠单抗是法国Sanofi公司研发的一种抗vWF的人源化免疫球蛋白纳米抗体,其以vWF的A1结构域为作用靶点,通过阻止A1结构域与GPⅠb-Ⅸ-Ⅴ受体的相互作用,进而抑制微血管血栓形成。临床试验显示,卡普赛珠单抗可以降低血栓性血小板减少性紫癜(TTP)的复发率或血栓栓塞事件的复合发生率,该药已于2019年2月被美国FDA批准用于治疗TTP[15-16]。安菲博肽是一种来源于蛇毒的GPⅠb拮抗剂,由李氏大药厂研发。安菲博肽能直接作用于GPⅠb,抑制其与vWF的相互作用,进而抑制血小板黏附、聚集。前期动物实验表明,安菲博肽能抑制血小板黏附、聚集和血栓形成,但不会延长小鼠尾部出血时间或引起小鼠出血[17];该药也可以抑制小鼠自发性血小板减少症的发生,预防TTP[18]。临床试验显示,安菲博肽用于非ST段抬高型心肌梗死患者不会显著影响其止血功能,但药物疗效和安全性仍有待在临床试验中进一步确立或评估[19]。由于TTP以血浆金属蛋白酶活性不足导致超大vWF聚合物在内皮和血液中积累、进而形成血管内弥散性血栓为病理特征,因此目前靶向GPⅠb-Ⅸ-Ⅴ复合物与vWF相互作用的药物多用于TTP治疗。前期的动物研究及临床试验均表明,这类药物具有良好的抑制血小板聚集的作用,应加强相关研究以扩大其临床应用(如在心脑血管疾病抗血小板治疗方面);同时,应加强对此类药物口服制剂的研究,以方便患者服用。
2.2 GPⅥ与胶原
血小板中的GPⅥ仅表达于巨核细胞和血小板的细胞膜上,是胶原的主要结合受体,在低剪切血流环境中就可以发挥作用[1,20]。GPⅠb-Ⅸ-Ⅴ与vWF的结合可引发GPⅥ与胶原结合,协同介导血小板的稳定黏附。胶原还是强效的促凝血物质,可以激活前凝集素酶,促进凝血。此外,GPⅥ还可以与层粘连蛋白、纤维蛋白结合,促进血小板的黏附和活化[20]。
Revacept是一种被广泛研究的GPⅥ竞争性抑制剂,其是可溶性的GPⅥ-Fc二聚体融合蛋白,可以与胶原结合,抑制GPⅥ与胶原的相互作用。Ⅰ期临床试验显示,Revacept可以抑制胶原诱导的血小板聚集,且对正常出血无明显影响[21]。目前,该药正在进行Ⅱ期临床试验以评估其对中风和颈动脉狭窄等的治疗作用(临床试验注册号:NCT01645306)[22]。也有不少研究表明,一些GPⅥ抗体及GPⅥ-Fc片段(如JAQ 1、9O12、OM2、m-Fab-F等)因与胶原有较高的亲和力,可以特异性地阻断GPⅥ与胶原的相互作用或促进体内GPⅥ的消耗,故也是GPⅥ拮抗剂的研究重点 [23-25]。由于GPⅥ表达的特异性,抑制GPⅥ表达对其他生理过程影响较小,因此其在发挥抑制血小板聚集作用的同时不会影响机体正常的止血功能,具有较好的开发前景[23]。但靶向GPⅥ的药物目前多处在临床前或早期临床研究阶段,关于此类药物的安全性和治疗作用还需更严谨的试验方案进一步评估。
3 血小板活化信号靶点及相关药物
3.1 ADP受体通路
ADP由血小板内的致密颗粒释放,能够与血小板表面的P2Y受体结合诱导血小板活化,是一种重要的血小板激活剂[4]。血小板上的ADP受体主要有P2Y1和P2Y12。其中,P2Y1受体可以通过上调细胞内的Ca2+来诱导血小板形状改变,促进血小板活化。P2Y12受体可以放大血小板活化反应,并通过抑制腺苷酸环化酶的活性来放大和稳定聚集物,从而促进GPⅡb /Ⅲa活化;同时,P2Y12受体激活还可以促进凝血酶的产生,激活凝血系统,稳定血小板-纤维蛋白血凝块,是抗血小板药物开发的经典靶点,如目前临床广泛应用的抗血小板药氯吡格雷和替格瑞洛等均作用于P2Y12受体[26-27]。另外,也有研究表明,P2Y12受体可以促进血管平滑肌细胞的增殖、迁移并造成内皮功能障碍,引起炎症细胞的活动,参与动脉粥样硬化的形成[28]。因此,对冠心病和动脉粥样硬化性缺血性中风的治疗,P2Y12受体是一个非常好的靶点。
P2Y12受体抑制剂是临床上使用最为广泛的抗血小板药物,主要分为两类:前药噻吩并吡啶类药物(如噻氯匹定、氯吡格雷和普拉格雷等)以及直接作用于P2Y12受体的抑制剂(如替格瑞洛和坎格雷洛)。氯吡格雷是唯一一种可用于稳定型冠心病患者的口服P2Y12受体抑制剂,也是临床用量最大的抗血小板药物之一 [29]。但由于患者的基因多态性、依从性以及药物相互作用等多种原因,部分患者会发生氯吡格雷抵抗,严重影响其预后。因此,开发更有效的P2Y12受体抑制剂是非常必要的。此外,P2Y12受体抑制剂种类较多,用药方式和作用强度也各有不同,如何降低其出血风险以及如何在众多P2Y12受体抑制剂中针对患者情況进行个体化给药等问题均需要大规模的临床试验进一步探讨。而与P2Y12受体抑制剂相比,P2Y1抑制剂具有降低出血风险和抗血小板聚集的潜力,是抗血小板治疗的潜在药物,目前已有一些候选的P2Y1抑制剂,但均未进入临床试验阶段[30]。
3.2 PDE相关信号
除了血小板表面受体的激活,血小板活化还依赖于细胞内的信号传导。cAMP和cGMP是血小板内的次级信使,两者含量升高会抑制细胞骨架重排和纤维蛋白原受体激活,阻止血小板活化。但是,血小板中的PDE具有快速清除cAMP和cGMP的作用[6],因此PDE抑制剂也成为了抗血小板药物的研发方向之一。目前,PDE抑制剂西洛他唑、双嘧达莫已在临床上被广泛应用[31],但这些药物均为可逆性PDE抑制剂,有增加缺血事件的风险,通常需与其他药物联合应用。此外,PDE分布广泛,在淋巴细胞、平滑肌细胞等也有表达,因此非特异性地抑制PDE可能会带来其他副作用,如血管扩张引起的头痛和恶心、呕吐等胃肠道反应[32]。可见,具有不可逆性及特异性的PDE抑制剂将是未来的研究方向。
3.3 PI3K信号
PI3K信号转导是诱导血小板颗粒释放的重要转导途径,对于GPⅠb-Ⅸ-Ⅴ和GPⅡb/Ⅲa由内而外的信号转导至关重要,也是ADP/P2Y12结合下游信号转导的关键介质,参与血小板活化和稳定的血小板黏附过程[33]。因此,PI3K抑制剂也成为抗血小板药物开发的候选药物。目前在研的PI3K抑制剂包括AZD 6482、TGX-221等,均属于PI3Kβ抑制剂。其中,AZD 6482目前正处在临床前研究评估阶段,动物实验显示其能抑制血小板聚集[34];TGX-221则能选择性抑制PI3Kβ,可抑制大鼠颈动脉血栓形成,而对鼠尾出血时间无影响[35]。
3.4 TXA2相关信号
TXA2是血管收缩和血小板活化聚集的关键介质。当血小板活化信号启动后,血小板释放出质膜中的花生四烯酸(AA),并通过COX和血栓素合成酶(TXS)转化为TXA2,然后与血小板表面的TP受体结合。TXA2的主要作用是放大血小板活化作用,将更多的血小板募集到血管内皮的损伤部位中[36-38]。可见,COX-1、TXS、TP是抗血小板药物研发的主要靶点。阿司匹林能不可逆地抑制COX-1的活性,是目前使用最广泛的经典抗血小板药物[39]。但阿司匹林在临床使用中易发生抵抗现象,因此使用阿司匹林前要注意评估患者的血小板反应性,以减少药物抵抗的发生[4]。奥扎格雷是第1个被批准用于临床的TXS抑制剂,由于TXA2也是支气管高反应性的强效刺激剂,因此奥扎格雷可同时用于治疗脑梗死和哮喘。其余抑制TXA2与TP受体结合的药物(如AA-2414)等,也多被用于哮喘治疗的研究[40]。
血小板激活的细胞内信号是目前和未来抗血小板药物研究的主要靶点,但是这类药物研究存在一个共同的问题:这些信号不仅存在于血小板内,还涉及体内的其他生理活动[32],所以在药物研究时应注重药物的特异性和选择性;此外,这类药物的研究与其他抗血小板药物研究一样,均需评估患者的出血风险。
4 血小板聚集靶点及相关药物
4.1 GPⅡb/Ⅲa
GPⅡb/Ⅲa是血小板上表达最丰富的GP受体,其表达与活化是所有血小板激活途径的共同终点[12,41]。正常生理状态下,GPⅡb/Ⅲa处于低亲和力或静止状态;当血小板激活后,GPⅡb/Ⅲa活化并对纤维蛋白原的亲和力增强。同时,其还可以直接与vWF结合,将信号传递到细胞质和细胞骨架结构域,以促使血小板的二次激活[31]。因此,GPⅡb/Ⅲa受體也成为了抗血小板药物研发的理想靶点。
目前被美国FDA批准使用的GPⅡb/Ⅲa受体拮抗剂(GRPAs)有3种——阿昔单抗、依替巴肽和替罗非班[42]。这类药物多用于急性冠脉综合征(ACS)的治疗,但存在血小板减少和出血等不良反应。随着越来越多新型抗血小板药物的相继研发,GRPAs的使用逐渐减少。有研究发现,GPⅡb/Ⅲa中的PSI结构域成为了新型抗血小板药物的研究靶点,其与GPⅡb/Ⅲa的活化有关。PSI单克隆抗体可以抑制GPⅡb/Ⅲa 和纤维蛋白原的相互作用,抑制血小板黏附、聚集和血栓形成,且不显著影响出血时间和血小板计数[43]。这表明,GPⅡb/Ⅲa仍然是理想的抗血小板靶点,未来的研究要多从蛋白功能和结构出发,寻找更为安全有效的靶点。
4.2 PARs
PARs是血小板表面的一种G蛋白偶联受体,其N端的蛋白水解后可以暴露出胞外凝血酶结合位点,与凝血酶结合,从而诱发凝血反应[44]。人体血小板可表达PAR1和PAR4,可以分别反映损伤部位不同凝血酶水平的变化,促进血小板活化和聚集。低浓度的凝血酶就可以激活PAR1,触发快速、瞬时的凝血信号级联反应;而PAR4缺乏水蛭素样凝血酶结合域,必须达到较高浓度水平凝血酶的作用才能触发其缓慢而持续的信号级联反应,维持血小板不可逆的聚集[44-45]。
PAR1拮抗剂是抑制凝血酶介导的血小板功能研究中最有突破的抗血小板药物,第1个PAR1竞争性拮抗剂沃拉帕沙在美国被批准为ACS的辅助抗血小板药物,也被美国FDA批准用于心肌梗死或外周动脉疾病患者血管事件的二级预防。但是临床试验表明,沃拉帕沙在抑制血小板聚集的同时也会增加患者脑出血的风险[46]。由于PAR4只有在高浓度凝血酶环境下才能被激活,因此在闭塞型血栓等高浓度凝血酶环境中,特异性抑制PAR4能够阻断血栓形成,而对正常止血功能的影响较小[44-45]。BMS-986120是一种高选择性、可逆性的PAR4拮抗剂,Ⅱ期临床试验表明,其能减少健康志愿者在高切变条件下的体外血栓形成,并且对活化部分凝血活酶时间(ATPP)、凝血酶原时间(PT)等凝血指标无影响[47]。因此,PAR4拮抗剂可能是未来抗血小板药物研究的热门方向之一。
5 其他信号靶点及相关药物
5.1 磷脂酶C(PLC)
PLC是血小板活化信号的一个中枢,许多活化信号通路均在此汇聚。人血小板主要表达PLCγ2、PLCβ2和 PLCβ3,可通过与G蛋白偶联受体结合和蛋白酪氨酸磷酸化而被激活,胶原和凝血酶都是其激活剂,激活的PLC可以促进Ca2+从致密小管系统释放到胞浆中,使血小板形态改变,并作为第二信使传递血小板活化信号[33]。体外试验结果显示,PLC抑制剂U73122可以减弱AA和ADP诱导的血小板聚集[48]。因此,PLC也可能成为未来抗血小板研究的靶点之一。
5.2 P-选择素
P-选择素贮存在血小板的α颗粒中,血小板活化信号启动后,P-选择素会迅速转移到血小板表面并与P-选择素糖蛋白配体1(PSGL-1)相互作用,促进血小板的活化、聚集和血栓形成,并介导血小板对白细胞的黏附[2,6,49]。P-选择素还可以与血小板表面的硫苷脂类物质相互作用,稳定血小板聚集,并促进血小板表面P-选择素的表达,是一种增强血小板聚集的正反馈机制,而P-选择素特异性肽拮抗剂可以阻断P-选择素和硫苷脂类物质的相互作用,抑制血小板聚集[49]。Wang Y等[50]开展的一项动物研究表明,中药冬凌草能通过靶向抑制大鼠体内P-选择素的释放而发挥抗血小板聚集的作用。由此可见,P-选择素也是抗血小板药物研究的潜在靶点。
5.3 血小板活化因子(PAF)
PAF是一种能够诱导血小板聚集的内源性脂质因子,表达于血小板、神经细胞及内皮细胞等众多细胞中,是迄今为止发现的活性最强的血小板聚集诱导剂,且PAF诱导的血小板聚集途径不依赖于ADP和AA[51]。PAF可特异性地与血小板表面的PAF受体相结合,促进PLC的水解,上调细胞内Ca2+水平,促进GPⅡb/Ⅲa和P-选择素的表达,激活并放大炎症反应和血小板活化、聚集[47]。PAF受体拮抗剂具有抗炎、抗氧化、抗血小板聚集和保护神经等多种作用,被推荐作为脑梗死临床治疗药物(Ⅰ级推荐,A级证据)[52]。因此,PAF受体拮抗剂有 望成为非常理想的抗血小板药物,尤其是对于脑卒中的治疗。目前在许多天然植物中都发现了相关活性成分,例如,银杏内酯B是已知天然产物中活性最强的PAF受体拮抗剂之一,以其为主要成分的银杏二萜内酯葡胺注射液已被用于脑梗死的治疗[52]。
6 结语
抗血小板治疗是血栓栓塞性疾病、特别是心脑血管疾病最重要的防治措施之一,这类药物的研究存在一個共同的难题,就是止血和出血的平衡[2,41]。通常,抗血小板效果越好的药物,其出血风险越高。因此,对于抗血小板药物的研究,不仅要注重药物抗血小板聚集的能力,也要关注其出血风险及其他副作用,寻找更安全、有效的抗血小板靶点是未来抗血小板药物研究的突破口。除了研究较多的P2Y受体抑制剂、TXA2通路抑制剂、PDE抑制剂外,还可加强对GPⅥ和PAR抑制剂以及GPⅠb-Ⅸ-Ⅴ与vWF抑制作用的研究。抗血小板药物抵抗、患者血小板反应的异质性也是抗血小板治疗中的难点之一[4],今后除了开展更加完善和规范的临床试验评估用药剂量和用药时间外,研究药物抵抗发生的机制,开发其他途径的抗血小板药物,如PAF途径,也是抗血小板研究的方向之一。此外,以现有治疗药物为基础,通过分子修饰、改变药物特性,研发起效迅速、代谢过程更加简单的抗血小板药物也是抗血小板药物研究的突破口之一。部分血小板活化信号,如PI3K和PDE还参与了人体其他的生理过程,故开发特异性抗血小板药物也是非常重要的。与此同时,作用于血小板聚集多个靶点的药物也可能是未来抗血小板药物研究的方向之一,了解血小板激活聚集的机制和相关信号通路可为其研究提供切入点。
参考文献
[ 1 ] KOUPENOA M,CLANCY L,CORKERY HA,et al. Circulating platelets as mediators of immunity,inflammation,and thrombosis[J]. Circ Res,2018. DOI:10.1161/CIRCRESAHA.117.310795.
[ 2 ] UNGERER M,M?NCH G. Novel antiplatelet drugs in clinical development[J]. Thromb Haemost,2013,109(11):868-875.
[ 3 ] CARRERAS ET,MEGA JL. Dual antiplatelet therapy for heart disease[J]. Circulation,2014,129(21):506-508.
[ 4 ] METHAROM P,BERNDT MC,BAKER RI,et al. Current state and novel approaches of antiplatelet therapy[J]. Arterioscler Thromb Vasc Biol,2015,35(6):1327-1338.
[ 5 ] RAINGER GE,CHIMEN M,HARRISON MJ,et al. The role of platelets in the recruitment of leukocytes during vascular disease[J]. Platelets,2015,26(6):507-520.
[ 6 ] KNOWLES RB,WARNER TD. Anti-platelet drugs and their necessary interaction with endothelial mediators and platelet cyclic nucleotides for therapeutic efficacy[J]. Pharmacol Ther,2019. DOI:10.1016/j.pharmthera.2018. 08.004.
[ 7 ] VARGA-SZABO D,PLEINES I,NIESWANDT B.Cell adhesion mechanisms in platelets[J]. Arterioscler Thromb Vasc Biol,2008,28(3):403-412.
[ 8 ] TOMAIUOLO M,BRASS LF,STALKER TJ. Regulation of platelet activation and coagulation and its role in vascular injury and arterial thrombosis[J]. Interv Cardiol Clin,2017,6(1):1-12.
[ 9 ] JURK K,KEHREL BE. Platelets:physiology and biochemistry[J]. Semin Thromb Hemost,2005,31(4):381- 392.
[10] CHEN Y,RUGGERI ZM,DU X. 14-3-3 proteins in platelet biology and glycoprotein Ⅰb-Ⅸ signaling[J]. Blood,2018,131(22):2436-2448.
[11] DA SILVA ML,OCONNOR MN,KRISTON-VIZI J,et al. Type Ⅱ PI4-kinases control Weibel-Palade body biogenesis and von Willebrand factor structure in human endothelial cells[J]. J Cell Sci,2016,129(10):2096-2105.
[12] RIVERA J,LOZANO ML,NAVARRO-NUNEZ L,et al. Platelet receptors and signaling in the dynamics of thrombus formation[J]. Haematologica,2009,94(5):700-711.
[28] GAO Y,YU C,PI S,et al. The role of P2Y12 receptor in ischemic stroke of atherosclerotic origin[J]. Cell Mol Life Sci,2019,76(2):341-354.
[29] ANGIOLILLO DJ,ROLLINI F,STOREY RF,et al. International expert consensus on switching platelet P2Y12 receptor-inhibiting therapies[J]. Circulation,2017,136(20):1955-1975.
[30] JEON YT,YANG W,QIAO JX,et al. Identification of 1-{2-[4-chloro-1′-(2,2-dimethylpropyl)-7-hydroxy-1,2- dihydrospiro[indole-3,4′-piperidine]-1-yl]phenyl}-3-{5- chloro-[1,3]thiazolo[5,4-b]pyridin-2-yl}urea,apotent,efficaciousand orally bioavailable P2Y1 antagonist as an antiplatelet agent[J]. Bioorg Med Chem Lett,2014,24(5):1294-1298.
[31] YEUNG J,LI W,HOLINSTAT M,et al. Platelet signaling and disease:targeted therapy for thrombosis and other related diseases[J]. Pharmacol Rev,2018,70(3):526-548.
[32] XIANG Q,PANG X,LIU Z,et al. Progress in the development of antiplatelet agents:focus on the targeted molecular pathway from bench to clinic[J]. Pharmacol Ther,2019. DOI:10.1016/j.pharmthera.2019.107393.
[33] ESTEVEZ B,DU X. New concepts and mechanisms of platelet activation signaling[J]. Physiology:Bethesda,2017,32(2):162-177.
[34] NYLANDER S,KULL B,BJ?RKMAN JA,et al. Human target validation of phosphoinositide 3-kinase(PI3K)β:effects on platelets and insulin sensitivity,using AZD 6482 a novel PI3Kβ inhibitor[J]. J Thromb Haemost,2012,10(10):2127-2136.
[35] BIRD JE,SMITH PL,BOSTWICK JS,et al. Bleeding response induced by anti-thrombotic doses of a phosphoi- nositide 3-kinase(PI3K)-β inhibitor in mice[J]. Thromb Res,2011,127(6):560-564.
[36] MURPHY PT,GRACE S,GLAVEY S,et al. Rivaroxaban may increase platelet activation in vivo via thromboxane A2[J]. Circ Res,2019. DOI:10.1161/CIRCRESAHA. 119.315453.
[37] SMITH WL,MARNETT LJ,DEWITT DL. Prostaglandin and thromboxane biosynthesis[J]. Pharmacol Ther,1991. DOI:10.1016/0163-7258(91)90054-p.
[38] FAN H,CHEN S,YUAN X,et al. Structural basis for ligand recognition of the human thromboxane A2 receptor[J]. Nat Chem Biol,2019,15(1):27-33.
[39] 2019阿司匹林在心血管疾病一級预防中的应用中国专家共识写作组. 2019阿司匹林在心血管疾病一级预防中的应用中国专家共识[J/OL].中华心血管病杂志:网络版,2019,2(1):e1-e9.
[40] ROLIN S,MASEREEL B,DOGN? JM. Prostanoids as pharmacological targets in COPD and asthma[J]. Eur J Pharmacol,2006,533(1/3):89-100.
[41] LI Z,DELANEY MK,O'BRIEN KA,et al. Signaling during platelet adhesion and activation[J]. Arterioscler Thro- mb Vasc Biol,2010,30(12):2341-2349.
[42] USTA C,TURGUT NT,BEDEL A. How abciximab might be clinically useful[J]. Int J Cardiol,2016. DOI:10.1016/j.ijcard.2016.07.213.
[43] ZHU G,ZHANG Q,REDDY EC,et al. The integrin PSI domain has an endogenous thiol isomerase function and is a novel target for antiplatelet therapy[J]. Blood,2017,129(13):1840-1854.
[44] NIEMANMT. Protease-activated receptors in hemostasis[J]. Blood,2016,128(2):169-177.
[45] CUNNINGHAM M,MCINTOSH K,BUSHELL T,et al. Proteinase-activated receptors(PARs)as targets for antiplatelet therapy[J]. Biochem Soc Trans,2016,44(2):606-612.
[46] WIVIOTT SD,STEG PG. Clinical evidence for oral antiplatelet therapy in acute coronary syndromes[J]. Lancet,2015,386(9990):292-302.
[47] WILSON SJ,ISMAT FA,WANG Z,et al. PAR4(protease-activated receptor 4) antagonism with BMS-986120 inhibits human ex vivo thrombus formation[J]. Arterioscler Thromb Vasc Biol,2018,38(2):448-456.
[48] KHAN N,FAROOQ AD,SADEK BS. Investigation of cyclooxygenase and signaling pathways involved in human platelet aggregation mediated by synergistic interaction of various agonists[J]. Drug Des Devel Ther,2015. DOI:10.2147/DDDT.S84335.
[49] KORPORAAL SJA,MOLENAAR TJM,LUTTERS BCH,et al. Peptide antagonists for P-selectin discriminate between sulfatide-dependent platelet aggregation and PSGL- 1-mediated cell adhesion[J]. J Clin Med,2019. DOI:10.3390/jcm8081266.
[50] WANG Y,TANG J,ZHU H,et al. Aqueous extract of Rabdosia rubescens leaves:forming nanoparticles,targeting P-selectin,and inhibiting thrombosis[J]. Int J Nanomedicine,2015. DOI:10.2147/IJN.S91316.
[51] LORDAN R,TSOUPRAS A,ZABETAKIS I,et al. Forty years since the structural elucidation of platelet-activating factor(PAF):historical,current,and future research perspectives[J]. Molecules,2019. DOI:10.3390/molecules- 24234414.
[52] 鐘晓南.血小板活化因子受体拮抗剂治疗缺血性卒中的中国专家共识[J].中国神经免疫学和神经病学杂志,2020,27(1):1-5、8.
(收稿日期:2020-04-27 修回日期:2020-09-11)
(编辑:孙 冰)
