当归挥发油对缺氧/复氧损伤大鼠心肌细胞H9C2自噬的调控作用研究
2020-11-30浦延鹏周佳明
浦延鹏 周佳明


摘 要 目的:探討当归挥发油对缺氧/复氧(H/R)损伤大鼠心肌细胞H9C2自噬的调控作用。方法:以大鼠心肌细胞H9C2为对象,在CCK-8法筛选当归挥发油最佳给药浓度和给药时间的基础上,采用酶联免疫吸附测定法检测当归挥发油作用后细胞上清液中乳酸脱氢酶(LDH)的活性;以自噬抑制剂(3-甲基腺嘌呤,5 mmol/L)为阳性对照,采用MDC法和Western blotting法分别检测药物作用后细胞中MDC的平均荧光强度以及自噬相关蛋白[Beclin-1、微管相关蛋白轻链3Ⅱ(LC3Ⅱ)、LC3Ⅰ]的表达情况。结果:经0.6 μmol/L当归挥发油作用6 h后,与空白组比较,H/R组细胞上清液中LDH活性和细胞中MDC平均荧光强度、Beclin-1表达水平、LC3Ⅱ/LC3Ⅰ比值均显著升高,细胞中p62表达水平显著降低(P<0.05或P<0.01);与H/R组比较,H/R+药物组细胞上清液中LDH活性,H/R+药物组和H/R+自噬抑制剂组细胞中MDC平均荧光强度、Beclin-1表达水平、LC3Ⅱ/LC3Ⅰ比值均显著降低,细胞中p62表达水平均显著升高(P<0.05或P<0.01)。结论:当归挥发油可通过调控自噬相关蛋白的表达来降低H/R损伤心肌细胞的自噬水平。
关键词 当归挥发油;缺氧/复氧;大鼠心肌细胞H9C2;自噬
中图分类号 R285.5 文献标志码 A 文章编号 1001-0408(2020)20-2492-06
DOI 10.6039/j.issn.1001-0408.2020.20.11
ABSTRACT OBJECTIVE: To investigate the regulation effects of volatile oil from Angelica sinensis on autophagy of myocardial cell H9C2 in rats with hypoxia and reoxygenation (H/R) injury. METHODS: Using myocardial cell H9C2 as subject, CCK-8 method was used to screen the optimal concentration and administration time of volatile oil from A. sinensis. The acitivity of LDH in cell supernatant was determined after treated with volatile oil from A. sinensis by ELISA. Using autophagy inhibitors (3-methyladenine, 5 mmol/L) as positive control, MDC method and Western blotting assay were used to detect average fluorescence intensity of MDC and the expression of autophagy related proteins [Beclin-1, microtubule associated protein light chain 3Ⅱ(LC3Ⅱ), LC3Ⅰ] in H9C2 cells after treated with medicines. RESULTS: After treated with 0.6 μmol/L violate oil from A. sinensis for 6 h, compared with blank group, LDH activity in cell supernatant, average fluorescence intensity of MDC, the expression of Beclin-1, LC3Ⅱ/LC3Ⅰ ratio in cells were increased significantly in H/R group, while the expression of p62 was decreased significantly (P<0.05 or P<0.01). Compared with H/R group, the activity of LDH in cell supernatant of H/R+drug group as well as average fluorescence intensity of MDC, the expression of Beclin-1, LC3Ⅱ/LC3Ⅰratio in cells in H/R+drug group and H/R+autophagy inhibitor group were decreased significantly, while the expression of p62 were increased significantly (P<0.05 or P<0.01). CONCLUSIONS: The volatile oil from A. sinensis can reduce the autophagy level of H/R injury myocardial cells by regulating the expression of autophagy related proteins.
KEYWORDS Volatile oil from Angelica sinensis; Hypoxia/reoxygenation; Myocardial cell H9C2 of rats; Autophagy
缺血性心脏病大多是由冠状动脉供血不足所致,可引起心肌损伤。如果能及时恢复心脏供血,可恢复心脏功能;但也可能导致心肌损伤加重,造成缺血/再灌注(I/R)损伤[1-2]。在很多情况下,机体会出现I/R损伤,如创伤、收缩后血管回流、经冠状动脉成形术、溶栓治疗等,而当受损的缺血心肌组织经过干预再次恢复血液灌注时,往往会伴随着组织损伤加重的可能,引起心功能不全、再灌注心律失常和心肌梗死加重等[3-4]。因此,如何有效改善I/R所致组织损伤成为了学者研究的热点。
导致心肌I/R损伤的机制较复杂,而自噬在组织损伤中扮演了重要的角色。有研究表明,自噬可降解老化的蛋白质及受损的细胞器,在维持心脏的正常形态和功能以及改善心肌I/R损伤等方面发挥了积极作用[5]。但是,自噬对细胞的作用是双向的,过度自噬也可以造成组织损伤[6]。有研究发现,中药能有效缩小I/R后组织的坏死面积,并能改善相应脏器的功能障碍,其治疗机制可能与对自噬作用的调控有关[7]。
中药当归以补血通络为主要功效,常用于胸痹等缺血性疾病的治疗,而挥发油是当归的主要活性成分之一。已有文献报道,当归挥发油可对大鼠局灶性脑I/R损伤发挥保护作用[8],并且对平滑肌[9]、免疫系统[10-12]及心血管系统[13-14]等也有相应的保护作用。但是,当归挥发油的作用机制是否与自噬有关,目前尚未得到证实。因此,笔者以当归挥发油预处理大鼠心肌H9C2细胞,以缺氧/复氧(H/R)模拟心肌I/R损伤,并选用自噬抑制剂3-甲基腺嘌呤(3-MA)作为阳性对照,探讨当归挥发油是否能通过调节自噬对大鼠心肌H9C2细胞的H/R损伤来发挥保护作用,以期为当归挥发油在心肌I/R损伤研究领域中的开发和利用提供依据。
1 材料
1.1 仪器
MCO-15AC型CO2细胞培养箱(日本Sanyo公司);BX53T-32F01-FLB3型荧光显微镜(日本Olympus公司);Infinite 200 PRO型多功能酶标仪(瑞士Tecan公司);1708625型电泳仪、化学发光成像系统(美国Bio-Rad公司);HS-1800型超净工作台(苏州安泰空气技术有限公司)。
1.2 药品与试剂
当归挥发油[甘肃康达药业开发有限责任公司,批号:20190916,含量:81.4%(以藁苯内酯计)];自噬抑制剂3-MA对照品(美国Targetmol公司,批号:T1897,纯度:98%);胎牛血清(美国Clark公司,批号:FB25015);DMEM无糖培养基(批号:90113)、青链霉素混合液(批号:P1400)、二甲亚砜(DMSO,批号:D8371)均购自北京索莱宝科技有限公司;0.25%蛋白胰酶(批号:SH30031.02)、DMEM/F12培养基(批号:SH30213.02)均购自美国Hyclone公司;增强型CCK-8试剂盒(上海尚宝生物科技有限公司,批号:ST1006);细胞自噬染色(MDC法)检测试剂盒(北京雷根生物技术有限公司,批号:DA0041);乳酸脱氢酶(LDH)检测试剂盒(批号:WLA073)、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)快速制备试剂盒(批号:WLA013)、BCA蛋白质定量试剂盒(批号:WLA004)、超敏ECL试剂盒(批号:WLA006)、兔源β-actin多克隆抗体(批号:WL0002c)、辣根过氧化物酶(HRP)标记山羊抗兔IgG(H+L)二抗(批号:WLA023a)、兔源Beclin-1多克隆抗体(批号:WL02508)、兔源p62多克隆抗体(批号:WL02385)、RIPA裂解液(批号:WLA014)均购自沈阳万类生物科技有限公司;兔源微管相关蛋白轻链3(LC3)Ⅱ/LC3Ⅰ多克隆抗体(美国Proteintech公司,批号:14600-1-AP);厌氧产气包和厌氧培养袋均购自青岛海博生物技术有限公司;其余试剂均为分析纯或实验室常用规格,水为蒸馏水(三级)。
1.3 细胞
大鼠心肌H9C2细胞购自武汉博士德生物工程有限公司。
2 方法
2.1 药物工作液制备
取当归挥发油1 g,加适量DMSO溶解后,以DMEM无糖培养基配制成质量浓度为4.28 mmol/L的母液,于-20 ℃下保存;临用前,用DMEM无糖培养基稀释至相应质量浓度的工作液。稱取3-MA适量,以DMEM/F12培养基制成浓度为5 mmol/L的工作液,备用。
2.2 细胞培养
将H9C2细胞培养于含有10%胎牛血清及1%青链霉素混合液的DMEM无糖培养基中,置于 37 ℃、5% CO2的细胞培养箱中进行培养。
2.3 H/R损伤细胞模型的建立
参考文献方法[15]选取缺氧2 h、复氧4 h为模型建立条件:取H9C2细胞,复苏,待其生长至培养皿的80%~90%时,弃去培养基,以无菌磷酸盐缓冲液(PBS,pH 7.2)洗涤后,加入不含血清的DMEM无糖培养基,置于厌氧培养袋中(内有一个打开的厌氧产气包)进行密封培养2 h,使细胞缺氧;随后,以不含血清的DMEM/F12培养基替换DMEM无糖培养基,置于37 ℃、5%CO2的细胞培养箱中继续培养4 h进行复氧,以建立H/R损伤细胞模型。
2.4 当归挥发油对H9C2细胞活力的影响
采用CCK-8法检测。取对数生长期的H9C2细胞,用无血清DMEM/F12培养基制备细胞悬液,并以1×104个/孔接种于96孔板中,每孔100 μL。将细胞随机分为空白对照组和不同浓度当归挥发油组,在37 ℃、5%CO2的细胞培养箱中培养24 h。以无菌PBS洗涤后,除空白对照组不加药外,其余各组均加入无菌当归挥发油工作液(终浓度分别为0、20、40、60、80、100 μmol/L),每组设置3个复孔。继续培养2、4、6 h后,弃上清液,每孔加入无血清DMEM/F12培养基100 μL和CCK-8检测试剂10 μL,继续培养40 min,采用多功能酶标仪在490 nm波长处检测各孔的光密度(OD)值并按说明书公式计算各组的相对细胞活力,OD值越高,细胞活力越强[4]。上述试验重复3次。
2.5 当归挥发油对H9C2细胞上清液中LDH活性的影响
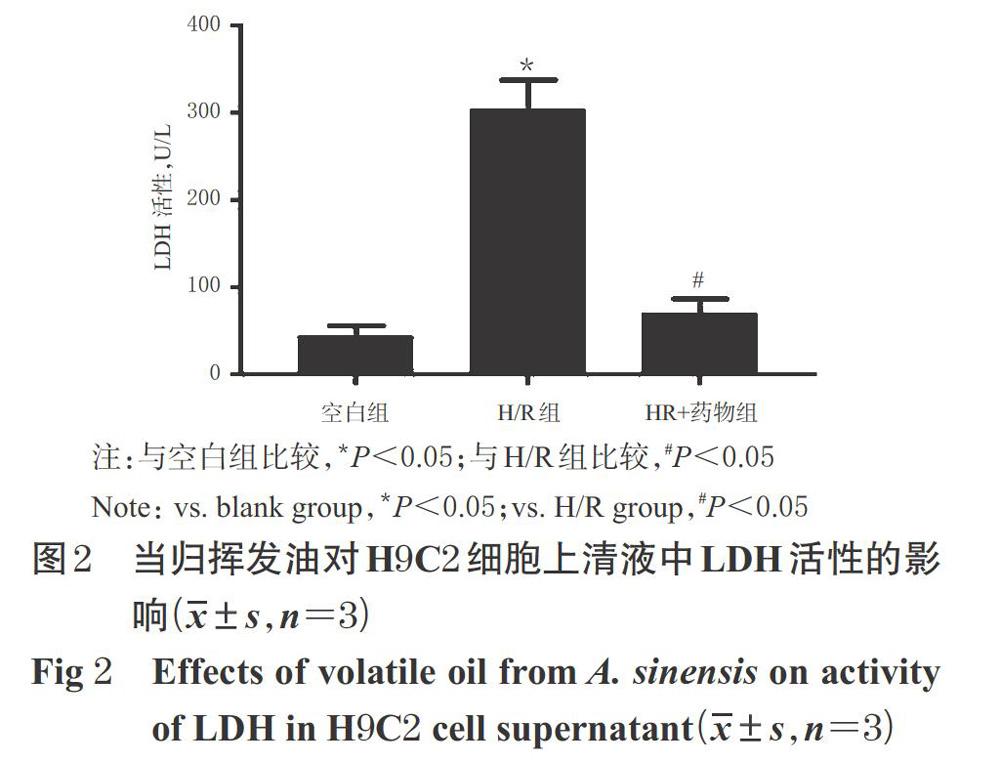
采用酶联免疫吸附测定(ELISA)法检测。取对数生长期的H9C2细胞,按“2.4”项下方法制备细胞悬液后,以1×104个/孔接种于96孔板中,每孔100 μL。将细胞随机分为空白组、模型组(H/R组)、H/R+药物组(给药浓度参考“2.4”项下结果,下同),每组设置3个复孔。空白组不作任何处理;H/R组、H/R+药物组先参照“2.3”项下方法建立H/R损伤模型,药物组再给予相应药物。培养适宜时间(时间参考“2.4”项下结果,下同)后,收集各组细胞上清液。参照相应试剂盒说明书,采用多功能酶标仪于450 nm波长处检测并计算LDH活性。LDH活性越高,则细胞自噬水平越高[5]。上述试验重复3次。
2.6 当归挥发油对H9C2细胞自噬水平的影响
采用MDC法检测。取对数生长期的H9C2细胞,按“2.4”项下方法制备细胞悬液后,以5×103个/孔接种于96孔板中,每孔100 μL。将细胞随机分为空白组、模型组(H/R组)、H/R+药物组(终浓度同“2.5”项)、H/R+自噬抑制剂组(3-MA终浓度为5 mmol/L[16])。空白组不作任何处理;H/R组、H/R+药物组、H/R+自噬抑制剂组先参照“2.3”项下方法建立H/R损伤模型,各药物组再给予相应药物。培养适宜时间后,以无菌PBS轻柔清洗2次,洗去药物和抑制剂后,每孔加入MDC染色工作液100 μL,于37 ℃、5%CO2条件下避光孵育 15~60 min;然后,各孔加入PBS 100 μL清洗2~3次后,置于荧光显微镜下,观察MDC染色情况,随机选取3个视野进行拍照,使用Iamge-Pro Plus 6.0图像处理软件分析染色部位的积分光密度(IOD)并计算MDC平均荧光强度。平均荧光强度值越高,则细胞自噬水平越高[6]。上述试验重复3次。
2.7 当归挥发油对H9C2细胞中Beclin-1、LC3Ⅱ、LC3Ⅰ、p62蛋白表达的影响
采用Western blotting法检测。取对数生长期的H9C2细胞,参照“2.6”项下方法接种、分组、造模、给药,培养适宜时间后,弃去培养液,用PBS轻柔清洗1~2次后,加入RIPA裂解液200 μL和苯甲基磺酰氟(PMSF)2 μL,并进行冰上裂解。细胞充分裂解后,于4 ℃下以12 000 r/min离心20 min,取上层总蛋白提取液,采用BCA法进行蛋白定量。取蛋白适量,在100 ℃下行变性处理后,进行15% SDS-PAGE,随后转移至聚偏二氟乙烯膜(PVDF)上,以7%脱脂奶粉于室温下封闭1 h;用TBST溶液清洗10 min×3次,然后加入自噬相关蛋白Beclin-1、LC3Ⅱ、LC3Ⅰ、p62抗体和内参β-actin抗体(稀释度均为1 ∶ 500),4 ℃孵育过夜;以TBST溶液清洗10 min×3次,加入二抗(稀释度为1 ∶ 500),室温孵育2 h;以TBST溶液清洗10 min×3次,滴加ECL显影液,在化学发光成像系统中曝光成像,采用Image J 1.8.0图像处理软件测量各目标蛋白灰度值,并以内参蛋白灰度值为参照计算相对灰度值以表示目标蛋白(Beclin-1、p62)的表达水平,同时计算LC3Ⅱ、LC3Ⅰ的灰度值比值(以下简称“LC3Ⅱ/LC3Ⅰ比值”)。上述试验重复3次。
2.8 统计学方法
采用SPSS 19.0软件对数据进行统计分析。计量资料以x±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD检验。以P<0.05為差异有统计学意义。
3 结果
3.1 当归挥发油对H9C2细胞活力的影响
与空白组比较,不同浓度当归挥发油组细胞在培养2、4、6 h后的相对活力均无显著变化(P>0.05),且在一定程度上有随浓度增加而升高的趋势,并在当归挥发油60 μmol/L时达到最高值;且随处理时间的延长,这一作用越发明显,其中以60 μmol/L当归挥发油培养6 h时的细胞相对活力最高,故本研究选取上述条件进行后续试验。不同浓度当归挥发油对H9C2细胞相对活力的影响见图1。
3.2 当归挥发油对H9C2细胞上清液中LDH活性的影响
与空白组比较,H/R组细胞上清液中LDH活性显著升高(P<0.05);与H/R组比较,H/R+药物组细胞上清液中LDH活性显著降低(P<0.05)。当归挥发油对H9C2细胞上清液中LDH活性的影响见图2。
3.3 当归挥发油对H9C2细胞自噬水平的影响
与空白组比较,H/R组细胞的MDC平均荧光强度显著升高(P<0.01);与H/R组比较,H/R+药物组和H/R+自噬抑制剂组细胞的MDC平均荧光强度均显著降低(P<0.05或P<0.01)。当归挥发油对H9C2细胞自噬水平影响的荧光显微图和自噬水平检测结果见图3、图4。
3.4 当归挥发油对H9C2细胞中Beclin-1、LC3Ⅱ、LC3Ⅰ、p62蛋白表达的影响
与空白组比较,H/R组细胞中Beclin-1表达水平和LC3Ⅱ/LC3Ⅰ比值均显著升高,p62表达水平显著降低(P<0.05);与H/R组比较,H/R+药物组和H/R+自噬抑制剂组的Beclin-1表达水平和LC3Ⅱ/LC3Ⅰ比值均显著降低,p62表达水平均显著升高(P<0.05)。当归挥发油对H9C2细胞中Beclin-1、LC3Ⅱ、LC3Ⅰ、p62蛋白表达影响电泳图和表达水平检测结果见图5、图6。
4 讨论
随着时代的发展和生活水平的不断提高,人们的不良饮食习惯日渐增多;与此同时,高血脂、高血压、糖尿病等代谢性疾病的发病率呈增高的趋势,由此类基础疾病导致的缺血性心脏病的发病率也逐年升高,严重威胁人们的健康。缺氧和局部缺血后会导致细胞能量供应不足,进而造成心肌损伤,此时应尽快恢复正常的血供以使心脏损伤降至最低;然而在恢复血供的同时,再灌注损伤亦随之出现,并有可能进一步加重病情[15]。有研究发现,I/R所导致的细胞凋亡与自噬密切相关,当发生I/R损伤后,机体可通过自噬作用来清除受损的细胞器来减少细胞凋亡,从而发挥保护作用[17]。自噬是细胞的一种自我降解和清除的动态过程,当机体受到外界刺激而导致细胞器受损时,就会激活自噬作用以清除受损细胞器和蛋白质[18-19]。据相关文献报道,有的中药成分可通过抑制神经元的过度自噬来协助I/R后相应脏器的功能恢复[7]。可见,自噬作为I/R损伤中重要的病理变化,已经成为学者们研究的热点[20]。
有研究表明,细胞上清液中LDH的活性可以反映细胞自噬水平,且LDH活性升高,细胞自噬作用增强;同时,选用MDC法可以直观地评估药物作用后的细胞自噬水平,即MDC平均荧光强度升高,细胞自噬水平增强[21]。在自噬过程中,LC3-Ⅱ、LC3-Ⅰ是生成自噬体膜的必备物质,是自噬体形成的最重要分子,因此常被作为自噬的标志蛋白,且LC3-Ⅱ/LC3-Ⅰ比值升高时,细胞的自噬水平亦升高[22];而自噬底物蛋白p62可通过在C端与泛素化蛋白结合,以及在N端与LC3Ⅱ结合,从而参与自噬的降解[23]。因此,通过检测LC3Ⅱ/LC3Ⅰ比值和p62蛋白的表达水平,可以评估细胞自噬水平的高低。此外,在自噬体形成的初始阶段,Beclin-1可与Ⅲ型胞内磷脂酰肌醇-3-激酶(PI3K)、p150蛋白结合形成Ⅲ型PI3K复合体,并作为该复合体的中心蛋白,主要发挥促使自噬体成熟的作用[24];同时,Beclin-1还能与Atg1、Atg9作用,共同参与调控吞噬泡的形成,最终促进自噬的发生[25]。因此,本研究通过检测LC3-Ⅱ/LC3-Ⅰ比值和Beclin-1、p62蛋白的表达水平来评价药物对细胞自噬水平的影响。3-MA是一种特异性针对自噬作用的常用抑制剂,广泛应用于自噬诱导的研究中[26],因此笔者选用3-MA作为阳性对照,以对比研究当归挥发油对H/R损伤H9C2细胞自噬的影响。结果显示,与空白组比较,H/R组细胞上清液中LDH活性显著升高,细胞中MDC平均荧光强度显著升高,Beclin-1表达水平和LC3Ⅱ/LC3Ⅰ比值升高,p62表达水平降低(P<0.05)。这表明发生H/R后,细胞的自噬作用增强。与H/R组比较,H/R+药物组细胞上清液中LDH活性均显著降低,且H/R+药物组和H/R+自噬抑制剂组细胞中MDC平均荧光强度均显著降低,Beclin-1表达水平和LC3Ⅱ/LC3Ⅰ比值显著减少,p62表达水平均显著升高(P<0.05)。这表明经当归挥发油及自噬抑制剂干预后,细胞的自噬作用受到了抑制。
综上所述,当归挥发油能显著降低H/R损伤心肌细胞H9C2的自噬水平,这一作用与其可降低自噬相关蛋白Beclin-1、LC3Ⅱ、LC3Ⅰ蛋白的表达,增加p62蛋白的表达有关。
参考文献
[ 1 ] 翟恒博,刘俊.缺血性心脏病再认识[J].心血管病学进展,2016,37(4):395-400.
[ 2 ] 吴晓燕,苗琳,郑蕊,等.心肌缺血再灌注损伤的研究进展[J].中国临床药理学杂志,2016,32(11):1043-1045.
[ 3 ] YE Y,YANG M,ZHANG S,et al. Percutaneous coronary intervention versus cardiac bypass surgery for left main coronary artery disease:a trial sequential analysis[J]. Medicine,2017. DOI:10.1097/MD.0000000000008115.
[ 4 ] HAUSENLOY DJ,YELLON DM. Myocardial ischemia- reperfusion injury:a neglected therapeutic target[J]. J Clin Invest,2013,123(1):92-100.
[ 5 ] 谢凤,柳威,陈临溪.自噬参与心脏疾病调控的研究进展[J].生物化学与生物物理进展,2012,39(3):224-233.
[ 6 ] 王晓茹,安芳.自噬及其在脑缺血再灌注损伤中作用机制[J].神经药理学报,2016,6(1):41-48.
[ 7 ] 杨海龙,刘春萍,刘建滔,等.基于自噬探讨丹蒌片减轻心肌缺血再灌注损伤的机制研究[J].中国中西医结合杂志,2020,6(2):2-6.
[ 8 ] 罗慧英,杨林,杨焕,等.当归挥发油对大鼠局灶性脑缺血再灌注损伤的保护作用[J].中国临床药理学与治疗学,2012,17(4):387-391.
[ 9 ] 肖军花,周健,丁丽丽,等.当归挥发油对子宫的双向作用及其活性部位筛选[J].华中科技大学学报(医学版),2003,32(6):589-596.
[10] 李健蕊,柳钟勋,左增艳.当归内酯对小鼠细胞免疫功能的影响[J].中药药理与临床,2004,20(5):13-14.
[11] 冯景奇,柳钟勋.当归多糖及当归内酯对小鼠细胞免疫功能的影响[J].中国免疫学杂志,1998,14(4):279-282.
[12] 冯景奇,柳钟勋.当归内酯拮抗环孢菌素A、氢化可的松及抗肿瘤药物的免疫抑制作用[J].中国免疫学杂志,2000,16(1):22-24.
[13] 肖军花,丁丽丽,周健,等.当归A3部位对心肌生理特性和动作电位的影响[J].中国药理学通报,2003,19(9):1066-1068.
[14] 李敏,孙虹,李琰,等.不同产地当归对血小板聚集及凝血时间活性的比较[J].中国中医基础医学杂志,2003,9(2)∶47-50.
[15] 吴世勇.自噬在曲美他嗪保護心肌缺血再灌注损伤中的作用及机制[D].重庆:重庆医科大学,2019.
[16] 尚颖.自噬抑制剂3-MA增强顺铂对神经母细胞瘤化疗效果及其分子机制的研究[D].石家庄:河北医科大学,2017.
[17] 王晓茹,安芳.自噬及其在脑缺血再灌注损伤中作用机制[J].神经药理学报,2016,6(1):41-48.
[18] 李春明,舒适,钱小路,等.自噬与脑缺血再灌注损伤的研究进展[J].中国脑血管病杂志,2015,12(6):330-333.
[19] KIM H,LEE MS. Autophagy:a key player in cellular and body metabolism[J]. Nat Rev Endocrinol,2014,10(6):322-337.
[20] WANG JF,MEI ZG,FU Y,et al. Puerarin protects rat brain against ischemia/reperfusion injury by suppressing autophagy via the AMPK-mTOR-ULK1 signaling pathway[J]. Neural Regen Res,2018,13(6):989-998.
[21] HUANG YG,TAO W,YANG SB,et al. Autophagy:novel insights into therapeutic target of electroacupuncture against cerebral ischemia/reperfusion injury[J]. Neural Regen Res,2019,14(6):954-961.
[22] LEE YK,LEE JA. Role of the mammalian ATG8/LC3 family in autophagy:differential and compensatory roles in the spatiotemporal regulation of autophagy[J]. Bmb Rep,2016,49(8):424-430.
[23] LAMARK T,SVENNING S,JOHANSEN T. Regulation of selective autophagy:the p62/SQSTM1 paradigm[J]. Essays Biochem,2017,61(6):609-624.
[24] SU H,LIU W. PIK3C3/VPS34 control by acetylation[J].Autophagy,2018,14(6):1086-1087.
[25] KANG R,ZEH HJ,LOTZE MT,et al. The Beclin-1 network regulates autophagy and apoptosis[J]. Cell Death Differ,2011,18(4):571-580.
[26] 單培仁,余灵芳,黄周青,等.调控自噬对H9C2心肌细胞缺氧/复氧损伤的影响[J].心电与循环,2013,32(6):473-477.
(收稿日期:2020-06-14 修回日期:2020-09-21)
(编辑:罗 瑞)
