基于微流控技术的细胞分析仪研制及其应用
2020-11-30吴志成陈卫布宋美嘉王小英吴志红
吴志成 陈卫布 宋美嘉 王小英 游 璠 吴志红
1(北京大学深圳医院 深圳 518036)
2(深圳市人民医院 深圳 518020)
3(深圳市龙岗区慢性病防治院 深圳 518172)
4(中国科学院深圳先进技术研究院 深圳 518055)
5(深圳中科芯海智能科技有限公司 深圳 518116)
1 引 言
白细胞通常被称为免疫细胞,具有细胞核,主要作用是吞噬病原微生物、防御疾病。临床上,白细胞的检测具有非常重要的意义。白细胞升高通常表明患者因细菌感染而导致身体组织和器官的急性或慢性炎症反应或组织损伤,一般需要给予特定的抗生素治疗以控制病情的发展和恶化[1-2]。对于基层医生接诊最多的上呼吸道感染病例来说,白细胞增高往往意味着细菌感染,需要给予抗生素治疗,而白细胞正常或偏低时,无需使用抗生素干预[3-4],因此白细胞计数指标对抗生素用药具有指导作用。在我国基层医疗卫生单位(包括村卫生室、社区卫生站等),由于缺乏白细胞测定的检验设备,医生无从判断患者是细菌还是病毒感染,因此均给予抗生素和抗病毒双重治疗,导致抗生素滥用[5-7]。基层医疗单位血细胞测定设备短缺的原因主要是现有常规血细胞检验设备体积庞大、价格昂贵、操作复杂、试剂消耗大,不适合在基层应用。因此,开发一种成本低廉、操作简便的白细胞检验设备将能很好地适用于基层医疗单位,有效改善抗生素滥用的现状。 随着微流控技术的出现和发展,开发基于微流控技术的即时检验设备(Point-of-Care Testing,POCT)受到广大研究者的青睐[8-9]。基于该技术的即时检验设备正好适合基层医疗单位的使用场景。Wang 等[10]研发了基于微流控纸芯片平台的快速检测血糖血脂的 POCT 装置,该技术有望应用于基层和家庭的个人血糖血脂检测。该研究与本研究的市场目标类似,都致力于解决基层临床检验设备短缺的难题,但检测项目和原理均不相同。王小英等[11]研发了一款基于微流控流式细胞术的荧光微粒计数仪,该仪器对标准荧光微粒测试准确,并对添加了荧光染色剂的白细胞样本也能准确计数。该研究与本研究所使用的技术手段都是微流控技术,但检测原理不同、成本差异大。Zhou 等[12]加工了一种基于阻抗法对液体中颗粒计数的微流控芯片,将库尔特计数小孔设计在通道侧面,颗粒不需要上下穿过小孔就能实现计数,计数灵敏度高,可计数 1 μm 直径的粒子。Lee 等[13]开发了一款基于微流控技术的细胞计数平台,可在芯片上处理脑脊液样本并分别计数其中的白细胞数和红细胞。尽管上述的研究都充分利用了微流控技术体积小、功能集中等特点,但目前仍仅局限于实验室研究,均未形成商品化产品。
作为一种新的技术手段,微流控技术的产业化应用鲜见报道。针对基层检验设备短缺的现状,本文研发了一款适合在基层医疗单位推广应用的微流控血细胞分析仪。本研究设备创造性地利用多层复合结构的微流控芯片代替传统血液检测设备的液路系统,将液体完全封存于芯片内,使其与主机彻底隔离。同时,本研究设备利用微流控技术实现对微量液体的精准控制,结合经典的库尔特原理,实现微粒或细胞的在片整流、在片检测。这一创新性的研究成果已获得了我国食品药品监督管理局颁发的医疗器械注册证,是目前全球首款获批微流控白细胞检测仪的产品。本文通过将所研发设备对商业化的标准粒子检测情况,及临床样本双盲实验的实际检测,来评价其性能和实际的应用效果。
2 实验材料与方法
2.1 仪器与试剂
微流控细胞分析仪 C S 1 7 0 0(序列号:1710001-0001、1710001-0002,深圳中科芯海智能科技有限公司);白细胞分析用溶血剂(深圳中科芯海智能科技有限公司);微流控芯片(深圳中科芯海智能科技有限公司);标准粒子(货号 4K-03、4K-05、4K-10,美国赛默飞世尔科技公司);血细胞分析仪 XN20(希森美康),希森美康 XN20 使用配套的溯源性校准品、质控品和原装试剂。
2.2 实验方法
2.2.1 微流控芯片设计及库尔特阻抗法原理
采用 Coreldraw 和 autoCAD 等制图软件设计微流控芯片流道和构型。通过 GAMBIT 及 Fluent 软件对流道及构型进行了建模及仿真,对其可能产生的“液体死角”现象进行了分析并对流道构型进行了改进。对于影响流体形态及宽度的外界因素(微通道结构、微泵抽吸压力及抽吸时间等)进行了仿真分析,并用 SPSS 回归分析进行了分析,确定了影响流道宽度的主要因素。试验对比了实际流体形态与仿真结果,二者具有较好的一致性。
芯片主要材质为高分子聚合物。通过冲压成型、印刷、对准封装等步骤完成芯片的制作。该微流控芯片结构分为 5 层,通过虹吸和负压驱动液体在上下各层间穿梭流动。其中,库尔特检测小孔位于芯片的中间层,液体由下往上通过检测小孔实现库尔特阻抗计数,具体如图 1 所示。
2.2.2 标准粒子测试
将浓度为 5.00×1010/L、直径为 2.995 μm,浓度为 1.00×1010/L、直径为 4.993 μm,浓度为 1.00×109/L、直径为 10.120 μm 的标准粒子溶液,分别在 CS1700 上重复测定 10 次,然后计算变异系数 CV(Coefficient of Variation)。
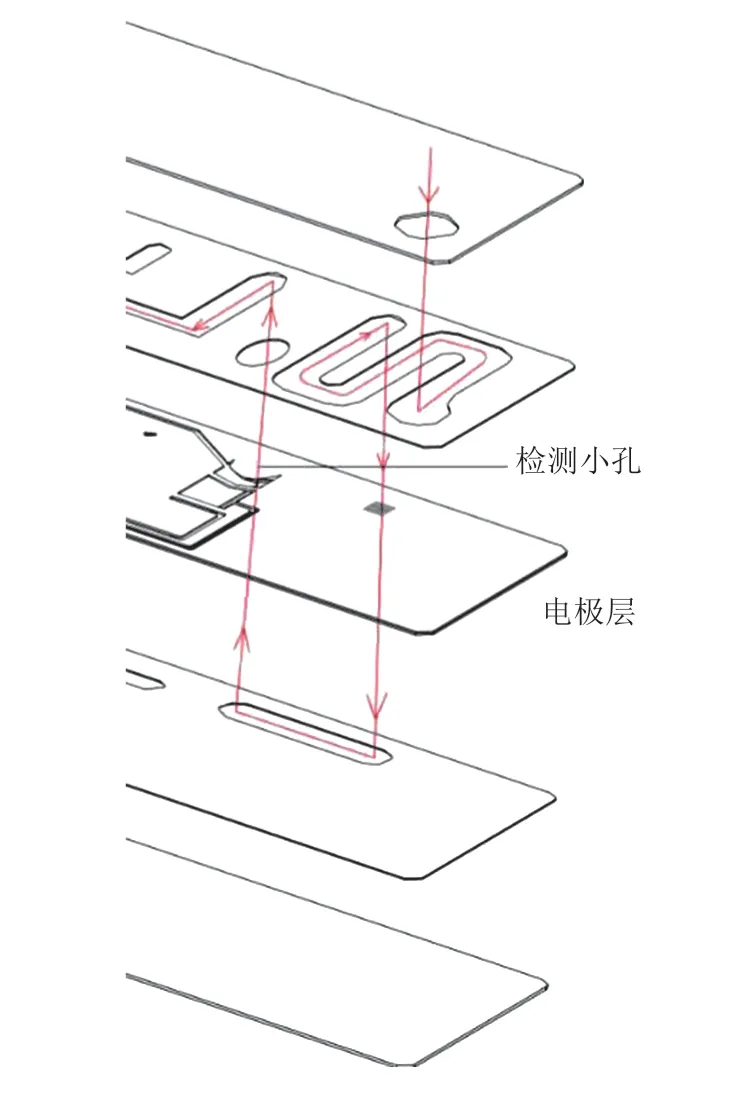
图 1 微流控芯片结构示意图Fig. 1 Structure diagram of microfluidic chip
2.2.3 临床样本测试
在北京大学深圳医院和深圳市人民医院各选取临床血液样本 120 例。样本均为医院患者临床检测所剩的离体 EDTA-2K 抗凝血样本。试验以希森美康 XN20 上的白细胞测试值为对照值,以 CS1700 上的白细胞测试值为试验值,采用统计学方法分析两者的相关性和一致性等[14]。
3 结 果
3.1 设备及芯片外观
本文中所用微流控芯片为深圳中科芯海智能科技有限公司设计和生产的多层复合结构的微流控芯片,其外观如图 2(a)所示,芯片长、宽、高分别为:76 mm、20 mm 和 1.2 mm。CS1700 外观如图 2(b) 所示,外观长、宽、高分别为:25 cm、12 cm 和 26 cm。
3.2 标准粒子测试结果
3.2.1 标准粒子脉冲信号
库尔特电阻抗计数法的原理是悬浮在电解液中的颗粒随电解液通过小孔管时,取代相同体积的电解液,在恒电流设计的电路中导致小孔管内外两电极间电阻发生瞬时变化,产生电位脉冲。脉冲信号的大小和次数与颗粒的大小和数目成正比[15-16]。图 3(a)、(b)和(c)分别是本文在测试标准粒子(3 μm、5 μm 和 10 μm)时的脉冲信号,图 3(d)是在显微镜下捕捉的 3 μm 粒子通过计数小孔(直径 40 μm)时的瞬时照片。

图 2 微流控芯片和 CS1700 Fig. 2 Microfluidic chip and CS1700
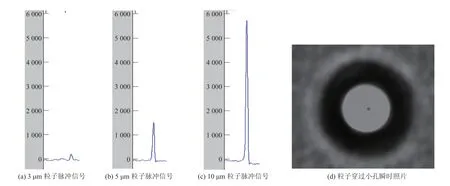
图 3 检测脉冲信号和粒子过孔瞬间照片Fig. 3 Pulse signals of particles test and instant image of particle passing through orifice

表 1 标准粒子计数结果Table 1 Count results of standard particle
3.2.2 标准粒子计数结果
将直径和浓度不同的 3 种标准粒子分别在 CS1700 上各重复测定 10 次,统计测试结果均值和变异系数,结果如表 1 所示。从表 1 可看出,设备对不同浓度、不同直径的标准粒子的计数结果重复性良好。
3.3 临床样本测试结果
3.3.1 临床样本入选情况汇总
根据医院检验科血细胞分析仪希森美康 XN20 上的白细胞测试结果,共选取了 240 个样本,具体分布如表 2 所示。随后以希森美康 XN20 上的白细胞测试值为对照值,以 CS1700 上的白细胞测试值为试验值进行统计学分析。
3.3.2 相关性及回归分析
设测试值为 Y,相对应的对照值为 X 作散点图,结果如图 4 所示。从图 4 可看出,线性回归系数 R2=0.999 7>0.95,表明两设备(XN20 和 CS1700)相关性良好。
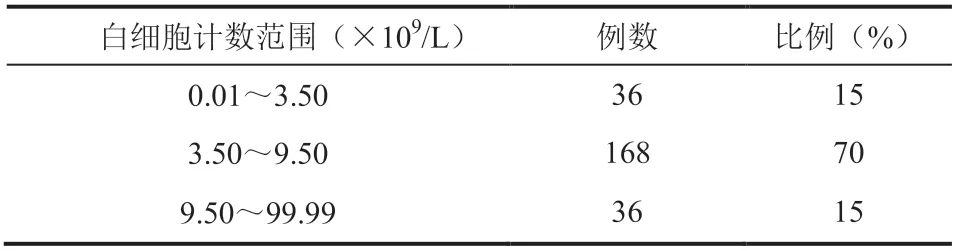
表 2 入组样本分布情况Table 2 Distribution of enrolled samples
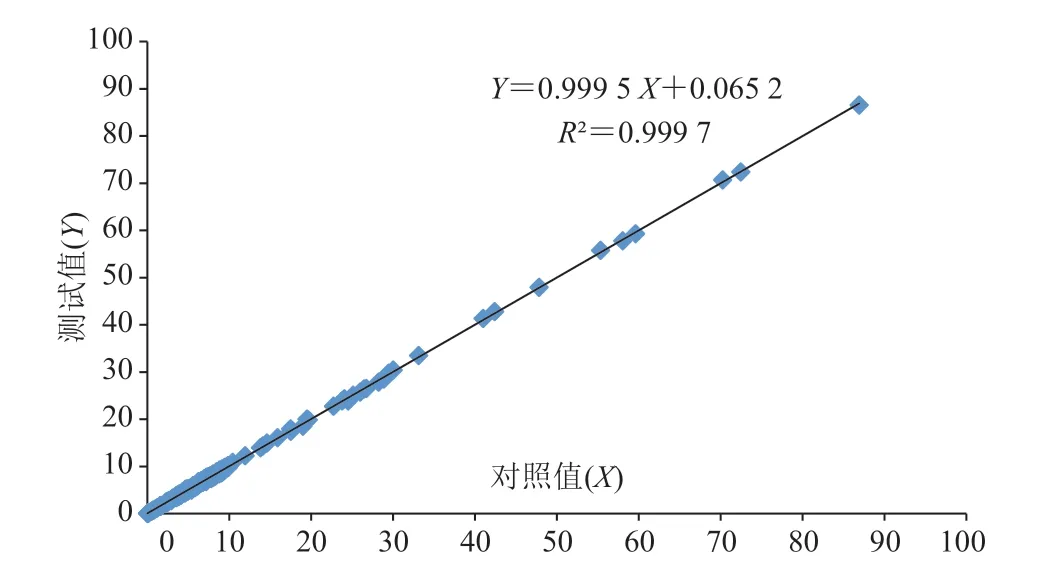
图 4 散点图Fig. 4 Scatter diagram
3.3.3 Bland-Altman 一致性分析
根据测试值和对照值计算出一致性界限(均值±1.96 标准差)及一致性界限上下限的 95% 可信区间。如果 95% 的点都在一致性区间内,那么认为两种方法的定量测定结果一致性好[17]。试验设备与对照设备测量值的 Bland-Altman 图如图 5:全部样本共 240 例,位于一致区间内的点有 228 例(95%)。这表明,试验设备与对照设备具有良好的一致性。
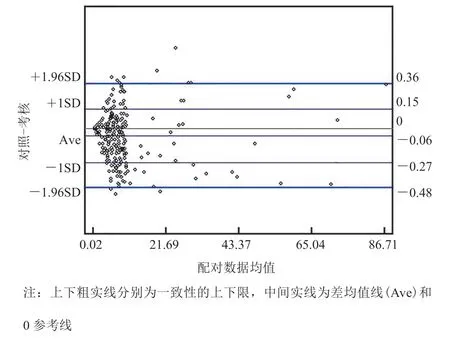
图 5 样本 Bland-Altman 图Fig. 5 Bland-Altman figure
3.3.4 医学决定水平预期偏倚
根据前面已建立的回归方程,以医学决定水平作为自变量(Xc),计算因变量(Yc),再依据 Xc和 Yc算出预期偏倚(Bc)、系统误差(System Error,SE)和相对偏倚[18]。以美国临床实验室改进修正法案(CLIA88)中规定的总容许误差(Total Allowable Error,TAe)的 1/5 作为判断标准:当系统误差 SE 小于或等于 1/5 TAe 时,则认为偏倚可接受;当系统误差 SE大于 1/5 TAe 时,则认为偏倚不可接受。将医学决定水平 Xc=3.00×109/L、11.00×109/L和 30.00×109/L,代入回归方程,计算系统误差 SE。获得 SE 分别为 2.12%、0.54% 和 0.17%,参考临床可接受性能的判断标准[SE=3%<1/5 TAe]可知,3 个水平均可接受[19]。具体计算结果如表 3 所示。
4 讨论与分析
试验结果显示,微流控白细胞分析仪 CS1700 及其配套的微流控芯片,对标准粒子的重复测定实验,变异系数均不大于 5%,精密度良好。在两家具有临床试验资格的医疗机构进行临床试验,共完成血液样本 240 例,其中正常值样本 70%,异常值样本 30%(异常高值及异常低值比例为 1∶1)。CS1700 和 XN20 测定结果相关性强(R2=0.999 7),回归方程 Y=0.999 5X+0.065 2;试验设备与对照设备测量值的 Bland-Altman 作图可知,95% 的点在一致性区间内,表明试验设备与对照设备具有良好的一致性;北京大学深圳医院和深圳市人民医院的临床试验中心合计医学决定水平处的预期偏倚及可信区间分析显示,白细胞计数在 3 个医学决定水平处(3.00×109/L、11.00×109/L 和 30.00×109/L)的可接受误差均小于 1/5 TAe,表明两个试验设备检测结果的偏倚在各医学决定水平处均可以接受。上述两实验中心均没有出现影响整机安全性的情况,试验设备与对照设备的质控记录均在各自的质控靶值范围,稳定性良好。试验期间,试验组和对照组均未出现任何不良事件和严重不良事件。
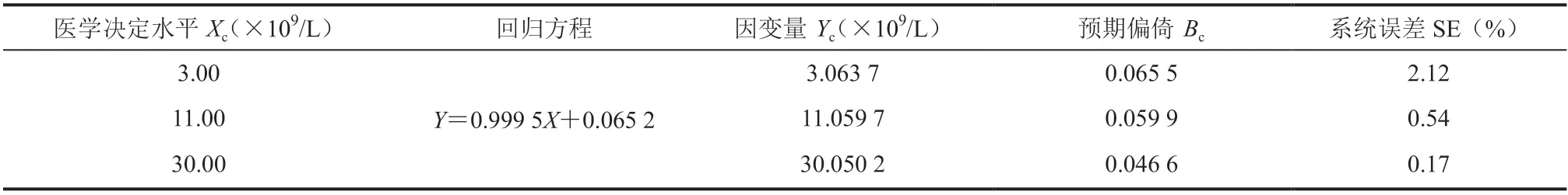
表 3 医学决定水平处的相对偏倚百分比Table 3 Relative bias at the medical decision levels
经过比对试验发现,基于微流控芯片的白细胞检测平台具有以下优势:(1)检测灵敏度高,对白细胞的测试灵敏度比血细胞行业标准高出 1 个数量级,达到 0.01×109/L。本文选取了 0.02×109/L、0.04×109/L、0.05×109/L 和 0.08×109/L 四个低浓度血液样本进行测试,与对照机的相对偏差分别为 0、0、6.67% 和 4.17%,均低于行业标准范围的 1/2(即 7.5%)。同时,这些样本也进行了镜检复检,结果与机器测试结果高度一致。(2)由于液体与设备完全分隔,芯片即用即抛,完全摒弃了传统的清洗维护等步骤,使用简便。同时,液路的一次性使用也杜绝了携带污染,保证结果的准确。与传统的血细胞分析设备特征指标相比,CS1700 具有便携、无携带污染、所需试剂少、灵敏度高、无需专业人员操作等优点。

表 4 CS1700 与传统血细胞分析仪的比较Table 4 Comparison of CS1700 and traditional hematology analyzer
但目前该设备也存在一些缺陷:(1)功能单一,仅能测试白细胞总数,后续需尽快完善对白细胞的分类功能;(2)缺乏对有核红细胞分辨的功能。在临床样本测试过程中,对于几个在 XN20 上提示有核红细胞增多的样本,我们在 CS1700 上进行了测试,发现其测试的白细胞值比 XN20 上报道的白细胞值高。因此,推测 CS1700 把有核红细胞计算在白细胞总数内,表明 CS1700 在进行白细胞计数时,不能排除有核红细胞的干扰,这也对后续的改进及升级提出了进一步的要求。
5 结 论
本文是我国及全球首款获得微流控白细胞分析设备医疗器械注册证的 POCT 仪器临床应用研究,首次公布了该设备在标准粒子检测、临床双中心试验的结果。虽然微流控技术从提出至今广受瞩目,但真正应用于产业化的产品十分鲜见,应用于临床血液细胞的快检设备,更属首次。为了确保临床使用的准确性及一致性,本文利用微流控技术实现对微量液体的精准控制,结合库尔特阻抗计数法,用多层复合结构的微流控芯片代替传统的液路系统,实现了微流控技术在临床快检领域的产业化应用。临床测试表明,该设备及配套芯片的检测结果,与业内公认的高端设备希森美康 XN20 的测试结果具有可比性。但目前该设备依然有较大的技术提升空间,为后续研发指明了方向。基于微流控技术实现 POCT 检验设备研发和应用的逐步发展和成熟,将助力分级诊疗,完善基层医疗机构的检验手段与诊断水平。
