CD317 在肿瘤发生发展及治疗方面的研究进展
2020-11-30万晓春章桂忠
万晓春 章桂忠 邓 湉 陈 倩
(中国科学院深圳先进技术研究院 生物医药与技术研究所 深圳 518055)
1 引 言
CD317(BST-2、HM1.24 或 Tetherin)由 BST-2 基因(Gene ID:684,定位于染色体 19p13.2 上)编码[1],是一个结构独特的 II 型跨膜糖蛋白[2]。该蛋白氮端和碳端各有一个膜结合位点,中间是一个比较大的胞外卷曲螺旋结构域(Extracellular Coiled-coil Domain),总体呈“桥式结构”横跨在细胞膜上[3-4]。氮端单次跨膜(Transmembrane Domain),胞内含有一个较短的胞质尾区(Cytoplasmic Tail)。胞质尾区可与 LRPPRC 或 MARCH8 结合诱导细胞自噬过程[5-6],或通过其上的 YxY 基序招募接头蛋白,发挥信号激活[7-8]、介导内吞[9]以及细胞骨架调控等功能[10];胞外结构域能够与 ILT7 及一些未知蛋白结合,发挥免疫调控作用[11-14]。碳端通过糖基磷脂酰肌醇基序(Glycosylphosphatidylinositol Motif,GPI Motif)锚定到脂筏(Lipid Raft)上,调控脂筏动态及其上锚定蛋白的分布[15-16]。由于这种独特的结构,CD317 可以通过物理方式将人类免疫缺陷病毒(Human Immunodeficiency Virus,HIV)等囊膜病毒(Enveloped Viruses)[3,17]以及外泌体[18]束缚在细胞表面。切除或突变任何一个膜结合位点均会导致 CD317 丧失束缚功能[17,19-21]。而被 CD317 束缚的病毒颗粒或驻留在细胞表面,或被宿主细胞内吞后通过泛素依赖途径降解[22-23],从而抑制病毒的扩散。此外,CD317 还可以通过激活 NF-κB[24]、增强自然杀伤细胞(Natural Killer Cell)介导的杀伤、抗体依赖的细胞毒作用(Antibody-Dependent Cellular Cytotoxicity, ADCC)等[25-26]发挥抗病毒功能,或通过促进 MAVS 降解抑制 RLR 介导的干扰素产生,控制抗病毒免疫强度从而降低免疫紊乱的风险[5]。近年来,越来越多的研究表明,CD317 不仅仅是一个抗病毒蛋白,而且在多种类型的肿瘤中表达上调并参与肿瘤的发生发展,是肿瘤治疗的一个潜在靶点[3,27-29]。因此,本文重点关注 CD317 在肿瘤方面的研究进展,总结 CD317 在肿瘤中的表达模式、作用机制以及靶向策略的相关研究,以期为肿瘤相关理论研究、治疗策略开发提供新的思考和方向。
2 CD317 在多种肿瘤中高表达且与预后不良直接相关
1994 年,Goto 等[2]利用单克隆抗体发现了一个终末分化 B 细胞的限制性表面抗原,命名为 HM1.24,此即为 CD317。该抗原主要表达于人骨髓瘤细胞系、多发性骨髓瘤以及从多发性骨髓瘤、华氏巨球蛋白血症(Waldenström’s Macroglobulinemia)患者的骨髓或外周血中获取的肿瘤浆细胞上,而在肝、脾、肾等健康组织中基本不表达或低表达。由于这种差异表达模式,CD317 被认为是骨髓瘤治疗的潜在靶点[30-31],引起了领域内众多科学家的关注。此后,越来越多证据表明,CD317 过表达不仅仅局限在骨髓瘤中,其在子宫内膜癌[32-33]、头颈部鳞状细胞癌[34]、乳腺癌[35-37]、胃癌[38-40]、结肠癌[39,41]、胶质瘤[42-43]、口腔鳞状细胞癌[44]、肾细胞癌[45-46]、胰腺内分泌肿瘤[47]、急性 B 淋巴细胞白血病[48]、以及肝癌[16]等恶性肿瘤中的表达也显著上调,并且表达水平与肿瘤进展、扩散程度或患者不良预后等指标呈正相关[37,39-41,44-46,49]。不仅如此,在多数肿瘤细胞中,利用 siRNA 敲减 CD317 能够显著抑制癌细胞增殖、迁移或促进药物诱导的细胞死亡,利用 shRNA 或单克隆抗体也能有效抑制小鼠移植瘤的发生发展,延长荷瘤小鼠生存期[16,29,39,43,50-53]。基于这些研究,可以确定 CD317 促进肿瘤发生发展,是一个潜在的治疗靶点,因此,不少研究人员开始关注 CD317 在肿瘤中的表达调控及其分子机制,并尝试开发靶向 CD317 的抗肿瘤策略。
3 CD317 在肿瘤中过表达的分子机制
CD317 编码基因定位于染色体 19p13.2 上,启动子区含有多个连续重复的 STAT3 结合位点、多个 AP2 结合位点以及 ISGF3、IRF1/2/7、CREB、SP1、GATA1、NF-AT 等转录因子结合位点[31,54-55],因此可以被肿瘤坏死因子 α(TNF-α)、干扰素(INF-α/β、INF-γ)等细胞因子[56-57]以及 GATA1[54]、未活化的 STAT1[58]等转录因子诱导表达。在多数肿瘤细胞中,CD317 过表达的主要原因也是转录增强[16,32,34,37],这可能是肿瘤微环境中的一些细胞因子激活了上述转录因子导致的。研究发现,乳腺癌细胞中的 CD317 表达水平与 TGF-β 有关,在恶性程度较低的乳腺癌细胞中,转录因子 AP2 被 TGF-β 激活并结合到 CD317 启动子上从而抑制 CD317 表达;而在高恶性程度的乳腺癌细胞中存在 TGF-β 抵抗现象,导致 AP2 活化障碍,CD317 表达增强[37]。在骨髓瘤中,IL-6 是癌细胞自分泌/旁分泌的生长因子,能够促进 STAT1 和 STAT3 的磷酸化,这可能是骨髓瘤中 CD317 过表达的主要原因[31]。尽管目前还没有直接的证据,但这一猜想已在其他癌细胞中得到了验证。Yi 等[59]研究发现,乳腺癌细胞中 CD317 的表达和启动子活性都受控于 STAT3 的活化水平。有意思的是,在一些正常细胞(如人脐静脉内皮细胞 HUVEC[56]或外周血单核细胞 PBMC[60])中,单纯的 IL-6 刺激虽然能够激活 STAT3,但并不能引起 CD317 表达上调[60]。该现象提示 IL-6/STAT3 对 CD317 表达的调控作用可能具有细胞特异性,至少在正常细胞和癌细胞中存在较大差异,这可能是正常细胞和癌细胞基因甲基化程度不同造成的。研究发现,在胶质瘤[42]、乳腺癌[61]以及宫颈癌[62]组织中,CD317 基因的甲基化水平远比正常组织低。这种低甲基化状态可能使 STAT3 更容易接触并结合到启动子区,诱导 CD317 表达。此外,肿瘤 CD317 高表达的另一个原因在于转录后调控异常。研究发现,CD317 是 miR-451a 和 miR-760 的靶基因,正常情况下 CD317 的表达被这两个 miRNA 严格控制。但在肿瘤细胞中,由于 miR-451a 和miR-760 表达下调,对 CD317 的抑制作用被削弱,导致 CD317 过表达[46,63]。综上所述,CD317 在肿瘤中的表达受肿瘤微环境特异的细胞因子组成、表观遗传差异的影响,在表观遗传修饰、转录激活以及转录后等层面被精确调控。
4 CD317 在肿瘤发生发展中的作用机制
CD317 在肿瘤细胞中高表达,在肿瘤细胞增殖、迁移、凋亡抵抗等方面都有重要的作用(详见表 1),但其中的分子机制还不是很清楚。目前已知的受 CD317 调控的信号通路主要有 NF-κB 和 EGFR 等(图 1)。2013 年,Tokarev 等[7]发现,除了束缚病毒,CD317 还具有激活 NF-κB 的功能。该功能的实现依赖于 CD317 胞质尾区的 YxY 基序与 TAK1、TAB1 等信号转导蛋白的结合。Galão 等[24]的研究成果进一步证实了 CD317 对 NF-κB 的激活作用,不同的是,他们认为 CD317 的胞质尾区可能含有一个半免疫受体酪氨酸激活基序(Hemi-Immunoreceptor Tyrosine-Based Activation Motifs,hemITAMs),
通过 hemITAMs 招募 Syk 从而激活 NF-κB。鉴于 NF-κB 信号在肿瘤发生发展过程中的重要作用[70],一些研究团队开始关注 CD317/NF-κB 信号轴在肿瘤中的作用。2017 年,Kuang 等[68]发现 CD317 在顺铂耐药的鼻咽癌细胞中表达上调,通过激活 NF-κB 信号促进 BCL-XL 及 Livin 等抗凋亡蛋白的表达,从而抑制顺铂诱导的细胞凋亡。该研究利用基因干扰技术敲减 CD317 显著增强顺铂的抗肿瘤效果,临床资料分析结果也显示,CD317 高表达的局部进展期鼻咽癌患者接受铂类化疗的预后比低表达患者差,进一步证实了 CD317 介导鼻咽癌的铂类耐药。Liu 等[40]也发现,在体外利用 siRNA 敲减胃癌细胞 CD317 明显降低 NF-κB 信号的活化水平,进而抑制胃癌细胞增殖、迁移,并促进细胞凋亡。除了 NF-κB,EGFR 信号轴是另一条被证实且作用机制较为明确的 CD317 调控通路。Pham 等[45]发现,CD317 在肾细胞癌中过表达,且表达水平与肿瘤分期、病理分级以及生存期等相关,提示 CD317 在肾细胞癌的发生发展中起重要作用。进一步的研究发现,敲减肾癌细胞 CD317 显著降低 EGFR 及下游 ERK、AKT 活化水平,抑制癌细胞的增殖和侵袭。Mukai 等[39]也发现,在胃癌细胞系中敲减 CD317 能够降低 EGFR-ERK/AKT 的活化水平,从而抑制肿瘤细胞生长。Zhang 等[16]的研究结果进一步证实了 CD317 对 EGFR 信号的调控作用并较详细地阐述了其中的分子机制:CD317 在肝细胞癌中表达上调,促进 EGFR 从脂筏到非脂筏细胞膜的转位,从而激活 EGFR 及下游 ERK、STAT3 等信号通路,加速细胞周期进程,促进肝癌细胞增殖及肿瘤发展(图 2(a))。此外,CD317 还可以直接激活 ERK 或其他信号通路帮助癌细胞抵抗环境压力(营养缺乏、失巢等),维持细胞生存。Mahauad-Fernandez 等[8]发现,在乳腺癌细胞中,CD317 二聚体化后通过磷酸化修饰的方式激活,然后招募接头蛋白 GRB2 促进 ERK 活化(图 1),后者进一步将促凋亡蛋白 BIM 磷酸化使其被蛋白酶体降解,抑制肿瘤细胞失巢凋亡。Li 等[67]的研究发现,在营养压力下,CD317 可以抑制线粒体损伤及 AIF 释放、核转位等过程,维持细胞生存(图 2(b)),但上游的分子机制尚不清楚。自噬在能量代偿及清除受损细胞器(如线粒体)、维持细胞生存方面发挥重要的作用[71]。肿瘤发展过程中(尤其到了晚期),癌细胞往往通过提高自噬水平促进增殖或提高其在压力下的生存能力[72-73]。考虑到 CD317 具有激活自噬的作用[5-6],Li 等[67]曾推测 CD317 可能通过自噬帮助癌细胞清除受损的线粒体,或为其提供能量及大分子前体,促进癌细胞在营养压力下的生存。但这一猜想在其实验体系中并没有得到证实,抑制自噬流对 CD317 维持癌细胞生存的作用基本没有影响。考虑到自噬流的复杂性以及条件依赖性[69],目前尚无法确定 CD317 介导的自噬在肿瘤发生发展过程中的作用。
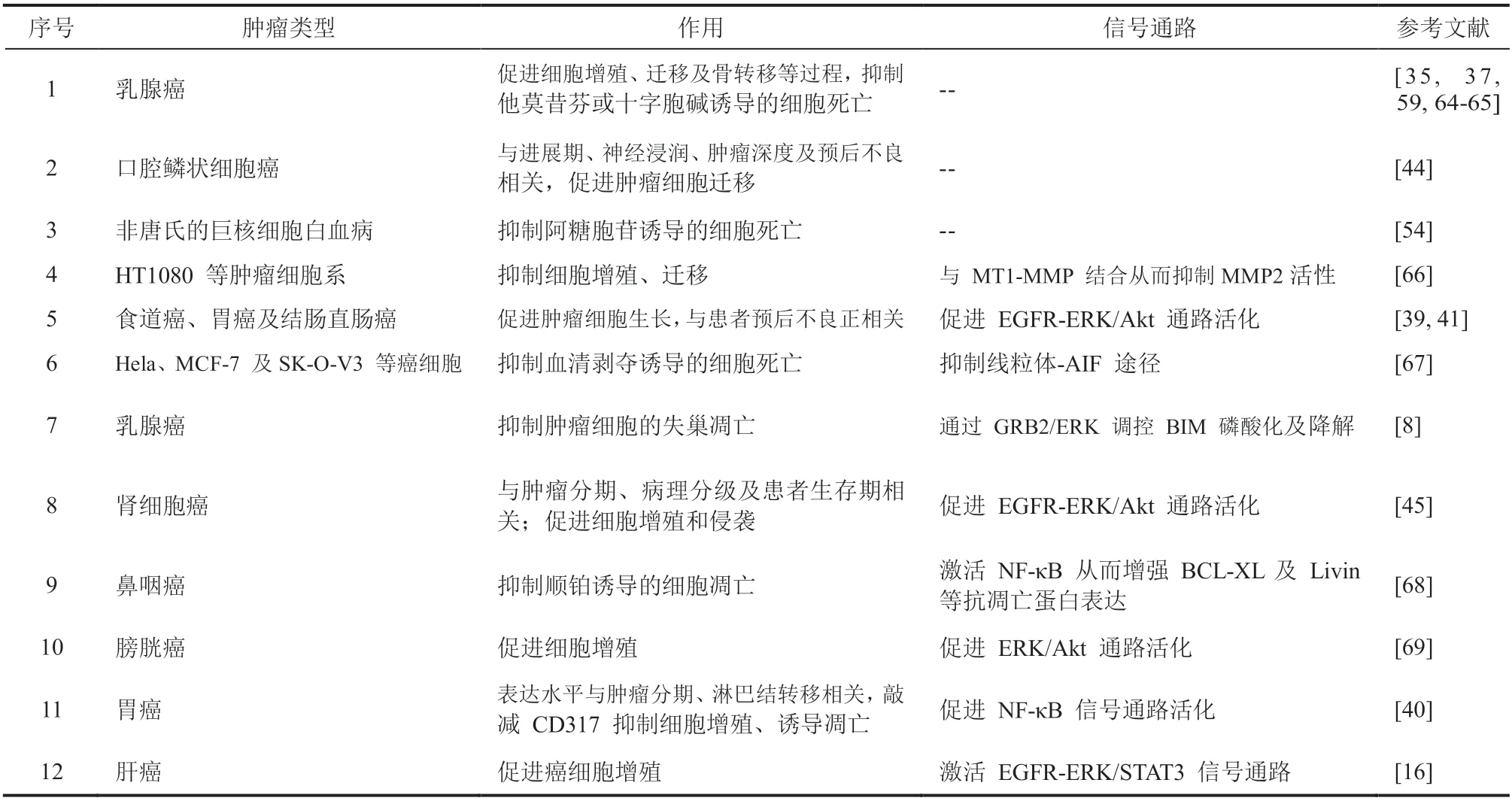
表 1 CD317 在肿瘤发生发展过程中的作用机制Table 1 The role of CD317 in tumor development
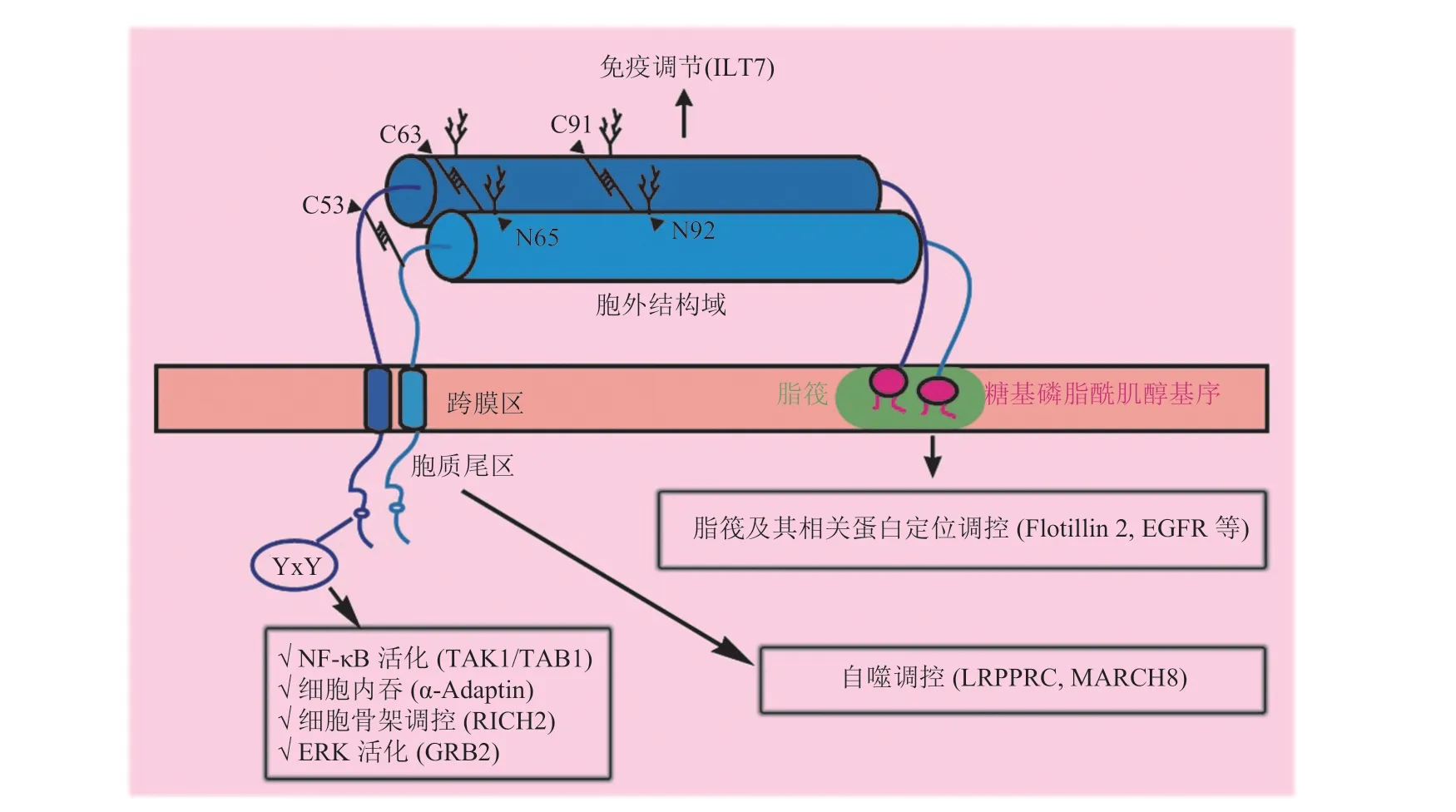
图 1 CD317 结构及相关功能示意图Fig. 1 Illustration of CD317’s topology and functions
除了影响癌细胞生物学进程外,CD317 可能还具有促进肿瘤细胞免疫逃逸的功能。2018年,Yang 等[49]发现 CD317 在头颈鳞状细胞癌(HNSCC)中表达上调,且表达水平与患者预后相关。进一步分析发现,CD317 表达水平与组织学分级、肿瘤大小、淋巴结转移等病理指标没有相关性,而与免疫检查点分子 PD-L1、B7-H3、B7-H4 及肿瘤相关巨噬细胞标志物(CD68、CD163)高度相关,提示 CD317 在头颈鳞状细胞癌中可能通过免疫调控促进癌细胞的免疫逃逸。此外,CD317 能够与类浆树突状细胞(pDCs)上的 ILT7 结合,抑制其活化[12-13]。鉴于在多数实体肿瘤中,pDCs 以非激活状态存在,并参与构成免疫抑制性的肿瘤微环境[74],因此猜测 CD317 与 ILT7 的相互作用可能是通过影响肿瘤微环境中 pDCs 的活性,从而促进肿瘤的免疫逃逸[59-60]。近几年,本文作者团队也开展了 CD317 在肿瘤免疫方面的作用研究,发现 CD317 介导了一种新的肿瘤免疫逃逸机制,即通过调控癌细胞骨架抵抗免疫杀伤。利用 siRNA 敲减 CD317 后,肿瘤细胞骨架相关基因的转录水平降低,对穿孔素介导的透膜效应及免疫杀伤也更为敏感(图 2(c),待发表)。因此,靶向 CD317 能够增强肿瘤免疫治疗效果。综上所述,CD317 可以通过影响癌细胞生物学行为(细胞增殖、凋亡等)或免疫调控,促进肿瘤的发生发展,是肿瘤治疗的一个潜在靶点。
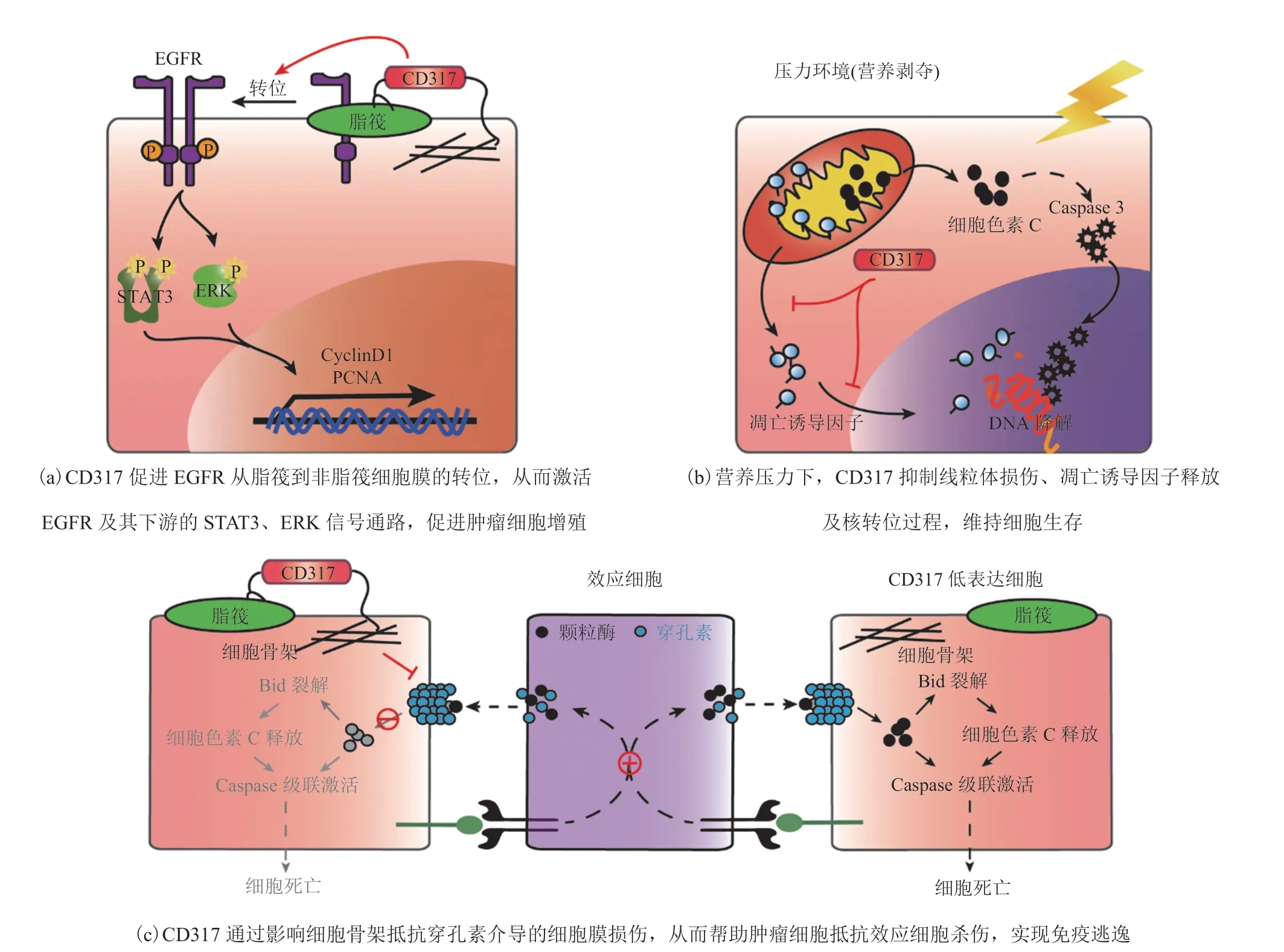
图 2 CD317 影响肿瘤细胞增殖、生存及免疫逃逸的机制Fig. 2 Mechanisms of CD317-mediated tumor cell proliferation, survival and immune escape
5 靶向 CD317 治疗肿瘤研究进展
CD317 是一个肿瘤相关的膜蛋白,因此是抗体或免疫细胞治疗的潜在靶点之一。目前在研的多数 CD317 靶向策略都是基于抗体、细胞毒 T 细胞(Cytotoxic T Lymphocytes,CTL)等开展的,涉及的肿瘤以骨髓瘤居多,涵盖了肺癌、肾细胞癌、子宫内膜癌等实体瘤(详见表 2)。总体研究进展缓慢,多数处于临床前研究阶段,主要的障碍可能有两个方面:靶点特异性和肿瘤微环境。CD317 在多种正常组织中有不同程度的表达[75],故抗体和 CTL 治疗时可能会损伤健康组织,限制了其临床应用。因此,后续应该进一步研究肿瘤细胞和正常细胞中 CD317 表达调控的分子机制差异,并开发特异性诱导肿瘤细胞 CD317 表达的药物,通过联合应用的方式增强抗体或 CTL 的抗肿瘤效果,尽可能降低脱靶毒性。另一方面,实体瘤往往建立了很复杂的抑制性微环境,这对抗体和 CTL 等介导的肿瘤免疫治疗都是极为不利的[89-90]。pDCs 是肿瘤微环境的重要组成细胞[74,91-92],利用 CD317 抗体清除 pDCs 细胞能够增强机体抗肿瘤免疫反应,抑制头颈部鳞状细胞癌的进展[88]。因此,可以考虑将 CD317 抗体与 CTL 联用,利用 CD317 抗体清除 pDCs 以打破免疫耐受,增强 CTL 的抗肿瘤效果。此外,CD317 在 pDCs 上高表达,利用抗体将抗原靶向递送到 pDCs 上,增强免疫应答[93-94],可能是一种极具潜力的肿瘤治疗性疫苗设计方案。
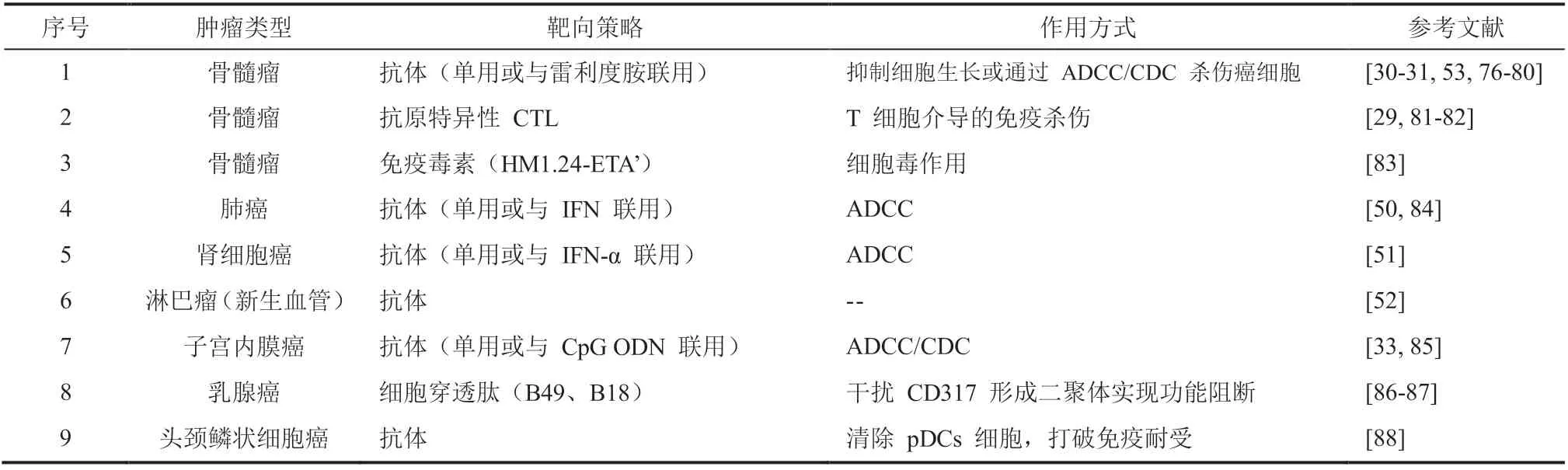
表 2 靶向 CD317 的肿瘤治疗潜在策略Table 2 Potential strategies for tumor treatment targeting CD317
除了抗体,一些调控 CD317 表达的药物或方法也是肿瘤治疗的潜在选择。比如,白藜芦醇[37]、小 RNA(miR-451a[46]与 miR-760[63])以及人工设计的 siRNA 等,它们都能降低肿瘤细胞中 CD317 表达,从而抑制肿瘤细胞增殖、迁移或促进药物诱导的凋亡。尽管如此,由于这些策略都是通过降低蛋白表达水平发挥作用,对 CD317 功能的抑制是全覆盖式的,因此还需考虑安全性的问题。目前我们对 CD317 生理功能的了解还不够全面,这种全面打击的方法是否会引起严重的副作用尚不明确。从这个角度看,基于结构和功能认识,开发选择性的抑制剂可能是更好的选择。一些研究团队已经成功开发出 B49[86]、B18[87]等小肽类抑制剂。其中,B49 是一种人工设计的细胞穿透肽,进入细胞后可以干扰 CD317 二聚体的形成,从而抑制乳腺癌细胞粘附、增殖等过程,发挥抗肿瘤作用[86]。更重要的是,B49 在小鼠模型中没有明显的毒副作用[86]。B18 是 B49 的改良版,是通过构效关系(Structure-Activity Relationship)研究设计的结构更小的 CD317 抑制肽,在体外实验中表现出良好的抗肿瘤活性[87]。此外,CD317 胞内胞质区可以招募 Syk[24]或 GRB2[8],激活下游 NF-κB 或 ERK 信号,因此,后续也可以针对它们的结合位点设计小分子抑制剂,为 CD317 驱动型肿瘤治疗提供更多选择。
6 结论与展望
历经手术、放化疗、分子靶向治疗以及正在兴起的免疫治疗这一发展历程后,我们在肿瘤治疗方面的选择越来越多,但总体治疗水平仍有待提高。肿瘤发病机制研究和治疗策略开发依然任重道远。新靶点的发现、开发利用不仅能为患者提供更多的选择,也是临床上提高疗效、解决耐药等问题的强大助力。CD317 在多种肿瘤中过表达,与疾病进展、患者预后等指标相关,是一个潜在的肿瘤诊断、治疗靶点。基于临床前的研究结果,CD317 也体现了其在肿瘤诊疗方面的应用潜力。再者,CD317 的结构独一无二,其发挥功能的机制也必然与众不同,潜藏其下的可能是一种全新的作用模式。因此,后续应该进一步加强对 CD317 的理论和应用研究,发现更多的功能和更深入的分子机制,推动理论进步以及相关靶向治疗策略的开发利用。
目前已知的 CD317 功能,包括束缚病毒、激活 NF-κB、EGFR 或 ERK 等信号,都依赖于其独特的结构。因此,B49 等干扰 CD317 结构形成的小分子肽可能是目前已知的、在疾病治疗中较有潜力的方法,但其安全性还需进一步的验证。尽管 CD317 敲除不影响小鼠生殖发育,但目前尚不明确长期的 CD317 功能缺陷是否存在其他安全隐患。后续还应进一步研究 CD317 的生理、病理功能,尤其是区分单体、二聚体在生理和病理状态下的功能差异,为进一步优化靶向 CD317 的疾病治疗策略提供理论基础。
