颅脑MRI 增强扫描联合纹理分析技术在鉴别脑胶质瘤与脑转移瘤中的价值
2020-11-30彭勇,王亮
彭 勇,王 亮
(湖北省武汉市第一医院医学影像科,湖北 武汉 430022)
成年人颅内原发性肿瘤约占全身肿瘤的2%,其他部位的恶性肿瘤20%~30%也可转移至颅内[1]。脑肿瘤发病率虽较其他部位的恶性肿瘤低,但其死亡率较高,同时脑转移瘤与原发性脑肿瘤的发病率相似[2]。手术治疗仍是目前治疗颅内肿瘤的首选方法,但手术成功与否和肿瘤恶性程度、大小、肿瘤生物学边界的确定及其与周围结构的关系密切相关[3],因此正确诊断及鉴别脑肿瘤并准确评估其恶性程度直接影响手术效果[4-7]。脑转移瘤和脑胶质瘤是颅内常见恶性肿瘤,临床常将MRI 检查作为其首选影像检查方法,当移转瘤为单发病灶且缺乏原发肿瘤病史时,两者在常规影像学上较难鉴别[8-9]。研究[10-12]表明,使用纹理分析软件对图像上的肿瘤区域进行分割并行纹理分析,可提取出图像中的特征性参数进行差异性对比,量化分析肿瘤影像学异质性,提供肉眼无法识别的客观信息,且不依赖于影像科医师的经验和主观判断,具有较大的临床应用价值。本文将探讨MRI 增强扫描结合纹理分析鉴别脑胶质瘤与脑转移瘤的价值。
1 资料与方法
1.1 一般资料 回顾性收集2018 年10 月至2019年10 月我院确诊的脑肿瘤患者60 例,男38 例,女22 例;年龄24~83 岁,中位年龄60 岁。其中脑胶质瘤34 例,男20 例,女14 例;年龄44~83 岁,中位年龄64 岁;脑转移瘤26 例,男14 例,女12 例;年龄39~81 岁,中位年龄67 岁。2 组年龄比较,差异无统计学意义(F=0.113,P=0.738)。纳入标准:①术前或放化疗前接受颅脑MRI 平扫及增强扫描;②经手术或立体定向活检获得病理学诊断结果。排除标准:①图像存在伪影;②病灶区域出现大范围出血、坏死;③病理结果不明确。
1.2 仪器与方法 采用GE Signa HDxt 3.0 T 超导型MRI 扫描仪,8 通道头部线圈。患者取仰卧位,头先进。扫描序列与参数:轴位T1FLAIR TR 2 500 ms,TE 24 ms,TI 860 ms;FSE T2WI TR 8 000 ms,TE 165 ms,TI 2 100 ms;对比增强扫描采用自旋回波序列轴位T1WI+C 及冠矢状位T1FLAIR TR 400 ms,TE 9 ms;以上序列视野220 mm×220 mm,矩阵512×512,层厚6 mm,层距2 mm。增强扫描采用对比剂Gd-DTPA,剂量0.2 mmol/kg 体质量,经手臂静脉快速注入,5 min后扫描。
1.3 图像处理 所有患者的最终诊断结果由2 名主任医师共同审核得出,意见不同时,讨论得出。图像分析和处理由1 位高年资放射科医师独立进行,将图像保存成DICOM 格式保存,后用MaZda 软件行后处理。参考MRI 平扫和增强扫描图像,在肿瘤实质区、强化病灶周围1 cm 范围内勾画ROI,避开血管、囊变、坏死及出血部分,脑胶质瘤病灶、脑转移瘤病灶分别标记为红色、绿色ROI(图1,2)。ROI 勾画完成后,软件即可自动计算出ROI 的各项纹理参数值。
1.4 统计学分析 使用MaZda 软件对脑胶质瘤组与脑转移瘤组中病灶纹理参数进行筛选,采用直方图、绝对梯度、游程矩阵、共生矩阵和自回归模型5种分析方法共可获得256 个纹理参数。通过一元特性、二元特性、三元特性3 种统计学筛选方法,筛选出10 个鉴别脑胶质瘤与脑转移瘤的最佳纹理参数。
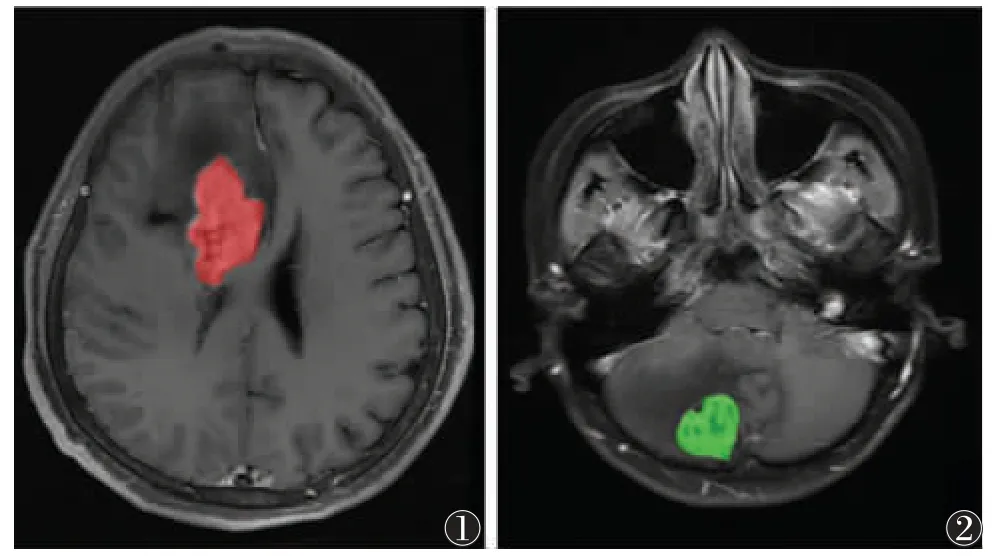
图1 男,48 岁,MRI 增强扫描诊断为胶质瘤 图2 女,60 岁,MRI增强扫描诊断为转移瘤
1.5 模型准确性判定 通过MaZda 软件B11 程序中的主成分分析(principal component analysis,PCA)、线性鉴别分析(1inear discriminant analysis,LDA)和非线性鉴别分析(nonlinear discriminant analysis,NDA)的特征向量变换方法对筛选出的10 个最佳纹理参数进行降维[13]。并对LDA 使用K 邻近分类器(K-1 代表最小分类错误)、NDA 使用神经网络分类法(artificial neural network,ANN),计算各方法组合下纹理参数鉴别诊断的最小误判率R(R=误判病灶个数/总病灶个数),并分为5 个等级:R≤10%为优秀,10%<R≤20%为良好,20%<R≤30%为中等,30%<R≤40%为一般,R>40%为较差。
2 结果
筛选出的10 个鉴别脑胶质瘤与脑转移瘤的最佳纹理参数见表1。
颅脑MRI 增强扫描与纹理特征的统计学提取方法及纹理特征的降维方法之间的不同组合,获得的纹理参数的诊断效能存在差异,各组合中最低误判率的结果见表2。其中一元特性+NDA 组合与二元特性+NDA 组合误判率为良好;一元特性+LDA 组合、二元特性+LDA 组合、三元特性+NDA 组合的误判率为中等;一元特性+PCA 组合、二元特性+PCA组合、三元特性+PCA 组合的误判率为一般;三元特性+LDA 组合的误判率较差。
纹理分析方法及MRI 增强扫描诊断脑胶质瘤与转移瘤的敏感度、特异度和准确率见表3。纹理分析方法诊断脑胶质瘤的敏感度高于MRI 增强扫描,特异度(15.4%)低于MRI 增强扫描;2 种方法联合诊断效能得到提高。
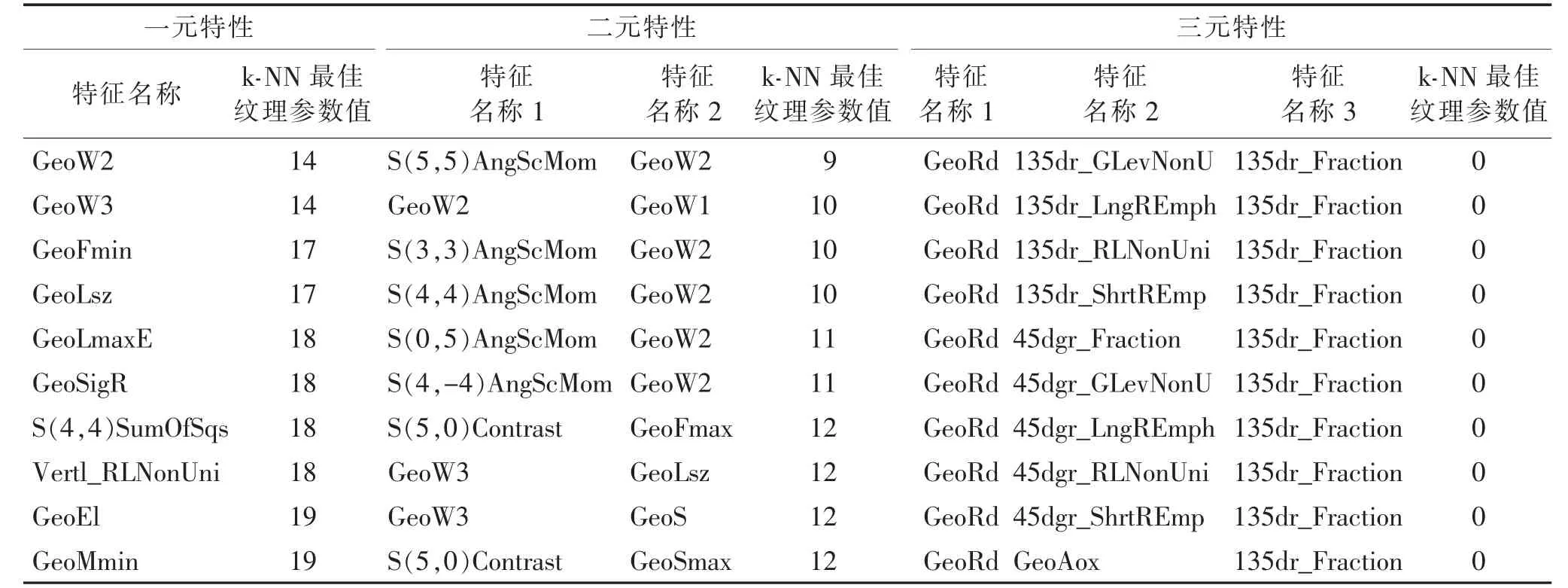
表1 3 种统计方法筛选出的最佳纹理参数
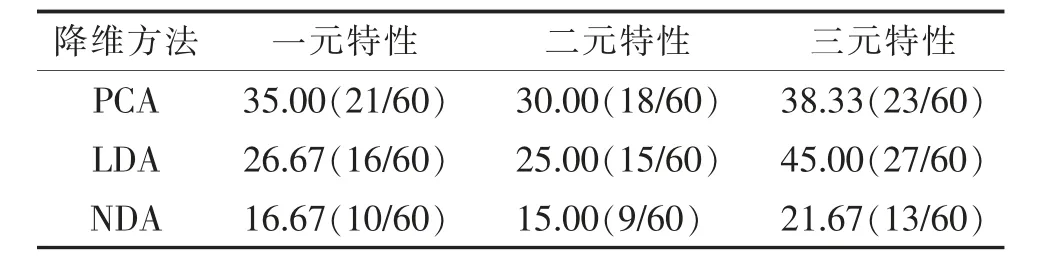
表2 不同纹理分析方法组合对脑胶质瘤与转移瘤诊断的误判率 %(例/例)
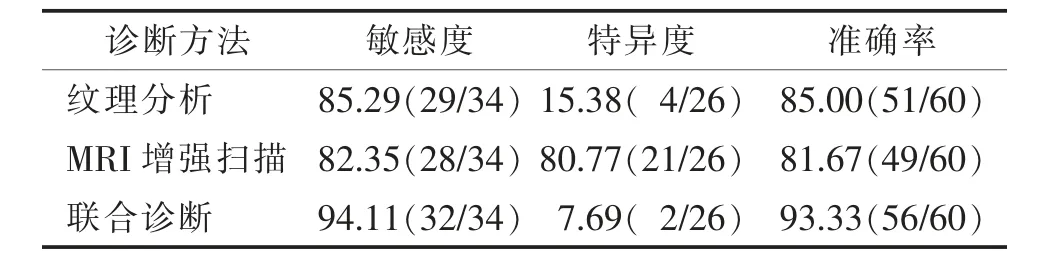
表3 纹理分析及MRI 增强扫描诊断脑胶质瘤与转移瘤的效能 %(例/例)
3 讨论
胶质瘤和脑转移瘤在颅内肿瘤中发生率较高,可起源于脑、脑膜、神经、血管等组织,或身体其他组织转移侵入颅内而成[14]。临床症状多表现为头痛、呕吐、视神经乳头水肿等。高级别胶质瘤多呈浸润性生长,瘤体组织部分坏死,胶质母细胞核分裂现象增多,血管内皮细胞、瘤巨细胞及瘤周继发结构大量增生,瘤体组织成分复杂;而转移瘤恶性程度较高,肿瘤细胞扩散增殖,新生血管生成,部分组织坏死[15]。
影像组学是对影像图像进行高通道体素特征提取,并经统计分析建模进行诊断的一门科学[16]。近年来,影像组学对许多疾病研究分析日趋丰富,如肺癌、乳腺癌等,但在高低级别脑胶质瘤的鉴别诊断中应用较少。影像组学的目标是将医学影像图像转化为可采集的、拥有高保真度和高通量的数据,并进行数据挖掘,将影像学特征与表型或基因-蛋白特征联系起来,用于构建描述和预测模型。影像组学的工作流程为图像采集与重建—图像分割与绘制—特征提取与量化—数据库建立与数据共享—个体化数据分析[17]。
纹理分析是影像组学中的一部分[18],是医学图像中近年发展起来的评价肿瘤异质性的新工具。其主要方法是将影像数据作为数据源,利用纹理分析软件,基于直方图、绝对梯度、游程矩阵、共生矩阵和自回归模型5 种分析方法,提取图像上肿瘤病灶的纹理特征,并使用软件自带的统计分析方法筛选出鉴别不同病变的特征性纹理参数,建立诊断及鉴别诊断模型。本研究中使用MaZda 软件中的直方图、绝对梯度、游程矩阵、共生矩阵和自回归模型5 种分析方法共获得256 个纹理参数;通过一元特性、二元特性、三元特性3 种统计学筛选方法,选出10 个鉴别脑胶质瘤与脑转移瘤的最佳纹理参数;根据最佳纹理参数值进行统计学提取方法和纹理特征的降维方法之间的不同组合,获得纹理参数的诊断效能,从表2 中可见使用NDA 降维方法的误判率比PCA、LDA低,其中二元特性+NDA 的误诊率最低(15.00%)。
本研究中采用纹理分析方法获得的识别脑胶质瘤的敏感度85.29%,特异度15.38%,准确率85.00%;MRI 增强扫描敏感度为82.35%,特异度为80.77%,准确率81.67%;可见纹理分析方法的诊断敏感度、准确率优于MRI 增强扫描,而MRI 增强扫描的特异度高于纹理分析;两者结合后敏感度、准确率分别提高至94.11%、93.33%,具有较高临床价值,值得推广使用。本研究局限性:①样本量相对较小,且影像表现不典型病例偏少,有一定的选择偏倚,后续研究需丰富样本量,进一步验证其诊断价值;②为回顾性分析,作为前瞻性研究与病理对照分析是后续的研究重点。
