人参皂苷Re 对椎间盘退行性变的作用及机制
2020-11-30梁智豪陈智谦周益帆
梁智豪,陈智谦,陈 辰,周益帆,杨 骁,赵 杰
上海交通大学医学院附属第九人民医院骨科,上海市骨科内植物重点实验室,上海 200011
椎间盘退行性变(intervertebral disc degeneration, IDD)是导致慢性下腰痛的主要病因之一[1],给我国公共卫生事业带来沉重的经济负担[2]。虽然目前IDD 的发生机制并未完全阐明,但普遍认为IDD 与椎间盘(intervertebral disc, IVD)内环境炎症状态的改变密切相关[3-4]。通过抑制炎症通路延缓IDD 进展,已成为近年来的研究热点。
人参皂苷Re 是人参皂苷的主要活性成分,具有抗炎、抗氧化及抗癌等多种功效[5-7]。人参皂苷Re 通过抑制Jun氨基末端激酶(Jun N-terminal kinase, JNK)及核因子κB(nuclear factor-κB, NF-κB)等炎症通路发挥作用[8],在治疗心肌纤维化、心力衰竭[9]、肾功能衰竭[10]、酒精性肝损伤[11]等多种疾病中被证实有效。此外,研究[12]显示,人参皂苷在抑制关节软骨的降解中具有明显的效果,可能具有治疗软组织炎症的功效。
在本研究中,我们探究了人参皂苷Re 是否可以延缓IDD 进展及其是否具有治疗作用,通过可引起IVD 退变的炎症因子肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)的刺激,利用体外髓核(nucleus pulposus, NP)细胞和体内大鼠尾椎针刺模型共同探究人参皂苷Re 的潜在作用及其机制。
1 材料与方法
1.1 NP 细胞
大鼠NP 细胞由美国Rush 大学医学中心骨科陈棣教授赠送。细胞在添加10%胎牛血清和1%青霉素-链霉素的高糖培养基(DMEM)中培养(Gibco, Thermo Fisher Scientific, 美国)。
1.2 实时定量聚合酶链反应检测NP 细胞炎症及代谢相关基因的表达
将NP 细胞以1×105/孔的密度种植在6 孔板24 h,按照12.5、25 和50 μmol/L 浓度加入人参皂苷Re,2 h 后加入10 ng/mL TNF-α;对照细胞只加入TNF-α。24 h 后,按照说明书使用TRIzol 试剂(Thermo Fisher Scientific, 美国)从NP 细胞中提取RNA。使用cDNA 合成试剂盒(Takara Bio, 日本)从提取的RNA 中反转录获得第一链互补DNA (cDNAs)。使用GoTaq 1-step RT-qPCR 系统(Promega, 美国)和琼脂糖凝胶电泳(Bio-Rad Laboratory, 美国)测定基因基质金属蛋白酶3(matrix metalloproteinase 3, Mmp 3)、血小板结合蛋白基序的解聚蛋白样金属蛋白酶5(a disintegrin and metalloproteinase with thrombospondin 5, Adamts 5)、聚集蛋白聚糖及Ⅱ型胶原a1(collagen type Ⅱ a1, Col2a1)的mRNA 相对表达量。在Applied Biosystems QuantStudio 6 Flex 实时PCR 系统(Thermo Fisher Scientific, 美国)中使用TB Green Premix Ex Taq 试剂盒(Takara Bio, 日本)进行实时定量聚合酶链反应(qPCR)。目标基因的表达水平通过2-ΔΔCt方法测定,利用Gapdh 循环次数(cycle time, Ct)校准实验组目标基因。qPCR 引物序列见表1。

表1 qPCR 引物序列Tab 1 Primer sequences for qPCR
1.3 蛋白质印迹法检测NF-κB 通路相关蛋白的表达
将NP 细胞以1×105/孔的密度种植在6 孔板24 h后,加入人参皂苷Re(50 μmol/L)2 h 后加入TNF-α(10 ng/mL);以仅加入TNF-α 的NP 细胞为阳性对照,空白对照细胞不作处理。TNF-α 刺激10 min 后使用添加了蛋白酶抑制剂和磷酸酶抑制剂的放射免疫沉淀法缓冲液(RIPA)提取细胞总蛋白(Roche, 瑞士)。使用10%或12.5%的聚丙烯酰胺凝胶电泳凝胶等量溶解提取好的蛋白(20~30 μg),将分离出的蛋白转移至0.22 μm 聚偏二氟乙烯膜上。膜使用含5%牛血清白蛋白的磷酸缓冲盐溶液(BSA-PBS)在室温下封闭1 h,然后与一抗(在5% BSA-PBS 中以1:1 000 稀释)在4 ℃孵育过夜(至少16 h)。p-IKKα (Ser176/180)、IKKα (D3W6N)、p-NFκB p65 (Ser536)、NF-κB p65 (D14E12)、p-IκBα (Ser32)、IκBα (44D4) 及β-actin (13E5) 抗 体 均 购 于Cell Signaling Technology( 美 国)。 使 用Tris-buffered saline-Tween20 (TBST)洗膜,然后使用二抗室温黑暗环境下孵育1 h。再次采用TBST 洗膜,并使用LI-COR Odyssey 荧光成像系统(美国)检测蛋白质免疫反应性。采用Image-Pro Plus 6.0 软件对蛋白免疫反应条带强度进行半定量分析,并利用内参β-actin 进行校准。
1.4 动物手术过程及影像学观察
所有动物实验均经上海交通大学医学院附属第九人民医院实验动物伦理委员会批准(审批号SH9H-2020-TK265-1)。12 只8 周龄雄性Sprague-Dawley 大鼠,购于上海甲干生物科技有限公司。动物生产许可证号为SCXK(沪)2015-0005,动物使用许可证号为SYXK(沪)2013-0087。在26 ~28 ℃、50% ~65% 湿度、12 h 昼夜循环的无病原体条件下饲养。动物以标准啮齿动物食物饲养并可获得淡水。手术前,通过腹腔注射苯巴比妥钠(5 mg/100 g)麻醉大鼠。12 只大鼠尾部用碘化聚乙烯吡咯烷酮消毒,然后做背侧纵向皮肤切口,显露尾椎(Co)6 ~8 的IVD。Co6/7 的IVD 作为假手术对照节段,不进行针刺;Co7/8 作为针刺节段,用20 号无菌针垂直于皮肤刺穿IVD 并旋转退出,缝合切口。其中,6 只大鼠作为实验组,每周腹腔注射50 μmol/L 人参皂苷Re 3 次,每次100 μL;其余6 只大鼠作为对照组,每周腹腔注射等量PBS。1 个月后行X 线检查,使用21 lp/mm 探测器在前后径上对针刺后的IVD 进行数字X 线成像(Faxitron VersaVision, Faxitron Bioptics LLC, 美国),以上下终板连线为IVD 高度指数进行退变分析。
1.5 免疫荧光染色
1.5.1 检测NP 细胞NF-κB p65 磷酸化情况 将NP 细胞玻片使用PBS 浸洗3 次,每次3 min;使用4%多聚甲醛溶液固定15 min;再次使用PBS 浸洗3 次,每次3 min;在室温下使用封闭缓冲液封闭30 min。切片与一抗在4 ℃的湿箱中孵育过夜;一抗p-NF-κB p65 (Ser536)、DAPI(40835)购于Cell Signaling Technology 公司(美国),按照1:1 000稀释。第2 日,用PBS 洗涤玻片,然后与1:500 稀释的Alexa Fluor 594 兔二抗(Cell Signaling Technology, 美国)在室温黑暗环境中孵育50 min。最后用PBS 洗涤玻片、风干,并使用荧光淬灭片封闭。在Leica DM4000B 荧光显微镜(Leica Microsystems, 德国)下捕获数字荧光图像,并使用Image-Pro Plus 6.0 软件进行积分光密度(integrated option density, IOD)测量。
1.5.2 检测尾椎组织TNF-α、MMP 3、聚集蛋白聚糖及COL2A1 蛋白的表达 处死所有大鼠,取出尾部,清理软组织,并将尾椎使用4%多聚甲醛溶液固定。组织切片在二甲苯中脱蜡、乙醇溶液中复水,然后在37 ℃的抗原修复缓冲液(Roche, 瑞士)中孵育30 min。冷却至室温后,将切片浸泡于pH 值7.4 的PBS 中,洗涤3 次,每次5 min。加入自动荧光淬灭剂5 min,然后在室温下使用封闭缓冲液封闭30 min。切片与一抗在4 ℃的湿箱中孵育过夜。一抗p-NF-κB p65 (Ser536)、DAPI (40835)、TNF-α (D2D4)、MMP 3 (D7F5B) 购 于Cell Signaling Technology公司(美国),聚集蛋白聚糖(EPR14664)及COL2A1(EPR12268)购于艾博抗(上海)贸易有限公司,均按照1:1 000 稀释。第2 日,用PBS 洗涤切片,然后与1:500稀释的Alexa Fluor 594 兔二抗(Cell Signaling Technology,美国)在室温黑暗环境中孵育50 min。最后用PBS 洗涤切片、风干,并使用荧光淬灭片封闭。在Leica DM4000B荧光显微镜(Leica Microsystems, 德国)下捕获数字荧光图像,并使用Image-Pro Plus 6.0 软件进行IOD 测量。
1.6 番红固绿及苏木精-伊红染色观察IVD 形态变化及组织学评估
将固定好的IVD 组织标本(5 μm 厚)包埋于石蜡切片内。组织切片在二甲苯中脱蜡、乙醇溶液中复水,然后在37 ℃的抗原修复缓冲液(Roche)中孵育30 min。冷却至室温后,将切片浸泡于pH 值7.4 的PBS 中,洗涤3次,每次5 min。将切片分别进行番红固绿及苏木精-伊红(hematoxylin-eosin, H-E)染色。在Olympus TH4-200显微镜(Olympus, 日本)下使用Olympus DP Controller 捕获数字图像。参考相关文献[13],通过评估数字图像纤维环形态、纤维环和NP 之间的交界处形态、NP 细胞密度及正中矢状面基质状态,对IDD 进行组织学分级(每项1 ~3 分,总分为4 ~12 分,4 分为健康,12 分为严重退变)。
1.7 统计学分析
采用SPSS 19.0 软件进行统计学分析。所有数据均进行3 次独立实验或重复测量,数据以x±s 表示。符合正态分布的2 组间定量比较采用成组t 检验,多组间比较采用单因素方差分析,P<0.05 表示差异有统计学意义。
2 结果
2.1 人参皂苷Re 体外对NP 细胞炎症因子的作用
TNF-α 刺激24 h 后,NP 细胞炎症相关基因Mmp 3 和Adamts 5 表达上升(P=0.000),而软骨相关基因聚集蛋白聚糖和Col2a1 的表达则下降(P=0.000)。经50 μmol/L 人参皂苷Re 作用后,与单用TNF-α 的细胞比较,Mmp 3 和Adamts 5 表达明显下降,聚集蛋白聚糖、Col2a1 表达明显上升,差异均有统计学意义(均P=0.000),且此作用具有浓度依赖性(图1)。
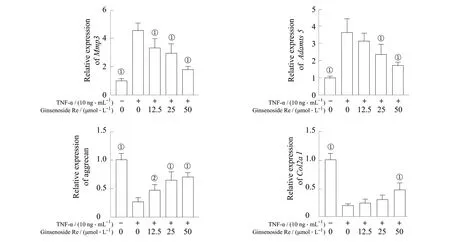
图1 人参皂苷Re 对Mmp 3、Adamts 5、聚集蛋白聚糖、Col2a1 基因表达的影响Fig 1 Effect of ginsenoside Re on gene expressions of Mmp 3, Adamts 5, aggrecan and Col2a1
2.2 人参皂苷Re 对NF-κB 通路的抑制作用
蛋白质印迹实验结果(图2A、C)显示:在TNF-α刺激10 min 后,NP 细胞NF-κB 通路上游高相对分子质量IκB 激酶 IKK 复合体磷酸化,p-IKKα 蛋白表达升高;p-IκBα 蛋白和p-p65 蛋白表达显著升高(均P=0.000);加入50 μmol/L 人 参 皂 苷Re 后,p-IκBα 蛋 白 和p-p65 蛋 白与单纯使用TNF-α 刺激的NP 细胞比较,表达量显著降低(均P=0.000)。免疫荧光实验结果显示:TNF-α 刺激可以促进p65 蛋白磷酸化而人参皂苷Re 则可以抑制这个过程(图2B、D)。

图2 人参皂苷Re 对NF-κB 通路相关蛋白表达的影响Fig 2 Effect of ginsenoside Re on expressions of NF-κB pathway-related proteins
2.3 人参皂苷Re 对大鼠IDD 程度的影响
术后1 个月X 线片检测结果显示,对照组(腹腔注射PBS)Co7/8 针刺节段与Co6/7 假手术节段相比,椎间隙骨赘增生明显,椎间隙塌陷;相反,实验组(腹腔注射50 μmol/L 人参皂苷Re)的大鼠尾椎间隙仅表现为轻度的骨赘增生,且具有良好的高度(图3A)。统计分析结果(图3B)显示:与相应的假手术节段相比,实验组和对照组的针刺节段椎间隙高度均减小(P=0.034,P=0.032);但实验组针刺节段椎间隙高度大于对照组(P=0.004)。H-E 染色及番红固绿染色结果(图3C、D)显示:对照组大鼠针刺节段IVD 相较于假手术节段退变严重,NP 水分丢失皱缩;而实验组针刺节段IVD 相较于假手术节段则退变较轻,NP 水分丢失较少,皱缩不明显。与对照组针刺节段相比,实验组针刺节段的退变程度明显改善,组织学分级的差异有统计学意义(P=0.023,图3E)。
2.4 人参皂苷Re 对大鼠IVD 细胞外基质的影响
免疫荧光定量分析结果(图4)显示:在对照组中,与假手术节段相比,针刺节段的大鼠尾椎IVD 内COL2A1及聚集蛋白聚糖含量明显降低,而MMP 3 及TNF-α 的含量明显升高,差异均有统计学意义(均P=0.000)。同为针刺节段时,与对照组相比,实验组的大鼠尾椎IVD 内炎症相关蛋白MMP 3 及TNF-α 含量较低,而COL2A1及聚集蛋白聚糖含量较高,差异均具有统计学意义(均P=0.000)。
3 讨论

图3 人参皂苷Re 对大鼠IDD 的改善作用Fig 3 Improvement effect of ginsenoside Re on IDD of rats
IVD 位于脊柱椎体的中间,主要由中心富含蛋白多糖呈凝胶状的NP 组织,以及外周富含胶原的纤维软骨组织的纤维环组成[14-15]。IDD 是一个复杂的生理过程。机械应力因素、遗传因素、环境因素、年龄老化以及IVD 炎症因子如TNF-α[16]等在NP 组织中的浸润等多种原因都会导致IDD 的产生和加重。这些因素导致IDD 的主要原因是破坏了IVD 中NP 细胞的细胞外基质的代谢平衡,使得分解代谢增加而合成代谢减弱。分解代谢的增加会导致NP细胞的MMP 和ADAMTS 表达增加,从而加速了细胞外基质的降解[17]。合成代谢的减弱会导致NP 细胞细胞外基质中Ⅱ型胶原和聚集蛋白聚糖的减少。降解的细胞外基质无法维持IVD 的含水量以及承担相应的应力负荷。这个过程同时伴有NP 组织大量的炎症因子浸润,而该过程起主要作用的炎症因子是TNF-α[18-20]。过度表达的炎症因子和细胞外基质的失平衡互为因果、互相加重。

图4 人参皂苷Re 对大鼠IVD 细胞外基质的改善作用Fig 4 Improvement effect of ginsenoside Re on IVD extracellular matrix of rats
对于IDD 导致的腰痛,根据疾病的轻重常规采用从腰背肌锻炼、口服止痛药,再到微创或者开放手术的阶梯式治疗方法[21]。缓解IDD 导致的腰痛,最常用的药物是非甾体类抗炎药(如双氯芬酸等)。这类药物可以通过调节炎症因子暂时起到缓解腰痛的作用,但是无法改变IDD的进展,并且会带来许多的不良反应[22-23]。目前,多种植物来源的化合物由于其良好的抗炎作用及相对小的不良反应而受到了越来越多的关注。人参皂苷Re 主要存在于人参属药材当中,是一种固醇类化合物,作为人参皂苷的主要活性成分,其抗炎和抗氧化等功效已在多种疾病中得到了证实[9,24-26]。在本研究中,我们探究了人参皂苷Re 在IDD 过程中所起的保护作用及其机制。在炎症反应中,由NF-κB 信号通路产生的炎症因子TNF-α 等,加剧了细胞外基质中Ⅱ型胶原蛋白和聚集蛋白聚糖等蛋白的降解,促进了MMP 和ADAMTS 等分解代谢蛋白的合成,对IDD起着重要的作用[27]。而TNF-α 与NP 细胞的TNF 受体结合,促进了NF-κB 信号通路进一步激活,形成了炎症反应正反馈环路,加剧了IVD 中的炎症反应。本研究以IDD 中的炎症因子TNF-α 为核心,探究了人参皂苷Re 在IDD 中的作用。
本研究通过探究不同浓度人参皂苷Re 对NP 细胞增殖的影响,确定了合适的刺激浓度。既往文献[28-29]报道,在TNF-α 激活NF-κB 后,引起IKKα 磷酸化,使IκBα 激酶被激活,进而导致IκBα 磷酸化,最后IκBα 蛋白被降解,随后NF-κB 从IκBα 复合体中分离出来,NF-κB p65亚单位磷酸化后从细胞质进入细胞核,调控下游炎症因子的合成。本研究中的蛋白质印迹实验结果显示人参皂苷Re 抑制了由炎症因子TNF-α 引起的NP 细胞的IKKα、IκBα、p65 的磷酸化,抑制了由TNF-α 引起的IκBα 的降解;免疫荧光结果表明人参皂苷Re 抑制了由TNF-α 引起的NP 细胞p65 的核转位。这表明人参皂苷Re 对NF-κB信号具有较好的抑制作用。既往许多研究表明,MMP 和ADAMTS 破坏了IDD 患者细胞外基质合成代谢和分解代谢之间的平衡。本研究中,IVD 组织番红固绿染色结果显示人参皂苷Re 对细胞外基质具有保护作用,免疫荧光检测结果显示COL2A1、聚集蛋白聚糖表达降低而MMP 3 表达升高;说明人参皂苷Re 可以部分逆转由TNF-α 刺激导致的分解代谢的增加以及合成代谢的减弱,使得细胞外基质得到较好的保护。结合以上结果,说明人参皂苷Re 有效地抑制了IDD 的发展过程。
综上,本实验结果表明人参皂苷Re 可以通过抑制NF-κB 信号通路,抑制相关炎症因子的表达,改善细胞外基质的合成、分解代谢的失平衡,从而延缓IDD 的进程。人参皂苷Re 在NP 细胞中的抗炎作用表明其可以作为IDD 治疗的潜在药物。
参·考·文·献
[1] Dowdell J, Erwin M, Choma T, et al. Intervertebral disk degeneration and repair[J]. Neurosurgery, 2017, 80(3S): S46-S54.
[2] Zhou MG, Wang HD, Zeng XY, et al. Mortality, morbidity, and risk factors in China and its provinces, 1990-2017: a systematic analysis for the Global Burden of Disease Study 2017[J]. Lancet, 2019, 394(10204): 1145-1158.
[3] le Maitre CL, Hoyland JA, Freemont AJ. Catabolic cytokine expression in degenerate and herniated human intervertebral discs: IL-1β and TNFα expression profile[J]. Arthritis Res Ther, 2007, 9(4): 1-11.
[4] Zhang CH, Gullbrand SE, Schaer TP, et al. Inflammatory cytokine and catabolic enzyme expression in a goat model of intervertebral disc degeneration[J]. J Orthop Res, 2020, 38(11): 2521-2531.
[5] Gao Y, Gao CY, Zhu P, et al. Ginsenoside Re inhibits vascular neointimal hyperplasia in balloon-injured carotid arteries through activating the ENOS/NO/cGMP pathway in rats[J]. Biomed Pharmacother, 2018, 106: 1091-1097.
[6] Gao Y, Zhu P, Xu SF, et al. Ginsenoside Re inhibits PDGF-BB-induced VSMC proliferation via the ENOS/NO/cGMP pathway[J]. Biomed Pharmacother, 2019, 115: 108934.
[7] Yao H, Li J, Song YB, et al. Synthesis of ginsenoside Re-based carbon dots applied for bioimaging and effective inhibition of cancer cells[J]. Int J Nanomed, 2018, 13: 6249-6264.
[8] Zhang ZG, Li XY, Lv W, et al. Ginsenoside Re reduces insulin resistance through inhibition of c-Jun NH2-Terminal kinase and nuclear factor-κB[J]. Mol Endocrinol, 2008, 22(1): 186-195.
[9] Wang QW, Yu XF, Xu HL, et al. Ginsenoside Re improves isoproterenol-induced myocardial fibrosis and heart failure in rats[J]. Evid - Based Complementary Altern Med, 2019, 2019: 1-9.
[10] Bikbov B, Perico N, Remuzzi G, et al. Disparities in chronic kidney disease prevalence among males and females in 195 countries: analysis of the global burden of disease 2016 study[J]. Nephron, 2018, 139(4): 313-318.
[11] Lee DY, Kim MJ, Yoon D, et al. Ginseng berry prevents alcohol-induced liver damage by improving the anti-inflammatory system damage in mice and quality control of active compounds[J]. Int J Mol Sci, 2019, 20(14): 3522.
[12] Lee JH, Lim H, Shehzad O, et al. Ginsenosides from Korean red ginseng inhibit matrix metalloproteinase-13 expression in articular chondrocytes and prevent cartilage degradation[J]. Eur J Pharmacol, 2014, 724: 145-151.
[13] Masuda K, Aota Y, Muehleman C, et al. A novel rabbit model of mild, reproducible disc degeneration by an anulus needle puncture: correlation between the degree of disc injury and radiological and histological appearances of disc degeneration[J]. Spine, 2005, 30(1): 5-14.
[14] Smith LJ, Nerurkar NL, Choi KS, et al. Degeneration and regeneration of the intervertebral disc: lessons from development[J]. Dis Model Mech, 2011, 4(1): 31-41.
[15] Walter BA, Purmessur D, Likhitpanichkul M, et al. Inflammatory kinetics and efficacy of anti-inflammatory treatments on human nucleus pulposus cells[J]. Spine, 2015, 40(13): 955-963.
[16] Wang C, Yu XH, Yan YG, et al. Tumor necrosis factor-α: a key contributor to intervertebral disc degeneration[J]. Acta Biochim Biophys Sin, 2017, 49(1): 1-13.
[17] Wang WJ, Yu XH, Wang C, et al. MMPs and ADAMTSs in intervertebral disc degeneration[J]. Clin Chimica Acta, 2015, 448: 238-246.
[18] Yang W, Yu XH, Wang C, et al. Interleukin-1β in intervertebral disk degeneration[J]. Clin Chimica Acta, 2015, 450: 262-272.
[19] Risbud MV, Shapiro IM. Role of cytokines in intervertebral disc degeneration: pain and disc content[J]. Nat Rev Rheumatol, 2014, 10(1): 44-56.
[20] Johnson ZI, Schoepflin ZR, Choi H, et al. Disc in flames: roles of TNF-α and IL-1β in intervertebral disc degeneration[J]. Eur Cell Mater, 2015, 30: 104-116.
[21] Barrey CY, Le Huec JC. Chronic low back pain: relevance of a new classification based on the injury pattern[J]. Orthop Traumatol: Surg Res, 2019, 105(2): 339-346.
[22] Rasmussen-Barr E, Held U, Grooten WJA, et al. Nonsteroidal anti-inflammatory drugs for sciatica[J]. Spine, 2017, 42(8): 586-594.
[23] Madigan L, Vaccaro AR, Spector LR, et al. Management of symptomatic lumbar degenerative disk disease[J]. J Am Acad Orthop Surg, 2009, 17(2): 102-111.
[24] Nam Y, Wie MB, Shin EJ, et al. Ginsenoside Re protects methamphetamineinduced mitochondrial burdens and proapoptosis via genetic inhibition of protein kinase C δ in human neuroblastoma dopaminergic SH-SY5Y cell lines[J]. J Appl Toxicol, 2015, 35(8): 927-944.
[25] Jang HJ, Han IH, Kim YJ, et al. Anticarcinogenic effects of products of heatprocessed ginsenoside Re, a major constituent of ginseng berry, on human gastric cancer cells[J]. J Agric Food Chem, 2014, 62(13): 2830-2836.
[26] Liu MC, Bai XY, Yu ST, et al. Ginsenoside Re inhibits ROS/ASK-1 dependent mitochondrial apoptosis pathway and activation of Nrf2-antioxidant response in β-amyloid-challenged SH-SY5Y cells[J]. Molecules, 2019, 24(15): 2687.
[27] Wuertz K, Vo N, Kletsas D, et al. Inflammatory and catabolic signalling in intervertebral discs: the roles of NF-κB and MAP kinases[J]. Eur Cell Mater, 2012, 23:103-119.
[28] Ghosh S, Dass JFP. Study of pathway cross-talk interactions with NF-κB leading to its activation via ubiquitination or phosphorylation: a brief review[J]. Gene, 2016, 584(1): 97-109.
[29] Mitchell S, Vargas J, Hoffmann A. Signaling via the NFκB system[J]. WIREs Syst Biol Med, 2016, 8(3): 227-241.
