一株核桃真菌病害生防菌的鉴定及抑菌特性研究
2020-11-28马腾张知晓户连荣刘凌季梅
马腾,张知晓,户连荣,刘凌,季梅
(1.青海省林业调查规划院,青海西宁 810000;2.云南省林业和草原科学院,云南昆明 650201)
核桃Juglans regia,学名胡桃,是多年生落叶乔木,核桃仁是高档坚果,果实种壳能开发成工艺品,木材是制作高档家具的原料,其叶子及果皮可以入药[1]。因其良好经济社会价值,云南省将胡桃作为发展八大产业的重要物种,是打造云南“绿色食品牌”的重要组成部分[2]。截至2017年,云南省核桃种植面积达286.67万hm2,核桃(干果)总产量为115万t,产值318亿元,居全国第一[3]。近年来,随着种植面积的快速增加,核桃病虫害发生情况也愈加严重。在我国,核桃黑斑病等细菌病害,以及炭疽病、枝枯病和腐烂病等真菌病害发生普遍,对核桃生产造成了严重影响[4]。目前,核桃病害防治仍然依赖化学药剂,随着全社会对绿色无公害食品需求的增加以及生态环境保护意识的提高,生物防治成为核桃病害防治的发展方向。
芽孢杆菌具有抗逆能力强、抑菌谱广等特点,近些年研究较多的如枯草芽孢杆菌Bacillus subtilis、解淀粉芽孢杆菌B.amyloliquefaciens、蜡样芽孢杆菌B.cereus等,在由丝状真菌引起的植物病害的生防领域有着广泛应用[5]。芽孢杆菌资源丰富,许多具有生防作用的种类有待发掘研究。芽孢杆菌抑菌谱广泛,但不同菌株对病原菌抑制效果不一,且不同芽孢杆菌抑制病原菌的作用机制不同[6],因此在发掘新的生防菌资源时,有必要对其抑菌特性进行研究。笔者选用前期试验分离验证的具有抑菌效果的一株生防细菌5-1,测定其对核桃病害主要病原真菌的抑菌特性,并进行种类鉴定,以期为应用该生防菌株防治核桃真菌病害、开发新的生防微生物资源提供参考。
1 材料与方法
1.1 试验材料
1.1.1 培养基 LB培养基(胰蛋白胨10 g、酵母粉5 g、氯化钠5 g、琼脂 20 g、蒸馏水 1 L),用于细菌培养及形态鉴定;PDA培养基(马铃薯200 g、葡萄糖20 g、琼脂20 g、蒸馏水1 L),用于病原真菌培养及对峙培养。
1.1.2 病原真菌 试验地区常见核桃真菌病害的病原真菌7种,从云南省核桃病害中分离(表1)。
1.1.3 生防细菌 2019年4月在云南省昆明树木园(N 25°8′39″,E 102°44′48″)随机挖取 5 份核桃根际土壤样品,每份10 g。将5份土样混合后,称取10 g土样用无菌自来水稀释,取最适浓度的土壤悬浮液均匀涂布于固体LB平板上,28℃条件下培养48 h,挑选单菌落,划线纯化。选择病原真菌胶孢炭疽菌Colletotrichum gloeosporiodes为指示菌,采用平板对峙法评价分离所得细菌的拮抗能力。选择拮抗效果最好的菌株5-1进行后续试验。
1.1.4 生防菌发酵液 菌株5-1接种于LB培养液,28℃、140 r/min摇床培养24 h,将菌液浓度稀释至2×109cfu/mL的活体菌液为活体发酵液;菌体浓度2×109cfu/mL的活体发酵液用细菌滤器过滤3次后的滤出液为发酵滤液;2×109cfu/mL的活体发酵液经121℃灭菌20 min后,用细菌滤器过滤1次的滤出液为灭菌发酵液。
1.1.5 病原菌孢子悬浮液 广布拟盘多毛孢菌Pestalotiopsis disseminata在PDA培养基上培养5 d,用无菌水冲洗分生孢子,离心沉淀并反复清洗3次后,配制成4×106个/mL的孢子悬浮液。
1.2 生防菌对核桃主要病原真菌拮抗作用 采用平板对峙法测试生防菌株5-1发酵液对核桃7种病原真菌的抑菌效果。用5 mm打孔器沿菌落边缘选取新鲜的菌丝制成菌饼,单个菌饼接种在PDA培养基平板中央,用移液器吸取50 μL生防菌活体发酵液,均匀对称地接种在距菌饼中央30 mm处的4个点,以接种无菌自来水为对照,于28℃下培养,每处理3个重复。培养7 d后,分别测量对照菌落直径、处理菌落直径,计算抑制率。
抑制率(%)=(对照菌落直径-处理菌落直径)/(对照菌落直径-5mm)×100[7]
1.3 生防菌对分生孢子的影响 由于广布拟盘多毛孢易产孢,且孢子形态易观察,因此选择该病原真菌的分生孢子进行试验。采用随机区组设计,共设活体发酵液、发酵滤液、灭菌发酵液和121℃灭菌20 min的灭菌自来水对照4个处理,每个处理3个重复。将分生孢子悬浮液分别和4个处理液体按1∶1的比例进行混和,置于离心管中,28℃、140 r/min摇床黑暗恒温培养,分别于12 h和24 h后,用无菌移液器吸取病原真菌分生孢子,在光学显微镜下观察形态,并拍摄照片。
1.4 生防细菌鉴定
1.4.1 形态学观察 将菌株5-1在LB固体培养基上划线培养[8]。在37℃恒温培养箱中培养48 h后观察菌落生长情况,并用革兰氏染色法制片完成细胞形态结构的显微观察。
1.4.2 生理生化特性测试 完成菌株5-1的温度(5~60℃)、pH(4.0~13.0)、NaCl(0~14%)耐受试验,测定水解淀粉和明胶能力,选择葡萄糖、麦芽糖、淀粉等碳源及酪氨酸、组氨酸等氮源进行唯一碳、氮源的生长试验[9]。
1.4.3 16S rRNA序列测定 采用细菌DNA提取试剂盒提取菌株5-1的基因组总DNA,用细菌通用引物27F/1495R扩增16S rRNA片段,用1%琼脂糖凝胶电泳回收扩增产物,送深圳华大基因有限公司进行测序,获得基因序列与GenBank中已知的核酸序列进行BLAST比对,选取相关近缘种序列使用MEGA 4.1软件进行系统发育分析,采用邻接距离法构建系统发育树[10]。
2 结果与分析
2.1 拮抗功能评价 菌株5-1对核桃7种病原真菌均表现出不同程度的抑制作用,其中对间座壳菌Diaporthe nobilis、镰孢菌Fusariumsp.、胶孢炭疽菌和广布拟盘多毛孢菌抑制效果十分明显,抑制率超过40%。对间座壳菌的抑制率最高,达到73.7%,对胡桃楸拟茎点霉Phomopsis juglandina的抑制率最低,仅为24.1%(图1,表1)。
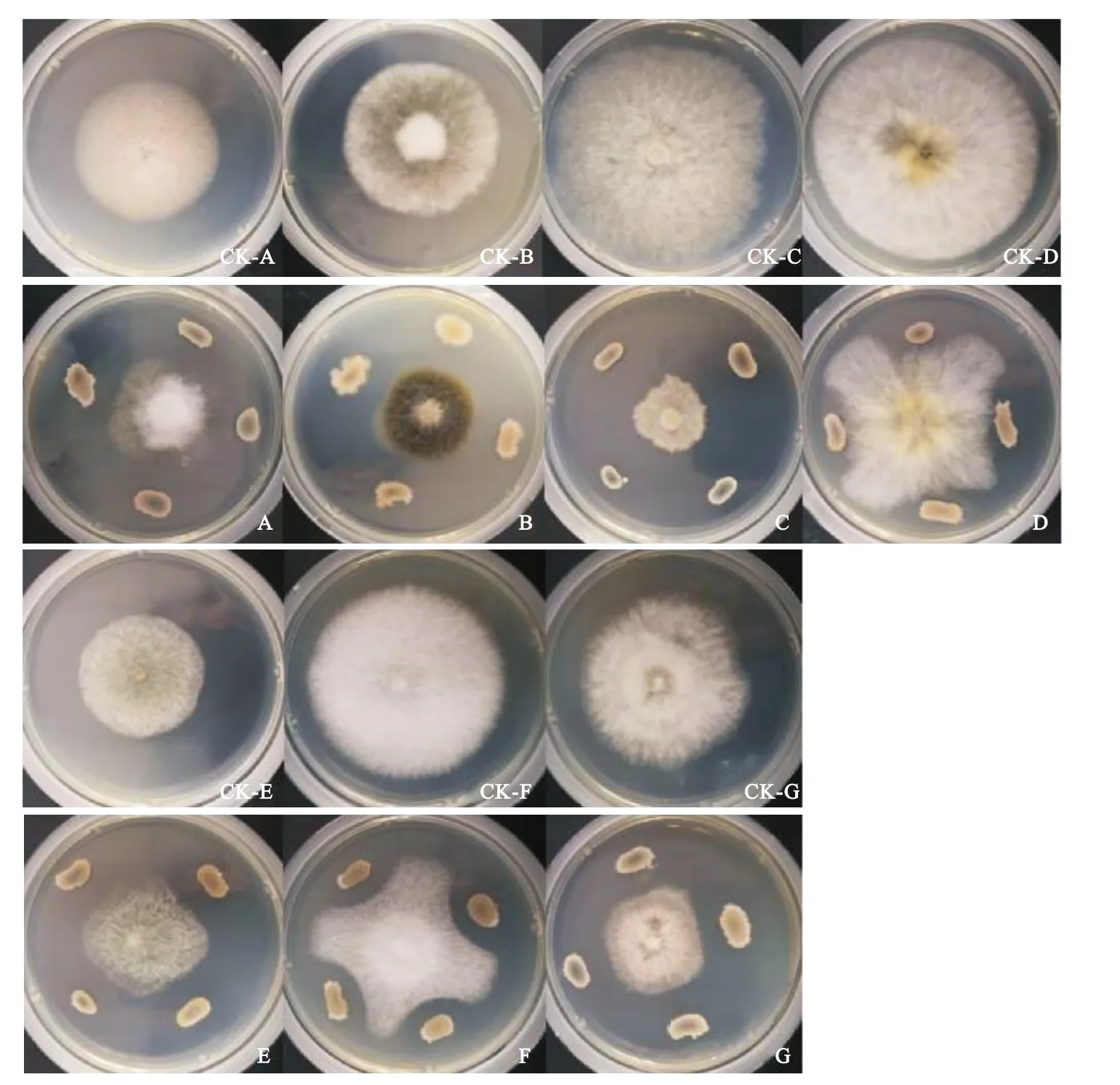
图1 生防菌株5-1对核桃7种病原真菌的拮抗效果Fig.1 Confrontation effect of biocontrol strain 5-1 on 7 species of pathogenic fungus infecting walnut
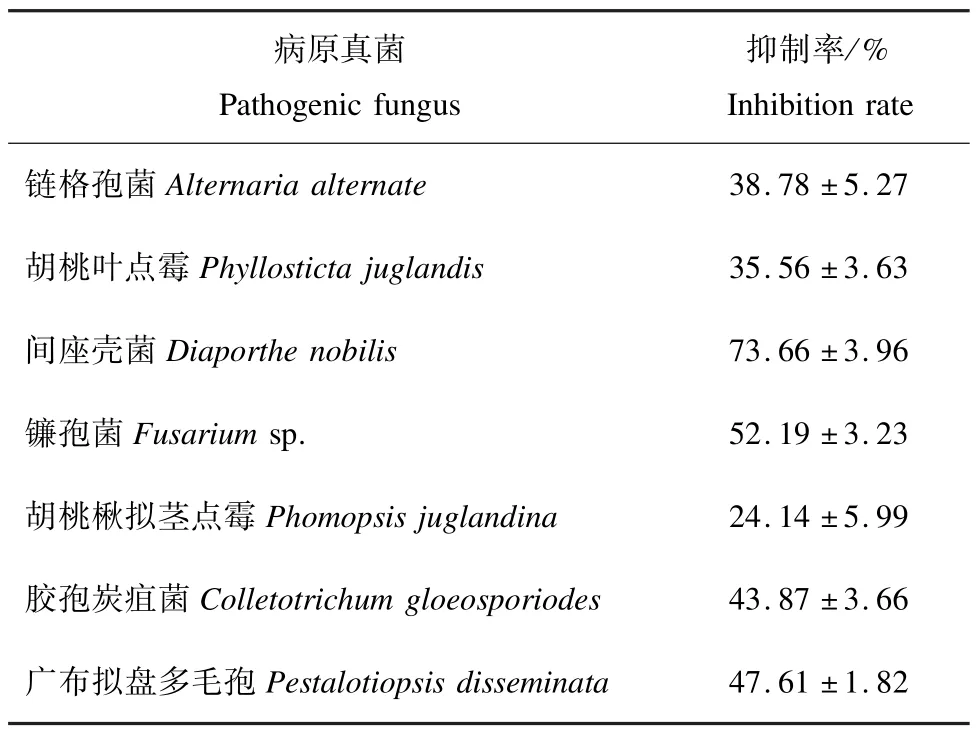
表1 生防菌株5-1对核桃7种病原真菌的抑制率Tab.1 Inhibition rate of biocontrol strain 5-1 on 7 species of pathogenic fungus infecting walnut
2.2 对病原菌分生孢子的影响 生防菌株5-1发酵液与广布拟盘多毛孢混合培养12 h和24 h后,广布拟盘多毛孢孢子萌发情况见表2。与对照组相比,3组发酵液均导致分生孢子和菌丝畸变,分生孢子表现为第3色胞明显膨大,基部无色胞呈囊泡状,随之溶解破裂失去萌发能力;菌丝表现为顶端膨大分叉变形,生长能力减弱(图2,3)。经高温灭菌后发酵液依然能导致孢子和菌丝畸变,表明菌株5-1发酵液的功能成分具有较好的热稳定性。活体发酵液比发酵滤液造成病原真菌孢子和菌丝的畸变更为明显,表明活体菌群加大了病原孢子畸形及破裂的程度。

表2 生防菌株5-1的发酵液对广布拟盘多毛孢菌丝和孢子形态的影响Tab.2 Effect of fermentation broth of biocontrol strain 5-1 on mycelia and spore morphology of Pestalotiopsis disseminata
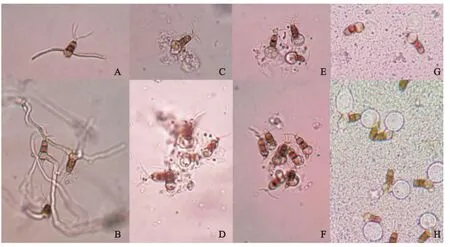
图2 生防菌3种发酵液培养12 h后广布拟盘多毛孢孢子的形态Fig.2 The spore morphology of Pestalotiopsis disseminata after culturing 3 kinds of fermentation broth for 12 h
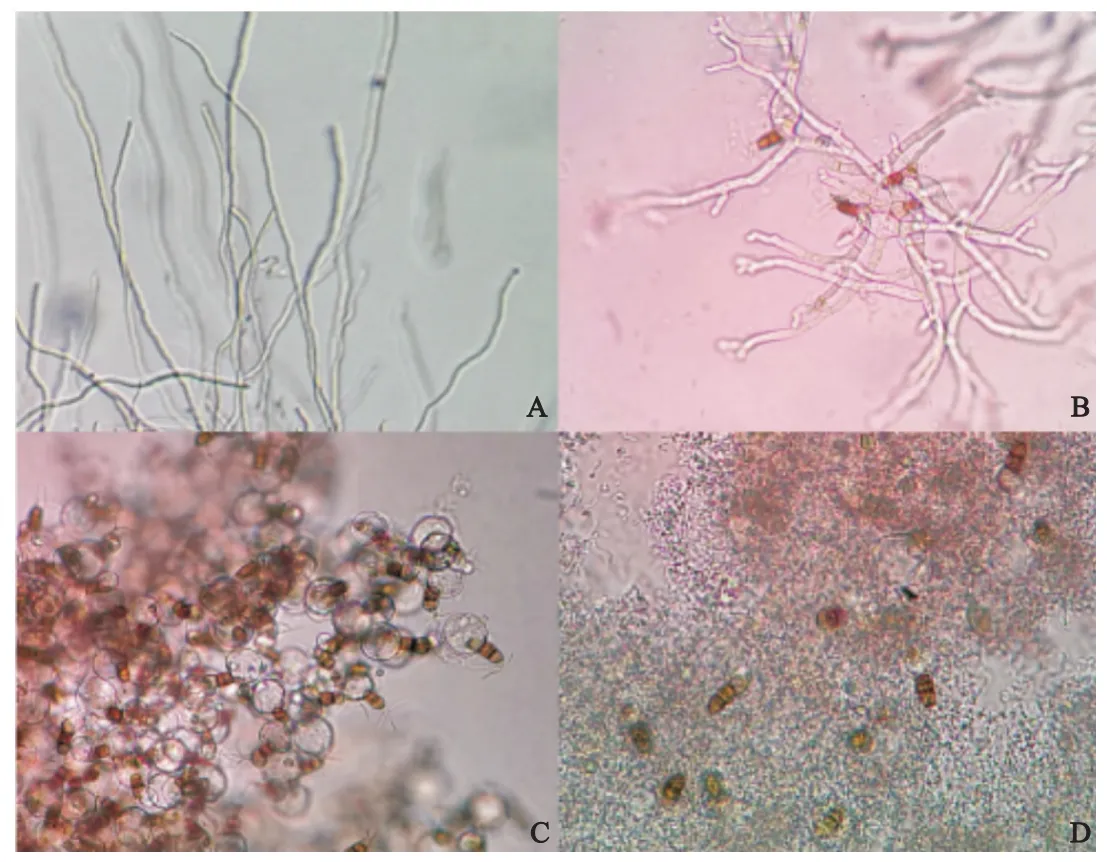
图3 生防菌3种发酵液培养24 h后广布拟盘多毛孢菌丝和孢子形态Fig.3 The mycelia and spore morphology of Pestalotiopsis disseminata after culturing 3 kinds of fermentation broth for 24 h
2.3 生防菌的鉴定
2.3.1 菌株形态 菌株5-1在固体LB培养基培养3 d后,其菌落为淡黄色,边缘不整齐,表面光滑,中央凸起,不分泌黏液。显微镜下观察到菌体直杆状,单个,两端钝圆,革兰氏染色呈阳性(图4)。
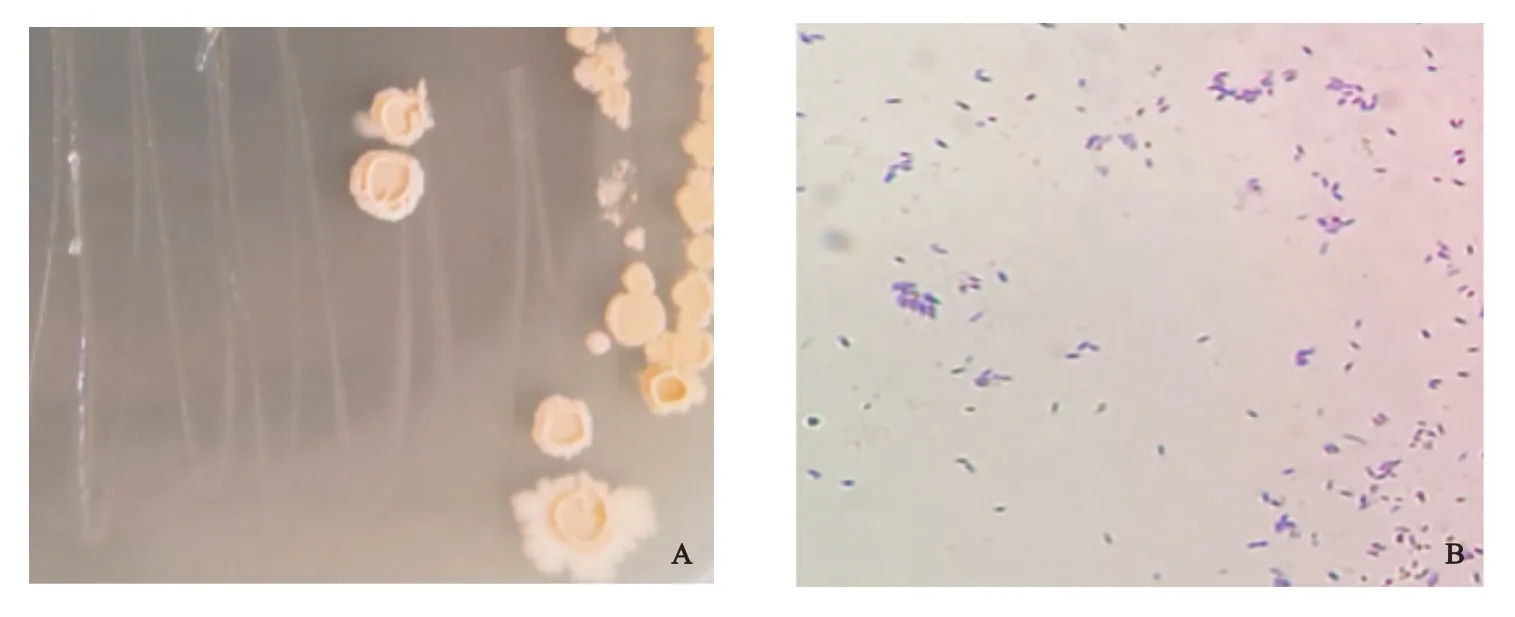
图4 菌株5-1在LB培养基培养3 d的菌落和菌体形态Fig.4 Bacterial colony and morphology of strain 5-1 cultured in LB medium for 3 days
2.3.2 生理生化特性 该菌株能利用葡萄糖、淀粉、蔗糖、D-甘露醇、D-木糖、L-阿拉伯糖等多种碳水化合物作为唯一碳源进行生长,却不能利用麦芽糖和壳聚糖;能利用酪氨酸、组氨酸作为唯一氮源进行生长,生长温度在5~50℃,生长pH范围在5.0~9.0,能耐受14%的NaCl;具有水解淀粉和明胶的能力,V-P试验阳性,不能利用柠檬酸盐及丙酸盐,不能还原硝酸盐。
2.3.3 16S rRNA基因序列测定及系统发育学分析 利用16S rRNA通用引物,以菌株5-1 DNA为模板进行PCR扩增,测序得到长度为1 373 bp的16S rRNA基因片段(登录号:MT378304)。将测序获得的序列在NCBI上进行核苷酸同源性比对,结果显示,其与暹罗芽孢杆菌B.siamensis的16S rRNA核苷酸序列同源性最高,达到99.7%。选取该种相关近缘种,采用邻接法构建系统发育树,菌株5-1与暹罗芽孢杆菌同聚一支,亲缘关系最近(图5)。因此,初步鉴定菌株5-1为芽孢杆菌属。
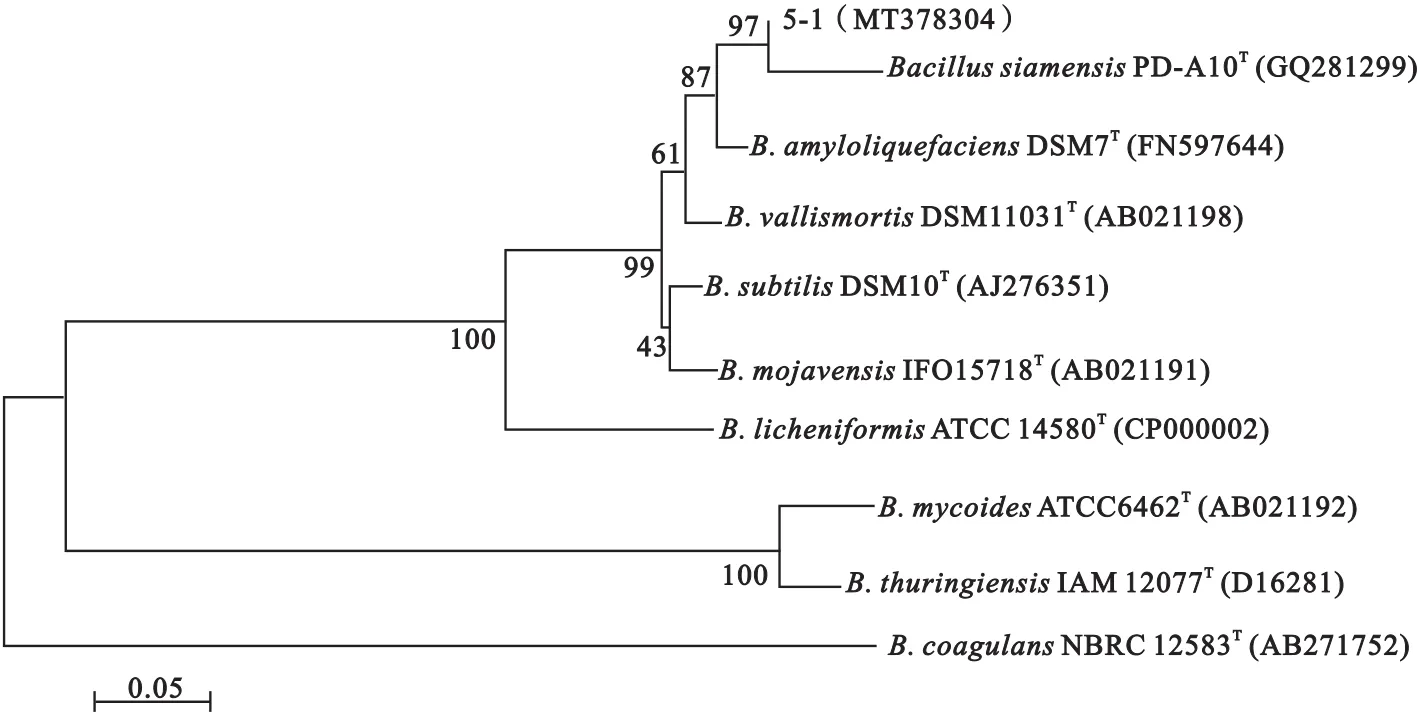
图5 菌株5-1的16S rRNA系统发育树Fig.5 16S rRNA phylogenetic tree of strain 5-1
3 结论与讨论
形态观察表明该细菌是革兰氏阳性菌,LB培养基上菌落呈淡黄色,不分泌黏液;生理生化试验结果表明该菌株能够在5~50℃温度范围内生长,能耐受14%的NaCl,这是区分暹罗芽孢杆菌与其他芽孢杆菌的重要特征[11]。此外,菌株5-1能够利用D-木糖,不能利用柠檬酸盐,这与Sumpavapol等人[12]的研究中对暹罗芽孢杆菌的描述一致;从系统发育树看,菌株5-1与B.siamensis、B.amylolique-faciens和死亡谷芽孢杆菌B.vallismortis的亲缘关系很近,而文献报道后面两者无法利用D-木糖,但可以利用柠檬酸盐[11]。通过形态观察、生理生化指标测定和分子生物学等技术手段,最终确定菌株5-1为暹罗芽孢杆菌。
目前核桃病害防治仍以化学防治为主,搭配育种及修枝、清落叶等营林措施[13],其中化学农药难免对生态环境造成破坏,育种及营造健康林分需要漫长周期,生物灾害突发时难以应对。生物防治技术因其见效快,对生态环境友好,满足食品安全需求等优点,近几年发展迅速。关于暹罗芽孢杆菌,前人已经报道过其拮抗真菌的特性,如对细极链格孢菌Alternaria tenuissima[14]、禾谷镰刀菌Fusarium graminearum[15]、尖孢镰刀菌Fusarium oxysporum[16]、粉红单端孢Trichothecium roseum和拟盘多毛孢Pestalotiopsis paeoniicola、半裸镰刀菌Fusarium semitectum、毁灭柱孢Cylindrocarpon destructans[17]等多种病原真菌均有一定的抑制活性。本研究中,菌株5-1能对7种核桃病原真菌产生抑菌作用,结合前人的相关研究表明,暹罗芽孢杆菌是一种潜力生防菌,抑菌能力强,抑菌谱广;菌株5-1经液体发酵后能够使病原真菌广布拟盘多毛孢的分生孢子及菌丝畸形,进而抑制其生长,菌群黏附性强,且抑菌能力稳定。这些特征表明其在核桃真菌病害生防领域具有广阔的应用开发前景。然而关于该菌株的研究才刚刚起步,要将其应用于核桃病害的生物防治还需对其代谢途径、功能机理等进行深入研究,同时还要开展大量的田间防效试验。
