硫酸化辣木多糖的制备及其抗氧化活性研究
2020-11-27许云华乔友志
许云华,周 旋,乔友志
(连云港师范高等专科学校海洋港口学院,江苏,连云港 222006)
辣木(Moringa oleifera Lam.),又名鼓植树、山葵树,属辣木科辣木属植物。这是一种有独特经济价值的热带植物,全株都有利用价值。辣木富含多种人体所需的维生素、蛋白质、矿物质、脂肪酸、多糖、抗营养因子、黄酮和多酚类化合物及氨基酸,可以作为天然营养食物材料。辣木不仅可以直接食用,而且经过加工处理后还可以制成保健品。辣木富含植物多糖(Polysaccharide),而植物多糖具有降血糖、降血压、降胆固醇,护心、护肝、治疗溃疡、抗炎抑菌、促进凝血、抗肿瘤[1]等药理作用,以及解热、利尿、止疼、预防心脏病等功效。植物多糖作为一种保健食品已经进入人们的实际生活,如黄芪多糖在调节免疫、抗病毒、抗衰老等方面具有重要的作用[2],因此辣木有非常广阔的经济开发前景。
多项研究显示,植物多糖经分子修饰后,其抗氧化活性和药理活性都有所增强;经过化学修饰后,其分子量的大小、空间结构及取代基会发生改变。植物多糖的硫酸化修饰是植物多糖分子修饰中应用较为广泛的一种修饰方法,许多植物多糖经过硫酸化修饰后不仅生物活性增强,抗病毒、抗肿瘤、抗免疫缺陷的效能也大为提高[3-4]。Jaiswal 和Yassa 等人发现辣木叶的水提取物含有降血糖有效成分[5-6]。Satish 等人的实验表明,辣木在经过热水浸提后提取出的辣木多糖具有抗突变活性[7]。Choudhary 等在实验中发现辣木多糖具有抗溃疡作用[8]。实验主要研究用热水浸提取法提取辣木中的植物多糖,并对提取到的辣木粗多糖进行硫酸化修饰,以研究其抗氧化活性。
一、实验材料与所用设备
(一)材料与试剂
材料:辣木叶(产地为云南保山,云南广昆堂农业科技有限公司)。
试剂:无水乙醇,95%乙醇,100%三氯乙酸(TCA),氢氧化钠,硫酸化试剂(正丁醇、硫酸铵、浓硫酸),硫酸钾,盐酸,氯化钡,明胶,硫酸亚铁,水杨酸,过氧化氢,Tris 盐酸缓冲溶液(Tris-HCl),焦性没食子酸。以上试剂均为国产分析纯。
(二)仪器与设备
CPA225D 分析天平(赛多利斯科学仪器北京有限公司),30B 万能粉碎机(无锡市中银机械制造有限公司),XMTD-204 恒温水浴锅(常州诺基仪器有限公司),岛津UV2550 分光光度计(日本岛津有限公司),低速离心机LD5-10(北京医用离心机厂),RE-52CS旋转蒸发器(上海亚荣生化仪器厂),SHB-Ⅲ循环水式多用真空泵(郑州长城科工贸有限公司),90-2 磁力搅拌器(上海申胜生物技术有限公司),VERTEX70红外光谱仪(德国BRUKER 公司),ALPHA1-4 型真空冷冻干燥机(德国CHRIST 公司)。
二、实验方法
(一)辣木多糖的提取
将辣木叶置于烘箱内,以80 ℃干燥,粉碎后过40 目筛。采用热水浸提法,称取500 g 辣木叶粉末,按料液比1∶20(g/mL)量取去离子水,置于烧杯中混合均匀,水浴温度80 ℃下提取2 次后将提取液合并;采取真空浓缩,将提取液浓缩至原体积的1/5。采用TCA 法去蛋白,以1∶10 比例将100%的TCA 加入到样品中,置于冰箱中冷藏沉淀1 h,离心取上清。醇沉后取上清液缓缓倒入95%乙醇,并且用玻璃棒缓缓搅拌,使乙醇浓度达到80%,经过滤、离心、干燥即为辣木粗多糖[9]。
(二)辣木多糖的硫酸化修饰
在冰浴条件下,锥形瓶中加入硫酸化试剂充分搅拌。将0.3 g 辣木多糖加入装有硫酸化试剂的锥形瓶中,0 ℃条件下搅拌直至多糖充分溶解。用浓度为2.5 mol/mL 的氢氧化钠调节,使溶液显中性(pH 值为7.0—8.0)。以离心法取沉淀加入透析袋透析,经48 h后减压浓缩体积,降低到原始体积的1/5。按照1∶3比例加入95%乙醇醇沉,然后取沉淀物以4000 r/min离心10 min,去除上清液,经真空冷冻干燥即为硫酸化辣木多糖。
(三)硫酸化辣木多糖的取代度测定
采用硫酸钡比浊法测定硫酸根离子含量[10]。分别吸 取0.02 mL、0.06 mL、0.10 mL、0.14 mL、0.18 mL、0.20 mL 的0.6 mg/mL 硫酸钾溶液加入试管,用浓度为1 mol/L 盐酸将六个试管补加至200 μl,再加入3%三氯乙酸3.8 mL 和0.5%氯化钡明胶溶液1.0 mL后充分混匀,静置10 min,在360 nm 波长处检测吸光度值A1,用明胶溶液测吸光度值A2,使用(A1-A2)对硫酸根的质量绘制标准曲线。
在100 ℃水浴下,用1 mol/L 盐酸与硫酸化辣木多糖制备2 mg/mL 储存液,4 ℃条件下保存,然后吸取0.2 mL 按标准曲线法测定A1、A2。根据测得的标准曲线计算硫酸基含量(S)并计算取代度(DS)。取代度的计算式为:
取代度(DS)=1.62×S/(32-1.02×S)
(四)单因素实验
固定称取辣木多糖0.3 g,取正丁醇3 mL。选取硫酸化制备反应时间、浓硫酸体积和硫酸铵添加量作为制备硫酸化辣木多糖单因素实验的考察因素。
1.反应时间对辣木多糖硫酸化效果的影响
固定取浓硫酸7.5 mL,硫酸铵用量为0.125 g,反应时间分别为20 min、30 min、1 h、1.5 h、2 h,测定取代度。
2.浓硫酸体积对辣木多糖硫酸化效果的影响
固定取硫酸铵0.125 g,反应时间为30 min,浓硫酸用量分别为2.5 mL、5 mL、7.5 mL、10 mL、12.5 mL,测定取代度。
3.硫酸铵用量对辣木多糖硫酸化效果的影响
固定取浓硫酸7.5 mL,反应时间30 min,硫酸铵用量分别为0.1 g、0.125 g、0.150 g、0.175 g、0.20 g,测定取代度。
(五)正交实验
根据单因素实验结果,选取硫酸化辣木多糖制备的反应时间、浓硫酸用量、硫酸铵用量作为考察因素,以取代度为指标,选取L9(34)正交表进行正交实验(见表1)。
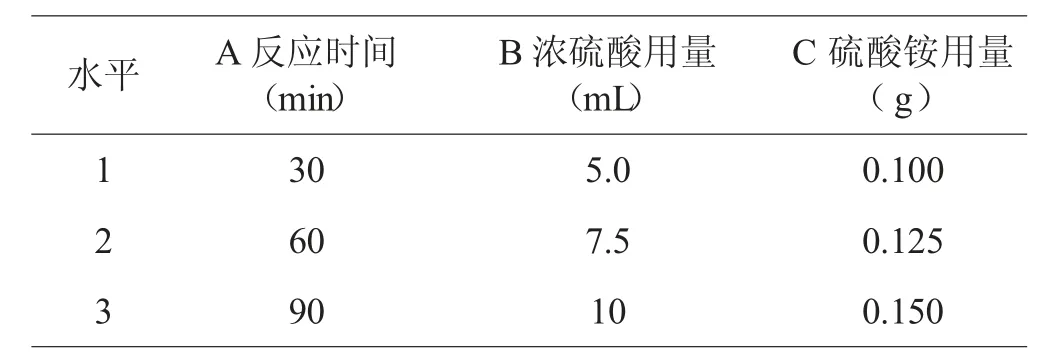
表1 因素水平表
(六)红外光谱检测
利用最优化条件制备硫酸化辣木多糖。分别取2 mg 辣木多糖和硫酸化辣木多糖,用研钵将多糖与溴化钾充分研磨混合后压片,在4000 cm-1—400 cm-1区间内对辣木多糖和硫酸化辣木多糖进行红外光谱检测。
(七)抗氧化活性测定
取正交试验最优条件下制得的硫酸化辣木多糖,测定其抗氧化活性。
1.羟基自由基(·OH)的清除率测定
取4 个干净的试管,分别加入浓度为0.2 mg/mL、0.4 mg/mL、0.6 mg/mL、0.8 mg/mL 的样品溶液各1 mL,再加入1 mL 的6 mmol/L 硫酸亚铁,1 mL 的6 mmol/L水杨酸,最后加入1 mL 的6 mmol/L 过氧化氢启动反应,摇动试管使溶液混合均匀。置于37 ℃水浴下反应1 h,然后于510 nm 处测定不同浓度样品及对照组吸光度值(对照组以蒸馏水代替多糖样品溶液)[11]。对照组吸光度值记为Ai,样品吸光度值记为Aj[12]。清除率计算式为:
清除率(%)=[(Ai-Aj)/Ai]×100%
2.超氧阴离子自由基(O2-·)的清除率测定
分别取浓度为0.2 mg/mL、0.4 mg/mL、0.6 mg/mL、0.8 mg/mL 的样品溶液各1 mL 加入到试管中,分别加入0.05 mol/L 的Tris-HCl 缓冲液(pH8.0)4.0 mL,震荡摇匀,然后置于25 ℃水浴锅中反应20 min;加入2.5 mmol/L 的焦性没食子酸溶液0.4 mL,使内容物混合均匀,置于25 ℃水浴条件下充分反应3 min;再加入2 mol/L 盐酸1.0 mL 终止反应[13]。在325 nm 处测定吸光度,对照组吸光度值记为Ai,样品吸光度值记为Aj[14]。清除率计算式为:
清除率(%)=[(Ai-Aj)/Ai]×100%
3.二苯代苦味酰基自由基(DPPH·)的清除率测定
取5 个试管,分别加入20μl、40μl、60μl、80μl、100 μl 浓度为1.01×10-1mg/mL 的DPPH·溶液,加多糖溶液至4 mL,充分混匀。样品组:3.5 mL浓度为0.1 g/L二苯代苦味酰基自由基的50%乙醇溶液,0.5 mL样品溶液。对照组:3.5 mL 浓度为0.1g/L 二苯代苦味酰基自由基的50%乙醇溶液,0.5mL 蒸馏水。空白组:3.5 mL无水乙醇,0.5 mL 样品溶液[15]。将样品对应溶液分别加入10 mL 试管中,密封,充分混匀,静置30 min,于波长517 nm 处测定吸光度,空白对照组的吸光度值记为Ai,样品溶液的吸光度值记为Aj[16]。清除率计算式为:
清除率(%)=[(Ai-Aj)/Ai]×100%
三、结果与分析
(一)单因素实验
1.硫酸基标准溶液标准曲线
绘制硫酸基标准溶液标准曲线,详见图1。标准回归方程:y=1.2735x+0.0415;相对系数:R2=0.9959。
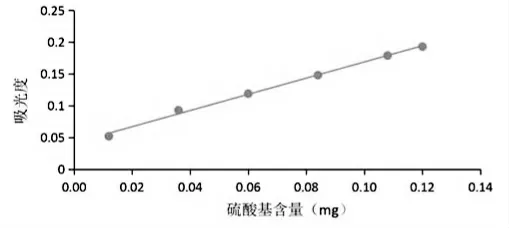
图1 硫酸基标准曲线图
2.反应时间对硫酸化效果的影响
随着反应时间的增加,硫酸化辣木多糖的取代度显著变大。反应30 min 时硫酸化辣木多糖的取代度达到最大值,为0.56;反应时间大于30 min 时,取代度减小(见图2)。数据表明,适当增加反应时间,取代度会增大,但反应时间长于30 min 时,取代度会降低。这可能是由于反应时间过长,造成一部分硫酸化多糖的硫酸基游离出来[17],导致取代度降低。因此,选择最适合辣木多糖硫酸化反应时间30 min,继续后续实验。
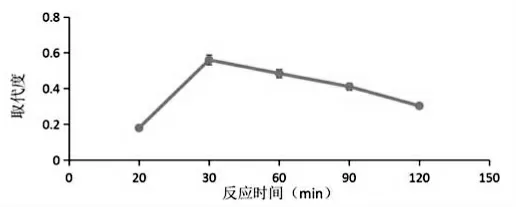
图2 反应时间对取代度影响
3.浓硫酸体积对硫酸化效果的影响
反应开始后,当浓硫酸体积为2.5 mL 至7.5 mL时,取代度呈上升趋势。当浓硫酸的体积为7.5 mL时,取代度达到最高值,为0.413;当浓硫酸体积超过7.5 mL 时,取代度降低(见图3)。原因可能是由于浓硫酸过多,多糖结构遭到破坏[17],导致取代度降低。在这个实验中,浓硫酸的最适体积为7.5 mL。
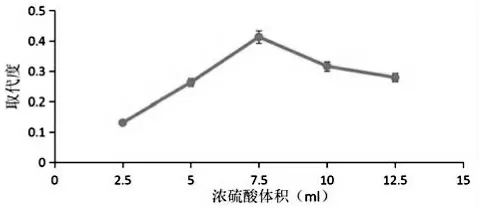
图3 浓硫酸体积对取代度的影响
4.硫酸铵用量对硫酸化效果的影响
反应开始后,硫酸铵用量为0.1 g—0.125 g 时,取代度呈上升趋势,当硫酸铵添加量为0.125 g 时,取代度达最大值0.631,继续加大硫酸铵用量,取代度则下降(见图4)。因此,硫酸铵的最佳添加量为0.125 mg。

图4 硫酸铵用量对取代度的影响
(二)正交实验
在单因素实验的基础上,按表1 进行正交实验,结果见表2。由表2 极差分析可知RC>RA>RB,即硫酸铵用量对辣木多糖的硫酸化影响最大,反应时间和浓硫酸体积对硫酸基取代度的影响相对较小,最优条件组合是A1B2C2,即硫酸化辣木多糖的制备反应时间为30 min,浓硫酸加入量为7.5 mL,硫酸铵添加量为0.125 mg,在此条件下取代度为0.535。
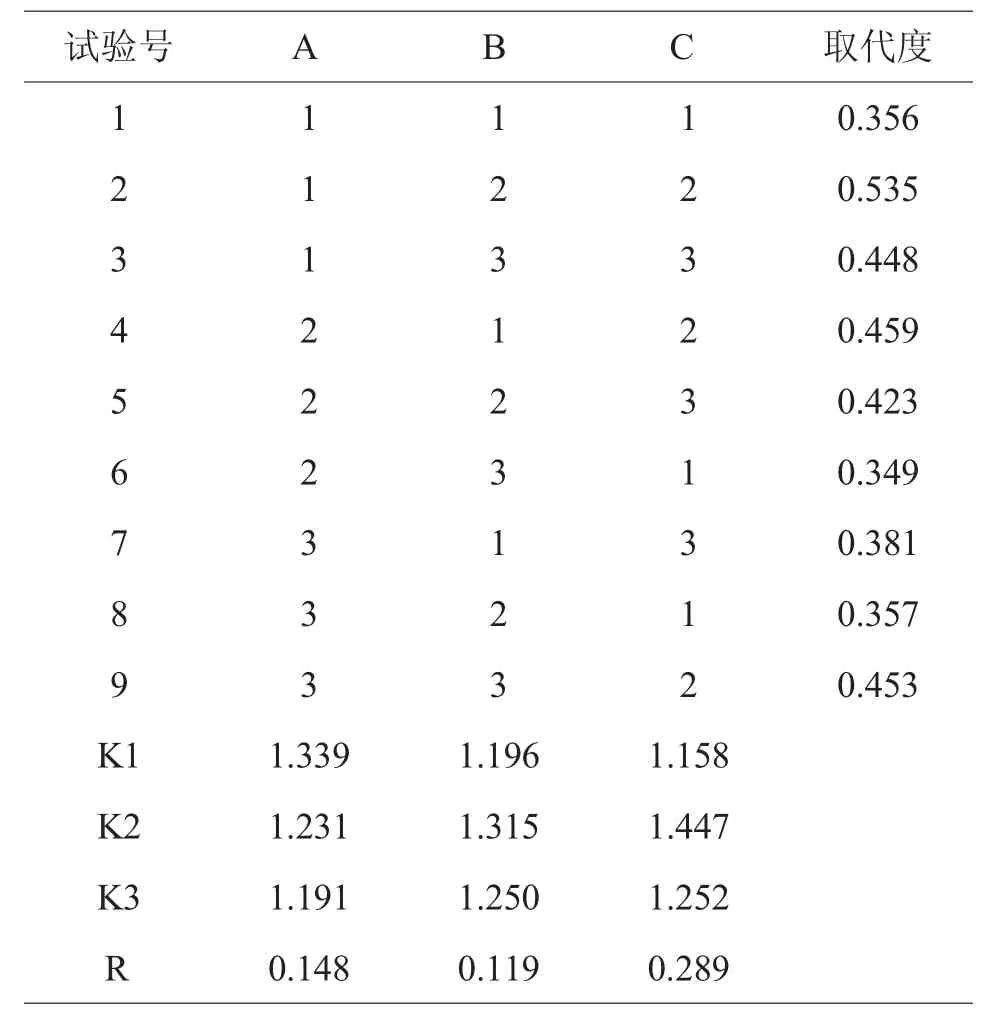
表2 正交实验结果
(三)红外光谱检测
辣木多糖及硫酸化辣木多糖红外光谱结构表征见图5。在3450 cm-1出现O-H 伸缩针对吸收峰,羟基与浓硫酸发生反应,导致硫酸化辣木多糖在此处O-H 的羟基峰明显减弱。与辣木多糖相比,硫酸化辣木多糖出现3 个新特征峰,在1240 cm-1和1150 cm-1处均形成了S=O 特征峰,C-O-SO3的伸缩振动引起810 cm-1处出现特征峰,由此可初步判断硫酸化修饰是成功的[18]。
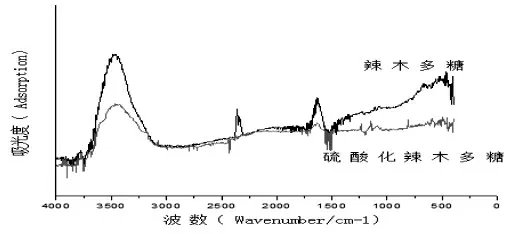
图5 辣木多糖及硫酸化辣木多糖的红外谱图
(四)抗氧化活性测定
1.羟基自由基(·OH)的清除率
随着多糖溶液浓度的增大,清除率不断提高,硫酸化辣木多糖对·OH 的最大清除率为79.8%,比未经硫酸化多糖的最大清除率(56.29%)提高了23.51%(见图6)。实验表明,硫酸化后的辣木多糖清除·OH的能力远远高于未经硫酸化的辣木多糖。
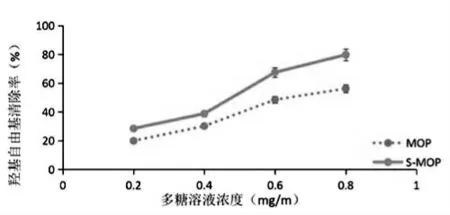
图6 羟基自由基(·OH)的清除率
2.超氧阴离子自由基O2-·的清除率
随着多糖浓度升高,辣木多糖及硫酸化辣木多糖对O2-·的清除率逐渐增大。糖浓度为0.8 mg/mL 时,硫酸化的辣木多糖对O2-·的清除率提高了33.32%(见图7)。实验表明,硫酸化后的辣木多糖清除O2-·的能力远远高于未经硫酸化的辣木多糖。
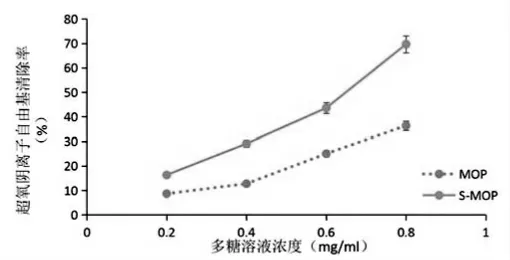
图7 超氧阴离子自由基(O2-·)的清除率
3.二苯代苦味酰基自由基(DPPH·)清除率
随着多糖浓度的升高,辣木多糖和硫酸化辣木多糖对DPPH·清除率都增大,经过硫酸化的辣木多糖对苯代苦味酰基自由基的最大清除率为65.79%,比未硫酸化的多糖的最大清除率51.23%提高了14.56%(见图8)。实验表明,硫酸化后的辣木多糖清除DPPH·的能力比辣木多糖稍有提高。
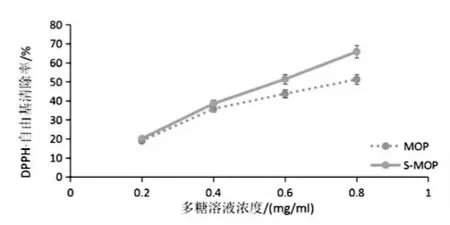
图8 DPPH·自由基清除率
综上,随着多糖浓度的升高,硫酸化辣木多糖活性较辣木多糖增强,可能是硫酸化修饰伸展了多糖的支链,致使多糖·OH 因暴露而改变了亲水性,在水溶液中溶解度增强,抗氧化活性也得到增强。邵力成等人[19]的研究表明,海洋真菌多糖硫酸化的活性随着硫酸基取代度的增加而增强,但王雁等人[20]的虎奶多糖研究表明,硫酸化多糖的取代度高,抗氧化活性不一定强。因此,硫酸化多糖的抗氧化活性不仅与取代度有关,而且与硫酸基取代位置及其空间结构有关。至于修饰多糖的位置以及空间构象不明确等问题,则有待进一步研究。
四、结论
红外谱图对比表明,用浓硫酸、正丁醇以及硫酸铵作为硫酸化试剂,对辣木多糖进行硫酸化结构修饰是可行的。硫酸化辣木多糖制备最优条件为:反应时间30 min,浓硫酸体积7.5 mL,硫酸铵用量0.125 g,在此条件下硫酸化辣木多糖的取代度是0.535。经过硫酸化后的辣木多糖对羟基自由基、超氧阴离子自由基、二苯代苦味酰基自由基的清除率都有明显提高。可见,硫酸化修饰可以增强辣木多糖的抗氧化活性。
